Av Per Morten Sandset, Oslo universitetssykehus, Avdeling for blodsykdommer
Disseminert intravaskulær koagulasjon (DIC) er en alvorlig komplikasjon til en rekke kliniske tilstander. Diagnostikken har så langt vært usikker, men kan bedres ved et enkelt skårsystem som baseres på erkjennelse av klinisk tilstand forenlig med DIC og skåring av blodplatetall, fibrin, protrombintid (INR) og fibrinogen. Skårsystemet bør tas i bruk ved norske sykehus.
Disseminert intravaskulær koagulasjon (DIC) innebærer en ekstrem form for aktivering av koagulasjonssystemet, se (1) for oversikt. Fellesnevneren er frigjøring av vevsfaktor («tissue factor», TF) til sirkulerende blod. TF er et membranbundet protein som produseres konstitutivt i ekstravaskulære celler, blant annet fibroblaster og gliaceller, men produseres normalt ikke inne i blodbanen. TF danner en kappe rund alle blodårer, men ved karskade vil TF eksponeres til blodet og bindes til koagulasjonsfaktor VII. Dette trigger koagulasjonen og fører til dannelse av trombin. Koagulasjonshemmerne antitrombin, protein C, protein S og tissue factor pathway inhibitor regulerer aktiveringen av koagulasjonen nøye. Ved mindre skader og traumer er denne kontrollerte aktiveringen av blodkoagulasjonen tilstrekkelig til å sikre adekvat hemostase, men ved mer alvorlige skader og traumer blir aktiveringen for kraftig og det oppstår varierende grad av ukontrollert DIC.
I visse situasjoner, blant annet ved alvorlig infeksjon/sepsis og ved kreft, kan TF også produseres av monocytter i blodbanen etter stimulering med ulike cytokiner. Ved liten produksjon av TF , som trolig skjer i forbindelse med dagliglivets mindre og banale infeksjoner, vil aktiveringen av blodkoagulasjonen være avgrenset, men ved mer alvorlige infeksjoner vil det dannes så mye TF at regulatorsystemene ikke er tilstrekkelige for å hindre utvikling av DIC. En rekke kliniske tilstander er assosiert med utvikling av DIC – se tabell 1. Dette gjelder som nevnt sepsis og alvorlige infeksjoner, kreft og traumer/skader. I tillegg kan organdestruksjon (for eksempel pankreatitt), obstetriske komplikasjoner, karveggssykdom, alvorlig leversvikt og toksiske og immunologiske reaksjoner forårsake DIC.
 Ukontrollert aktivering av koagulasjonssystemet fører til fibrindannelse og fibrinnedslag i mindre og mellomstore arterier som kan gi kompromittert organsirkulasjon og trombose med redusert organfunksjon, typisk redusert lever-nyrefunksjon og påvirkning av mentale funksjoner – se figur 1. Den vedvarende aktiveringen vil etter hvert føre til forbruk av blodplater og koagulasjonsfaktorer. Dette kalles forbrukskoagulopati og kan føre til blødning. En og samme pasient kan derfor være både blødnings- og trombosetruet. Dette karakteriserer det kliniske bildet ved DIC.
Ukontrollert aktivering av koagulasjonssystemet fører til fibrindannelse og fibrinnedslag i mindre og mellomstore arterier som kan gi kompromittert organsirkulasjon og trombose med redusert organfunksjon, typisk redusert lever-nyrefunksjon og påvirkning av mentale funksjoner – se figur 1. Den vedvarende aktiveringen vil etter hvert føre til forbruk av blodplater og koagulasjonsfaktorer. Dette kalles forbrukskoagulopati og kan føre til blødning. En og samme pasient kan derfor være både blødnings- og trombosetruet. Dette karakteriserer det kliniske bildet ved DIC.
Klinisk diagnostikk av DIC er usikker og må relateres til tilstander som er kjent for å kunne utvikle DIC – se tabell 1. Laboratoriediagnostikk ved DIC har over flere tiår vært gjenstand for omfattende diskusjon i det internasjonale fagmiljøet, men fortsatt finnes det ikke en enkelt laboratorietest som kan påvise eller utelukke DIC. I stedet må diagnostikken bygge på det kliniske bildet og kombinasjon av flere laboratorietester. Det er viktig å huske på at DIC ofte er en svært dynamisk tilstand og at eventuelle laboratorietester vil reflektere dette.
I 1995 ble det i Japan utviklet et skårsystem («Japan Ministry of Health and Welfare Score») for å påvise DIC (2). Dette ble videreutviklet av det internasjonale tromboseselskapet (International Society on Thrombosis and Haemostasis) (3) og senere validert (4) – se figur 2. Dette skårsystemet bygger på erkjennelse av en klinisk tilstand assosiert med DIC – se tabell 1. Dersom det ikke foreligger en slik klinisk tilstand, har ikke pasienten DIC. Dersom pasienten har en underliggende tilstand forenlig med DIC, skal en analysere 4 parametre; blodplatetall, en fibrinmarkør, protrombintid og fibrinogen – se figur 2. Platetall vurderes i forhold til cut-off verdier på henholdsvis 50 og 100·109/L med skår 0 når platetall >100·109/L, skår 1 for verdier mellom 50 og 100·109/L og skår 2 for verdier <50·109/L. Fibrinogen skåres i forhold til verdier under (skår 1) eller over (skår 0) 1 g/L. Fibrinmarkør klassifiseres som negativ (skår 0), moderat (skår 1) og sterkt positiv (skår 2). I Norge brukes i praksis kun D-Dimer test som markør for fibrin. For Sta-Liatest (Stago) som brukes ved de fleste sykehus, er verdi under 0.5 µg/L negativ, verdi 0.5-4.0 µg/L moderat positiv og >4.0 µg/L sterkt positiv. Den siste parameteren er protrombintid. I Norge rapporteres ikke protrombintid selv om den inngår i INR. Omregnet tilsvarer en protrombintidforlengelse på inntil 3 sekunder til INR<1.3 og inntil 6 sekunder til INR<1.6. INR cut-off kan dermed brukes i skår – se figur 2. Ved skår ≥5 poeng har pasienten DIC. En bør fortsette å vurdere pasientens skår daglig. Ved skår <5 har pasienten ingen sikker DIC, men en bør likevel fortsette ”å skåre” 1-2 dager for å se om det utvikler seg til DIC.
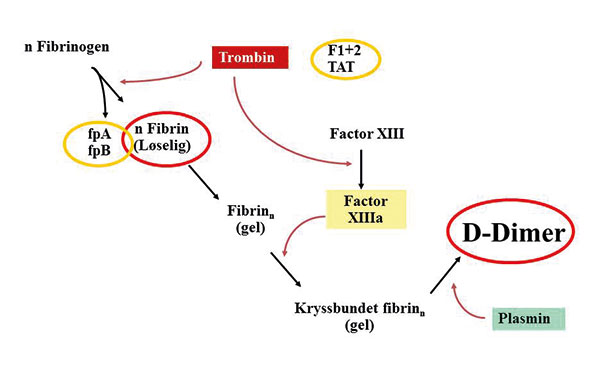
Figur 3 – Biomarkører på aktivert koagulasjon. Trombin spalter fibrinogen slik at det dannes løselig fibrinmonomer. Påvisning av fibrinmonomer er en spesifikk test for aktivert koagulasjon, men så langt er det ikke utviklet gode nok tester for klinisk diagnostikk. Fibrinmonomer polymeriserer spontant til ikke-løselig fibrin som feller ut som en gel. Disse fibrintrådene kryssbindes av aktivert faktor XIII. Fibrinet spaltes til fibrin degradasjonsprodukter. D-Dimer er et spesifikt degradasjonsprodukt av kryssbundet fibrin. Påvisning av D-Dimer forteller at koagulasjonen har vært aktivert og det er en pågående fibrinolyse. Protrombinfragment 1+2 (F1+2) er et fragment som dannes fra protrombin når protrombin aktiveres til trombin og forteller at det er pågående trombingenerering. Trombin-antitrombin kompleks (TAT) dannes når antitrombin inaktiverer trombin og forteller noe om dannet trombin. Fibrinopeptid A og B (fpA og fpB) er små peptider som spaltes av fra fibrinogen og forteller noe om fibrindannelse. F1+2, TAT og fpA og B brukes vesentlig i forskningsøyemed.
ISTH DIC skår er trolig et svært nyttig skåringssystem som bør brukes ved kliniske avdelinger og intensivenheter (5). Blant annet ser det ut til at ISTH DIC skår kan være prediktiv med hensyn til hvilke pasienter som vil respondere på behandling med koagulasjonshemmer (6), men dette må imidlertid bekreftes i nye studier.
Det finnes også andre markører som kan være av betydning for å påvise DIC. Flere av disse testene er først og fremst egnet til forskningsformål – se figur 3 for detaljer. Trombelastografi er en annen test med klinisk potensiale og brukes i økende grad pasientnært på intensivavdelinger, men det er foreløpig ikke dokumentert om denne kan gi tilleggsinformasjon eller erstatte ISTH DIC skår.
Konklusjonen er at ISTH DIC skår er et enkelt og verdifullt skåringssystem for DIC som nå må tas i bruk ved norske sykehus.