Av Eivind S. Platou, Thomas M. Knutsen og Torkel Steen. Pacemaker- og ICD-senteret, Oslo Universitetssykehus, Ullevål
Pacemaker- og ICD-innleggelser kan føre til komplikasjoner som infeksjon og ledningsbrudd. Dette krever spesialisert behandling. Antallet ekstraksjoner er økende, både pga økende antall pacemaker- og ICD-pasienter, og fordi flere sentre har blitt klar over at tilbudet finnes. Med god operatørerfaring er suksessraten meget høy og komplikasjonene få. Vi ser en gledelig tendens til at pasienter blir henvist tidligere, slik at det blir færre omfattende inngrep med multiple gamle elektroder fra begge sider. Det vil likevel komme nye utfordringer, og vi tror elektroder i sinus coronarius vil være en av dem.
Det ble i 2010 implantert 2424 nye pacemakere og foretatt 673 generatorbytter i Norge1. Det ble lagt inn 546 hjertestartere (ICD) og gjort 231 ICD generatorbytter. Av dette var 160 biventrikulære pacemakere (CRT-P) og 166 biventrikulære ICD’er (CRT-D). Samlet ble det innlagt ca. 550 ICD-elektroder og 4800 ”vanlige” elektroder. Hvis man forsiktig regner med 2 % infeksjoner, blir det nærmere 80 per år. Infeksjonsraten er imidlertid vesentlig høyere etter generatorskifte og ved innleggelse av biventrikulære pacemakere og ICD’er. I tillegg kommer andre elektrodekomplikasjoner. Antallet implantasjoner og generatorbytter er raskt økende (fig. 1). ICD-pasienter lever lenger med sin ICD enn pacemakerpasienter med sin pacemaker, (gjennomsnittsalder for pacemakerpasienter er nesten 80 år, og ca. 15 – 20 år mindre for ICD-pasienter). Ettersom levetiden for pacemakerelektroder i gjennomsnitt er 20 år, og ICD elektroder 10 år, samt at det er serier med kortere levetid, blir diagnose og behandling av elektrodeproblemer stadig viktigere. Her tar vi for oss problemer med infeksjoner og mekaniske skader som kan oppstå.
Er det problemer med pacemakerlommen, må man tenke på infeksjon. Pacemakerinfeksjoner opptrer generelt sent. Det kan ta 8-10 år fra implantasjon til infeksjon oppstår. Symptomene kan være diffuse og mange2, så som smerter og migrasjon av generator. Typiske funn er inndragning og rubor/misfarging over generator/ledning. Ved perforasjon er diagnosen åpenbar (figur 2). Infeksjonsparametrene er oftest (nesten) normale. Er det klart økede infeksjonsparametere og pasienten har feber, frysninger etc., bør man alltid mistenke endokarditt. Ved slik mistanke skal det tas blodkulturer og gjøres TØE (transøsofageal ekkokardiografi), da diagnosen kan være vanskelig.
 Infeksjoner etter generatorbytte skyldes antagelig ofte bakterier fra den første implantasjonen, som ”friskes opp” med ny næring2,3. Slike ”sene infeksjoner” skyldes oftest koagulase negative stafylokokker, KNS-bakterier4, altså normale hudbakterier. De koloniserer raskt hele elektroden. KNS-bakterier er vanskelige å dyrke. Aspirasjonsprøve gir sjelden oppvekst og anbefales ikke i ”guidelines”5. Dyrkning fra fistler gir usikkert resultat pga forurensing, og er derfor heller ikke nyttig. Tidlige infeksjoner (< 1 mnd.) er sjeldnere, og skyldes oftere gule stafylokokker. Mikrobiologisk diagnose fås best ved dyrkning av biopsi fra kapselvev tatt peroperativt.
Infeksjoner etter generatorbytte skyldes antagelig ofte bakterier fra den første implantasjonen, som ”friskes opp” med ny næring2,3. Slike ”sene infeksjoner” skyldes oftest koagulase negative stafylokokker, KNS-bakterier4, altså normale hudbakterier. De koloniserer raskt hele elektroden. KNS-bakterier er vanskelige å dyrke. Aspirasjonsprøve gir sjelden oppvekst og anbefales ikke i ”guidelines”5. Dyrkning fra fistler gir usikkert resultat pga forurensing, og er derfor heller ikke nyttig. Tidlige infeksjoner (< 1 mnd.) er sjeldnere, og skyldes oftere gule stafylokokker. Mikrobiologisk diagnose fås best ved dyrkning av biopsi fra kapselvev tatt peroperativt.
”Erosjon” er alltid tegn på infeksjon, og skal behandles som det. ”Revisjon” og antibiotika kan bare gi en utsettelse. Det kan ta måneder (eller år) til man får nytt oppbluss. Infeksjonen er imidlertid ikke fjernet.
De gjeldende retningslinjene fra 20096 angir helt klart at ved erosjon eller annen mistanke om infeksjon, skal generator og alle elektroder fjernes, heller før enn siden. Antibiotika er bare aktuelt som forberedelse til operasjon og for pasienter hvor et inngrep er kontraindisert.
Et annet problem vi ser er at venene, hvor elektrodene ligger, tenderer til å okkludere efterhvert, som følge av at elektroden reagerer med omkringliggende vev med dannelse av adheranser, arrvev og av og til forkalkninger. Tendensen øker med antall elektroder i venen. Mest uttalt er denne reaksjonen hos yngre individer.
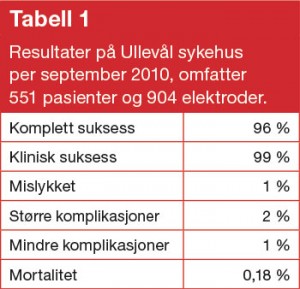
Figur 2. Fire “stadier”: a) inndragning i huden b) truende perforasjon
c) perforasjon d) generator helt ute av lommen.
Etter retningslinjene antas ekstraksjon å være en trygg prosedyre, forutsatt at operatør har gjort minst 40 ekstraksjoner veiledet av erfaren (som selv har utført minst 75 ekstraksjoner) operatør. Hver operatør skal ha minst 20 årlige prosedyrer for å vedlikeholde kompetansen, og institusjonen skal ha et kvalitetsregister som viser at komplikasjonsrisikoen er på nivå med resultater fra gode sentre6,7. Ellers blir forholdet mellom risiko og nytte for stort.
Klasse I indikasjon for ekstraksjon har man ved sikker systemisk eller lokal infeksjon, vena cava- eller bilateral subclavia-okklusjon, og ved unilateral subclavia-okklusjon når det er behov for ytterligere én eller flere elektroder og det er kontraindikasjon for bruk av motsatt side. Klasse IIa indikasjon har man ved subclavia-okklusjon når det ikke er kontraindikasjon for bruk av motsatt side. Dessuten hvis gjenværende elektroder kan gi livstruende arytmier, interferere med pacemaker- eller ICD-funksjonen (for eksempel defekt, etterlatt ICD-elektrode) eller gi problemer ved behandling av malignitet (f.eks. ved stråling av lunge- eller mammacancer, hvor anlegget må flyttes til motsatt side).
Klasse IIb indikasjoner inkluderer, i tillegg til okkludert vene, blant annet persisterende gram negativ bakteriemi, kroniske smerter i lommen eller ved innstikkstedet (de fleste av disse vil sannsynligvis også kunne kategoriseres som infeksjon). Dessuten etterlatte, fungerende elektroder som potensielt kan innvirke på funksjonen til det aktive systemet, elektroder som fungerer, men ikke er i bruk, elektroder som forhindrer en pasient i å ta en absolutt nødvendig MR og ikke-fungerende elektroder hos en pasient som uansett skal gjennom en pacemaker- eller ICD-prosedyre og hvor det ikke er kontraindikasjoner til ekstraksjon.
Pasientene må selvfølgelig vurderes individuelt, i lys av guidelines. Alder og forventet levetid, både på pasient og elektroder, kan være avgjørende. Vi synes f.eks. at okkludert vene er en god indikasjon for å ekstrahere en eller flere elektroder når det er indikasjon for oppgradering til tokammer pacemaker, ICD- eller CRT. Hos pasienter med lang forventet levetid er det uheldig med elektroder fra begge sider. En senere infeksjon i et anlegg med elektroder fra begge sider gir en vanskelig situasjon. Hos unge voksne anbefaler vi å ”rydde opp underveis”, dvs. ekstrahere elektroder som er ute av bruk, når man likevel skal gjøre generatorbytte. Elektroden(e) må trolig ut senere uansett, og det blir da vesentlig vanskeligere. Flere enn fire elektroder er det som oftest ikke plass til. Økende antall elektroder gir økt risiko for veneokklusjon. Vi anbefaler ikke to ICD-elektroder ved siden av hverandre. Som hovedregel bør defekte ICD-elektroder ekstraheres før de blir for gamle og vanskelige å få ut. Vi foretrekker som hovedregel også å ekstrahere en ICD-elektrode av en modell som har overhyppighet av elektrodebrudd (som Sprint Fidelis) ved generatorbytte, selv om den fungerer (uoffisiell klasse IIb indikasjon, Boston 2009). Pasientens alder og komorbiditet må selvsagt tas med i vurderingen.
Pasienten tas inn dagen før ekstraksjonen til klinisk vurdering, samtale, pacemakerkontroll, ekko, rtg. thorax og blodprøver med typing/screening. Ved ekko er fokus på elektrodens forløp gjennom trikuspidalklaffen. Ved mistanke om endokarditt må det gjøres transøsofagusekko. Hvis elektroden har grodd fast i klaffeapparatet, hvis det er større trikuspidalinsuffisiens eller hvis det er aktuelt med kirurgi på klaffen, må åpen kirurgi vurderes. Ved kirurgi på trikuspidalklaffen legges epikardiell(e) elektrode(r).
Ikke sjelden avslører rtg. thorax flere elektroder enn det som står i henvisningen. Pasienten kan ha forholdt seg til flere sykehus gjennom årene, og informasjon ha blitt borte underveis, eller det kan ha vært gjort ekstraksjonsforsøk der hele eller deler av elektrodene er etterlatt.
Det kan også ha vært gjort revisjoner som har gjort forholdene i lommen unødig vanskelige. Slikt gjør ekstraksjon ekstra vanskelig. Vi foretrekker å få henvist pasienten tidlig, fremfor at andre gjør gjentatte revisjoner selv. Det er svært viktig at alle operasjonsbeskrivelser sendes med. Før prosedyren må vi vite om pasienten er virkelig pacemakeravhengig.
Pasienten får ofte en akseptabel egenrytme hvis det gis Nuelin 250-350 mg x 2 fra dagen før. Vanligvis unngås temporær elektrode, selv ved totalt AV-blokk. Hvis ikke Nuelin er tilstrekkelig, gis Isoprenalin. I noen få tilfeller velger også vi å legge temporær elektrode.
Det må være utstyr og personell tilgjengelig for rask thoracotomi (innen 5 – 10 min) hvis større komplikasjoner oppstår.
Etter to ukers antibiotikabehandling preoperativt, lages først et båtsnitt rundt det gamle arret. Lommen og alt infisert vev fjernes, noe som ofte er tidkrevende. Det tas biopsi fra vevet rundt generator/elektrode til dyrkning.
Elektroden kappes og sikres med innvendig låsewire, og vi legger en kraftig ligatur proksimalt, slik at vi får drag både distalt og proksimalt.
Vi fører en tynn plasthylse påmontert et håndtak over elektroden for å frigjøre den fra vevet omkring. Under clavicula har elektroden av og til grodd fast i benet. Andre problemområder er overgangen brachocephalica/cava og selve innvoksingen i hjerteveggen. Ved ”frittflytende elektroder”, eller der hvor fullstendig ekstraksjon fra subclavia ikke er mulig, må elektroden ekstraheres fra lysken eller jugularis (figur 3).
Vi bruker aldri heparin ved ekstraksjoner, og LMWH, for eksempel Fragmin, seponeres minst ett døgn i forveien. Vi har gjort mange inngrep på kombinasjonen Albyl/Plavix uten store problemer, men kan én eller begge nulles ut noen dager uten uakseptabel risiko, foretrekker vi det. Ved kunstig ventil beholder vi Marevan og doserer slik at INR ligger mellom 2 og 2,5 operasjonsdagen, Dermed kan vi unngå Fragmin, som nå frarådes ved alle typer pacemaker- og ICD-kirurgi, pga. blødningsrisiko.
Etter infeksjonsbetingede ekstraksjoner, legger vi inn vakuumdren. Såret lukkes i tre lag. Orienterende ekko gjøres på operasjonsstuen etter inngrepet, for å utelukke perikardvæske. To dager senere legges et nytt anlegg på motsatt side. Pasientene får så 4 uker med antibiotika, to uker iv etter at nytt anlegg er på plass og ytterligere to uker peroralt. Håndtering av infiserte anlegg ble beskrevet i Hjerteforum i 20089. Hvis det kun har vært utført ukomplisert ekstraksjon uten infeksjon, vil pasienten som hovedregel kunne skrives ut påfølgende dag når ny elektrode/nytt anlegg er kontrollert. Dersom (lednings-)endocarditt var indikasjonen, skal nytt anlegg kun implanteres ved meget god indikasjon, og implantasjonen utsettes så lenge som mulig, for å redusere risikoen for reinfeksjon.
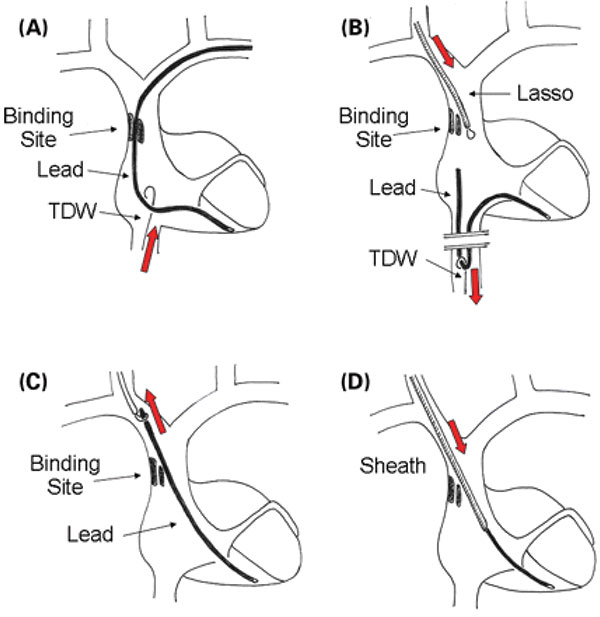
Figur 3. “The Pisa approach”. Elektroden fiskes ned fra subclavia/brachocephalica (A), man går ned med slynge fra jugularis (B), trekker elektroden opp i jugularis (C) og går til slutt over elektroden med hylse (D)8.
Den ”vanligste” alvorlige komplikasjonen er tamponade. Da kan det være behov for akutt kirurgi i løpet av minutter. Men en blødning kan også være mindre uttalt, gi et mindre dramatisk forløp og behandles med pericardiocentese. Perforasjon av stor vene, særlig cava superior, er en fryktet komplikasjon, men vi har ikke sett dette hittil. Andre komplikasjoner er lungeembolisme, sjokk, død og respirasjonsstans. Komplikasjonsrisikoen er svært avhengig av erfaring og proserdyrevolum hos både operatør og senter, og trenden internasjonalt er derfor å sentralisere disse operasjonene.
Artikkelen er en noe omarbeidet utgave av en artikkel i Hjerteforum nr. 2 2011