Av Birgitte Strømme Jensen og Inger Anne Finholt, medisinstudenter ved Universitetet i Bergen
Endoskopisk ultrasonografi (EUS) er en undersøkelsesmetode som blant annet kan brukes til å angi en tumors infiltrasjonsdybde og påvise lokale lymfeknutemetastaser ved kreft i spiserøret. På bakgrunn av dette bestemmes T- og N-stadium. To legestudenter ved UiB har undersøkt samsvar mellom tumorstadium bestemt ved EUS før behandling og tumorstadium funnet ved kirurgi og histopatologisk undersøkelse ved spiserørskreft.
Kreft i spiserøret utgjør 1% av alle kreftformer, og er en relativt sjelden kreftform i Norge. Forekomsten har i mange år vært relativt stabil med omkring 200 pasienter per år og en gjennomsnittsalder på 70 år. Kreftformen opptrer hyppigere hos menn (ca ¾) enn hos kvinner (ca ¼). Kreft i spiserøret klassifiseres oftest som plateepitelkarsinom eller adenokarsinom. Adenokarsinom er nå den vanligste typen kreft i spiserøret i den vestlige del av verden1.
Kreft i spiserøret på et tidlig stadium kan ofte behandles kurativt og har en god prognose (5-års overlevelse ca 90%). Mer langtkommet stadium responderer imidlertid mye dårligere på behandling. Korrekt stadieinndeling av ondartede svulster i øsofagus er viktig for å kunne tilby den enkelte pasient riktig behandling i forhold til sykdommens utbredelse. Dersom en svulst er i et tidlig stadium, vil primær kirurgisk kurativ reseksjon være mulig. Dersom man imidlertid oppdager lymfeknutemetastaser eller innvekst i de dypere vegglag, vil førstevalget som regel være stråling og kjemoterapi for å krympe svulsten før man eventuelt kan gå videre med kirurgi.
Endoskopisk ultrasonografi (EUS) gjør det mulig å studere små organstrukturer og vegglag i og omkring gastrointestinal-(GI-)traktus2. Kort avstand mellom UL-proben og målorganet tillater bruk av høye UL-frekvenser som dermed gir god bildeoppløsning.
EUS er beheftet med få komplikasjoner og tolereres godt av de fleste pasientene. EUS gir informasjon om både GI-veggens enkelte vegglag og om ekstraintestinale strukturer. Metoden er derfor egnet blant annet til vurdering av subepiteliale lesjoner og til lokal stadievurdering av svulster (T-stadium)3,4,5. EUS kan også visualisere patologi i lokale og regionale lymfeknuter, for eksempel forandringer som indikerer lymfeknutemetastaser (N-stadium)6. Ved å påvise tumorstadium kan EUS også gi viktig informasjon om pasientens prognose7. EUS brukes også i noen tilfeller til å vurdere svulstens respons på kjemoterapi og stråling, men dette vanskeliggjøres av betennelse og arrvev som dannes på grunn av behandlingen, og slikt vev er vanskelig å skille fra svulstvev (Figur 1 og 2).
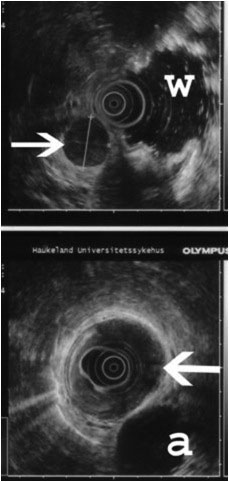
Figur 2. Øverst sees en malign lymfeknute på bakre bukvegg (pil). Vann i øvre del av magesekken (w). Nederst sees en svulst i veggen av spiserøret. Svulsten vokser ikke gjennom veggen (pil). Aorta (a).
På grunn av begrenset rekkevidde av høyfrekvent ultralyd er EUS best til å kartlegge lokale forhold omkring en tumor, og som regel vil den suppleres med CT eller MR for å få avklart om det foreligger fjernmetastaser5.
Studien var en retrospektiv gjennomgang av journalopplysninger og inkluderte pasienter som ble førstegangsundersøkt med EUS pga. kreft i spiserøret ved Haukeland Universitetssykehus i 2007.
Ultralydundersøkelsene ble utført med ekkoendoskop med mekanisk roterende transducere uten doppler av erfarne undersøkere.
Pasientenes journaler ble gjennomgått, og basert på journalnotat, operasjonsbeskrivelser og rapport fra EUS-undersøker og patolog ble det for hver pasient registrert kjønn, alder, instrumenttype, om tumor lot seg passere med endoskopet, tumors lokalisasjon, histologisk type, om pasienten hadde/fikk påvist Barretts øsofagus, om pasienten fikk neoadjuvant behandling, om tumor ble fjernet ved kirurgisk reseksjon, antall dager mellom EUS-undersøkelse og operasjon, og TN-stadium funnet ved EUS og histopatologi.
Tumorstadium angitt ved EUS ble sammenlignet med tumorstadium funnet histopatologisk etter kirurgisk reseksjon av tumor (Figur 3).
I studien ble den TNM-klassifiseringen som gjaldt for spiserørskreft i 2007 lagt til grunn.
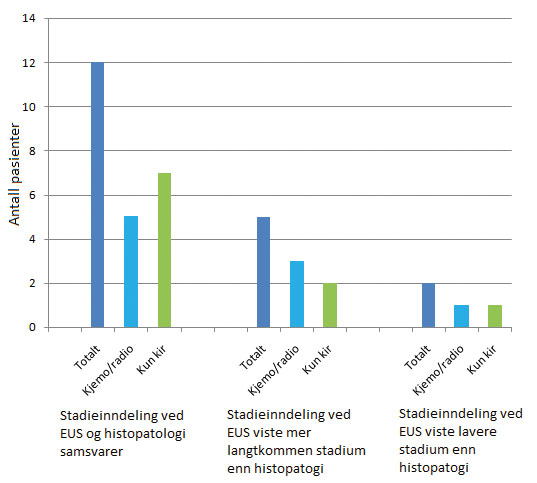
Figur 3: Sammenligning av stadieinndeling ved EUS og histopatologi samt behandlingsstrategi hos 19 pasienter operert for øsofaguscancer. Ca halvparten fikk adjuvant kjemo-/radioterapi.
Totalt ble 29 pasienter inkludert i studien, 25 menn og 4 kvinner. Aldersspredningen var fra 50 til 83 år, med median alder 65 år. Av disse pasientene ble 19 operert, slik at EUS kunne sammenliknes med histopatologien av operasjonsresektatet. I tillegg ble 3 ikke-opererte pasienter inkludert på bakgrunn av overflatebiopsier som viste histopatologisk stadium T0, (2 viste dysplasi og 1 viste plateepitelhyperplasi). Syv pasienter var inoperable pga langtkommen cancer, og man kunne derfor ikke sammenlikne stadium bestemt ved EUS og ved histopatologisk undersøkelse for disse.
Totalt kunne vi hos 22 pasienter sammenligne EUS med histopatologisk tumorstadium.
Tiden mellom EUS og operasjon varierte fra 7 til 173 dager, med median på 48 dager. I denne perioden fikk 12 av pasientene neoadjuvant behandling, som bestod enten av kjemoterapi, stråling eller en kombinasjon av disse. Ventetiden for de som gikk direkte til operasjon varierte fra 7 til 97 dager, med median på 29 dager.
Hos 5 pasienter var det ikke mulig å komme forbi tumor med endoskop. Av disse ble bare 1 operert. Hos ytterligere 4 pasienter ble det brukt miniprobe for å undersøke inn i det stenostiske området av tumor. To av disse ble operert.
Av de 19 opererte pasientene fikk 12 pasienter samme T-stadium ved EUS og histopatologi. Av disse 12 hadde 5 fått kjemo/radiobehandling preoperativt, mens de øvrige 7 pasientene ble operert uten forbehandling. Hos 5 av de 19 opererte pasientene viste EUS et høyere T-stadium enn ved histopatologi. Av disse 5 pasientene fikk 3 kjemo/radiobehandling preoperativt. I tillegg til disse 5 var det ytterligere 1 pasient som fikk et høyere T-stadium ved EUS enn histopatologisk, men denne ble ikke operert, og er derfor ikke med i Fig. 1. To av 19 opererte pasienter fikk et lavere T-stadium ved EUS enn histopatologisk. Av disse fikk 1 neoadjuvant behandling.
Tabell 1 viser at 14 av 22 pasienter fikk samsvarende T-stadium ved EUS og histopatologisk, mens 8 pasienter fikk ulike T-stadium. Den viser også at det er større grad av samsvar ved stadium >T2 (83.3%) enn ≤T2 (56.2%).
Tabell 2 viser at 12 av 15 pasienter fikk samsvarende N-stadium ved EUS og histopatologi, mens 3 pasienter fikk N-stadium som ikke samsvarer. Tabellen viser også et større samsvar ved N0 (100%) enn ved N1 (25%).
Åtte av 15 pasienter fikk både samsvarende T-stadium og samsvarende N-stadium. Fjorten pasienter ble ikke tatt med i denne sammenligningen da N-stadium fra EUS eller histopatologi manglet.
Søylediagrammet inneholder totalt 19 pasienter, mens 2×2-tabell for T-stadium inneholder 22 pasienter. Dette skyldes at søylediagrammet sier noe om grad av samsvar mellom EUS-stadium og histopatologisk stadium sammenholdt med den behandling de mottok, og at pasientene som inkluderes her derfor må være operert for sin øsofaguscancer. 2×2-tabellen for T-stadium inkluderer i tillegg 3 ikke-opererte pasienter som hadde fått sitt histopatologiske stadium på bakgrunn av overflatebiopsi (T0). 2×2-tabellen for N-stadium inneholder totalt 15 pasienter. Dette skyldes at EUS-beskrivelsen ikke inneholdt vurdering av N-stadium i 3 tilfeller, og at det manglet histopatologisk N-stadium hos 4 pasienter. Disse 7 pasientene kunne vurderes mtp. T-stadium, men ikke N-stadium, og ble derfor utelatt fra tabellen.
Flere faktorer kan forklare hvorfor EUS og histopatologi noen ganger ikke samsvarer ved stadieinndeling av svulster i spiserøret:
Faktorer som kan forklare diskrepans i T-stadier:
Faktorer som kan forklare diskrepans i N-stadier:
EUS er en velegnet metode for å stadieinndele svulster i spiserøret. Majoriteten av pasientene vil allerede ha en histopatologisk diagnose basert på biopsi fra primærtumor. EUS sin hovedstyrke er å kartlegge hvor dypt lesjonen vokser i forhold til de enkelte vegglagene. EUS er også viktig for å påvise lokale lymfeknutemetastaser. Selv om det bildemessig ikke er mulig å skille helt sikkert maligne fra benigne lymfeknuter, gir form, størrelse, avgrensing og ekkogenisitet en god indikasjon. Ved stenoserende svulster vil EUS ofte være inkomplett fordi man ikke kommer gjennom det trange området, men også ved slike svulster kan man ofte påvise T-stadium som tilsier at pasienten bør ha adjuvant behandling (>=T3) Kombinasjonen med andre bildemodaliteter som CT og MR vil derfor være nødvendig for å påvise evt. fjernmetastasering. Nye og mindre belastende behandlingsformer ved tidlige svulster i øsofagus, for eksempel endomukosal reseksjon, nødvendiggjør en detaljert stadieinndeling som hittil kun er mulig ved endoskopisk ultralyd.
Denne presentasjonen er et sammendrag av vår særoppgave ved medisinstudiet ved universitetet i Bergen (UiB). Arbeidet er utført ved Nasjonalt Senter for Gastroenterologisk Ultrasonografi, Medisinsk avdeling, Haukeland universitetssykehus og Institutt for indremedisin, UiB, under veiledning av Roald Flesland Havre, Lars Birger Nesje og Svein Ødegaard.