Av Trond Jenssen er tilknyttet avdeling for organtransplantasjon, fordøyelses- og nyresykdommer, Oslo universitetssykehus Rikshospitalet.
Transplantasjon av bukspyttkjertel (pankreas) eller insulinproduserende Langerhanske øyer er et aktuelt behandlingsalternativ for type 1-diabetes pasienter med ustabil diabetesregulering. Forutsetningen er at andre behandlingsalternativer allerede har vært prøvd, eller i alle fall vært vurdert, deriblant insulinpumpe.
Hele bukspyttkjertelen: Den første pankreastransplantasjonen ble utført i Minneapolis i 1966. I mer enn 15 år var teknikken utprøvende med tildels dårlige langtidsresultater. De fleste bukspyttkjertlene ble avstøtt og gikk tapt mindre enn 6 måneder etter transplantasjonen (1).
Det store gjennombruddet for pankreastransplantasjon som metode kom i 1983, da cyclosporinet ble tatt i bruk som immundempende middel. Dette året innførte man også pankreastransplantasjon som behandling ved Rikshospitalet. Men enda frem til slutten av 1980-tallet var behandlingen en betinget suksess, færre enn halvparten av de transplanterte organene fungerte etter 3 år (2).
Øycellene: Bukspyttkjertelen er bygd opp av ca. 1 million Langerhanske øyer, men dette endokrine vevet utgjør likevel bare 1 % av hele cellevolumet i kjertelen. Resten av buskpyttkjertelen er eksokrint vev som produserer fordøyelsesenzymer og bikarbonat. Hver Langerhansk øy består av insulinproduserende betaceller, glukagonproduserende alfaceller, somatostatinproduserende deltaceller, og gammaceller som produserer pankreatisk polypeptid. Hver øy består av 2000-4000 celler (figur 1), og har sin egen blodforsyning. Man transplanterer derfor ikke enkeltceller, men små mikroorgan. Egentlig burde man derfor omtale metoden som transplantasjon av celleøyer, ikke øyceller.
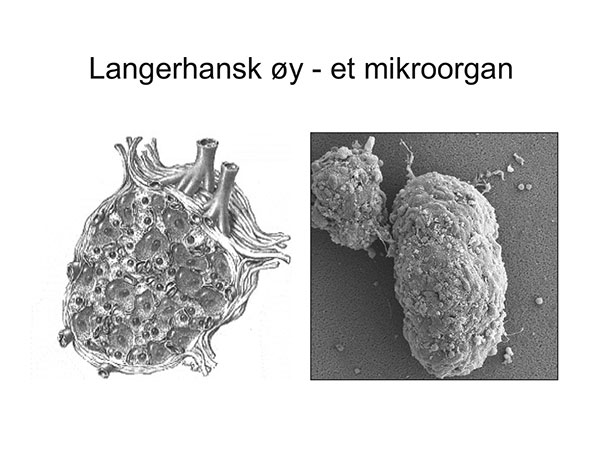
Figur 1: Tegning og fotografi av Langerhansk øy. Hver øy har arteriell blodforsyning med venøs drenasje.
Bukspyttkjertelen: Ved transplantasjon av hel bukspyttkjertel opereres den inn i buken til mottakeren, slik at arterie og vene på kjertelen koples til bekkenkarene på høyre, eventuelt venstre side. Den eksokrine delen (fordøyelsesdelen) av bukspyttkjertelen dreneres til mottakerens tynntarm, og festes så langt opp på jejunum som mulig. Dette gjøres slik at vi kan nå koplingsstedet med et gastroskop.
En liten bit av donors duodenum fungerer som koplingsstykke mellom bukspyttkjertelen og pasientens egen jejunum (figur 2). Som ledd i kontrollene de første månedene gjør vi rutinemessige endoskopier med biopsi fra donors duodenalstump, for å overvåke utvikling av eventuell avstøtningsreaksjon. Vi biopserer kun unntaksvis fra selve bukspyttkjertelen, siden det kan være beheftet med blødning, betennelser og lekkasjer. Pasienteoverlevelsen per- og postoperativt er nær 100 %, men forbigående komplikasjoner i form av infeksjoner, blødninger eller lymfelekkasje opptrer i 15-20 % av tilfellene.
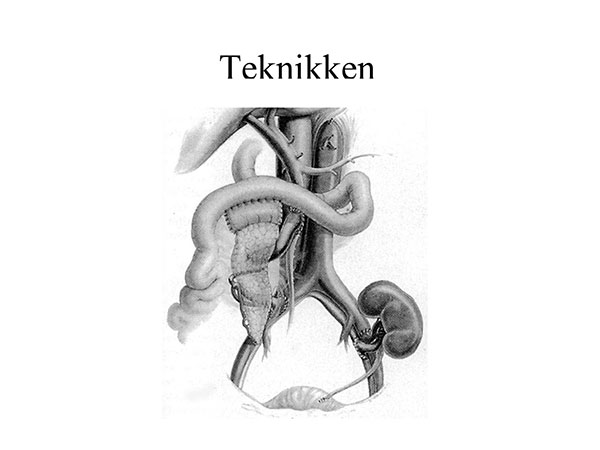
Figur 2: Tegning som viser plassering av en transplanterte bukspyttkjertel. Den eksokrine delen av kjertelen er koplet til pasienten tynntarm ved hjelp av en liten duodenalbit fra donor. Nederst til høyre ser man en transplantert nyre koplet til bekkenkarene.
Øycellene: Langerhanske øyer til humant bruk isoleres fra donorpankreas i spesiallaboratorier. I Norden er det foreløpig kun ett laboratorium som er lisensiert for å fremstille humane øyceller til terapeutisk bruk, det er Rudbecks laboratorium, Universitetet i Uppsala. Som regel er det bukspyttkjertler fra norske givere som brukes til norske pasienter. Donorpankreas flys til Sverige, øycellene isoleres og kommer tilbake som infusjonspreparat (figur 3). Via lokalbedøvelse settes cellene som en transfusjon inn i portvenen, og fester seg deretter i leveren. Denne prosedyren tar ca. 30 minutter. Pasienten utskrives etter 2-7 dager. De per- og postoperative komplikasjonene er veldig sjeldne, blødning etter innstikk eller portvenetrombose kan opptre i 1-2 % av tilfellene.
Ved transplantasjon av hel pankreas er resultatene best når man transplantarer pankreas sammen med en nyre til uremiske pasienter. Da er mortalitetet i forbindelse med inngrepet nesten null, og 70 % av pasientene er uten behov for insulintilskudd etter 5 år. Den gjennomsnittlige HbA1c-verdien hos disse pasientene er 5.5 % etter transplantasjon, uten insulintilskudd (personlig observasjon). Teknisk sett har det vært vanskelig å oppnå samme gode resultat når man transplanterer en bukspyttkjertel alene (5 års
organoverlevelse ca. 50-60 %).
Grunnen til det kan dels være at en transplantert nyre utgjør en immunologisk “beskyttelse” for bukspyttkjertelen, dels at behandlingen for avstøtninger (rejeksjoner) kommer i gang tidligere, siden kreatininstigning er et tidlig signal på rejeksjon i den transplanterte nyren. Stigning i blodsukkeret ved rejeksjon av en transplantert pankreas er derimot et sent tegn i prosessen, og opptrer først når en stor del av de Langerhanske øyene er gått tapt.
For øyceller er langtidsresultatene foreløpig dårligere. Etter gjennomsnittlig to overføringer av øyceller (dvs. fra to donororgan) er 75 % av pasientene insulinfrie etter ett år, men bare 25 % etter 5 år. Årsaken er at mange øyceller mistes under selve inngrepet, slik at man får færre insulinproduserende celler enn ved en hel pankreas. Dette skyldes dels at en inflammasjonsreaksjon utløses i det de ubeskyttede celleøyene kommer i kontakt med pasientens blod, dels at de er truet med iskemi før de etablerer sin egen blodforsyning fra levervevet ca. 2 uker etter overføringen.
På den andre siden lager fortsatt 75 % av pasientene C-peptid etter 5 år, og har normale blodsukre og HbA1c med et lite tilskudd av insulin, eventuelt blodsukkersenkende tabletter. Vurdert ut fra langtidsresultatene befinner dagens øycelleteknikk seg kanskje der transplantasjonsteknikken for hel pankreas befant seg på slutten av 1980-tallet (2, figur 4).
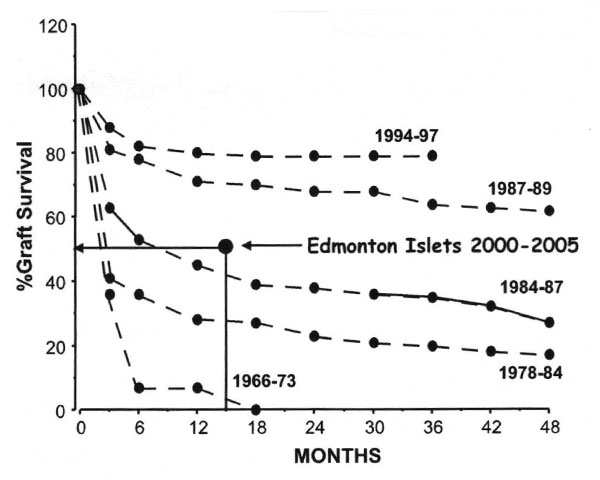
Figur 4: Trenden i organoverlevelse for forskjellige tidsperioder med pankreastransplantasjon, sammenlignet med organoverlevelse for øycelletransplantasjon i perioden 2000-2005 (Edmonton, Canada). Kriteriet for organoverlevelse er at pasienten er uten behov for insulintilskudd. (Fra ref. 2.)
En del av celletapet kan også ha med autoimmunitet å gjøre, ved at isolerte Langerhanske øyer er mer vulnerable når de ligger eksponert i levervevet, enn når de befinner seg i sitt normale pankreasmiljø Ved å benytte immunsuppresjon som delvis også demper B-lymfocyttene (som lager autoantistoffer), har en kanadisk gruppe nylig rapportert at 60 % av pasientene som var transplantert med øyceller én gang, var fortsatt uten behov for insulin 3 år etter (3). Det er i så fall resultat som ligner veldig på dem man i dag kan oppnå ved transplantasjon av hel pankreas alene.
Ved pankreastransplantasjon og ved øycelletransplantasjon bruker man noenlunde lik immunsuppresjon, hvor basisbehandling består av takrolimus og mykofenolat, eventuelt sirolimus i stedet for mykofenolat.
De viktigste faktorene som kan påvirke forskjell i langtidsfunksjon for hel pankreas og øyceller, er gjengitt i tabell 1.
I tabell 1 fremgår det at det pr. dags dato er ulik seleksjon av donororgan til pasienter som venter på hel pankreas versus øyceller. Dette skyldes at de makroskopisk beste organene selekteres til hel pankreastransplantasjon, og helst fra givere <50 år.
Ved øycelletransplantasjon har man akseptert givere opptil 20 år eldre enn dette. Det er imidlertid mulig å utføre en mer integrert selektering av organer, slik at donororganene bedre tilpasses pasientene som venter på transplantat. Pankreas fra overvektige donorer er som regel preget av fettinfiltrater, og egner seg i mindre grad til helorgantransplantasjon, mens de er meget vel egnet for øycelleisolering og transplantasjon. Pankreas fra slanke, unge givere egner seg mindre til øycelletransplantasjon (organet er vedlig vulnerabelt under isolering), men er derimot særdeles velegnet for helorgan transplantasjon (4).
Tabell 2 oppsummerer de viktigste faktorene som bestemmer om pasienten skal allokeres til hel pankreas eller øycelletransplantasjon.
Transplantasjon av hel pankreas er etablert behandling ved ustabil diabetes når konservativ behandling ikke kommer til målet. Best resultat ser man når pankreas transplanteres sammen med nyre til personer med uremi (75 % organoverlevelse etter 5 år). Noe dårligere resultat ser man når pankreas transplanteres alene (60 % organoverlevelse etter 5 år). Dagens teknikk for øycelletransplantasjon gir bare 25 % organoverlevelse etter 5 år (definert som insulinuavhengighet), men pasientene har fortsatt partiell organfunksjon med produksjon av C-peptid.
Nye immunsuppressive regimer kan muligens bringe øycelletransplantasjon resultatmessig opp på samme nivå som transplantasjon av hel pankreas alene. I dagens situasjon prioriteres transplantasjon av hel pankreas til yngre pasienter med uregjerlig hyperglykemi, spesielt når de trenger store doser insulin. Øycelletransplantasjon er derimot mest egnet når hypoglykemi uten ledsagersymptomer (”unawareness”) er problemet, helst kombinert med lavt insulinbehov. Aldersgrensen for øycelletransplantasjon er høyere
(65 år) enn for helorgan pankreas (55 år).
Artikkelen er tidligere publisert i Diabetesforum nr. 4 2010 og Nefrologisk forum nr. 1 2011 og trykkes med tillatelse.