Av Lars Fjellbirkeland, Overlege førsteamanuensis Dr.med, Lungeavdelingen, Oslo universitetssykehus, Rikshospitalet
For nøyaktig 100 år siden, i 1912, utkom det en liten bok i London med den tidstypiske tittelen: ”Primary Malignant Growths of the Lungs and Bronchi: A Pathological and Clinical Study”[1]. I forordet spurte forfatteren om det var noe poeng i å skrive en hel monografi om maligne svulster i lungene for, som han sa: ”On one point, however, there is nearly complete consensus of opinion, and that is that primary malignant neoplasms of the lungs are among the rarest forms of the disease.” Bare 70 år senere, i 1985, erklæres lungekreft for å være den vanligste kreftformen i verden. Samtidig som den tar flere liv enn noen annen kreftsykdom [2].
Også i Norge har antallet økt kraftig, fra 230 meldte tilfeller i 1953 til 2648 i 2009 (Tall fra Kreftregisteret). Økningen i Norge skyldes flere forhold. Dels er befolkningen blitt eldre, lungekreft rammer sjelden mennesker under 50 år, dels er befolkningen blitt større. I tillegg har helsevesenet fått bedre og mer presise diagnostiske metoder. Hovedårsaken er allikevel tobakksepidemien som tok av i første halvdel av forrige århundre. Trenden i tobakksbruk har nå snudd og i dag er andelen dagligrøykere på vei ned i Norge. Effekten av dette ser vi allerede hos menn hvor insisidenskurven for lungekreft har flatet ut fra ca 1995. I kontrast stiger fortsatt insidensen blant kvinner, slik at lungekreft er blitt nesten like vanlig blant norske kvinner som menn.
Sammenhengen mellom tobakksrøyking og lungekreft ble elegant illustrert blant engelske leger av Doll et al på 1950 tallet, en samling arbeider som fortsatt brukes i epidemiologiske lærebøker [3]. Andre etiologiske årsaker til lungekreft har kommet helt i skyggen av tobakksrøyking og har vært vanskelige å studere og påvise siden det store flertallet av lungekreftpasienter enten er eller har vært røykere. I øst-asiatiske land har det blitt postulert en sammenheng mellom røyk og avgasser fra ildsteder og lungekreft blant ikke-røykende kvinner [4]. I Norge er det en diskusjon rundt radongass i boliger og sjansen for lungekreft, uten at denne sammenhengen er lett å tallfeste [4]. Kanskje må vi vente på den ”post-nikotinelle æra” før vi får mer kunnskap om betydningen av andre årsaksfaktorer for lungekreft. At det er en individuell genetisk disposisjon for å utvikle lungekreft er hevet over tvil. Mindre enn 10% av sigarettrøykere får som kjent lungekreft. Det forskes på om det foreligger sårbarhetsgener og – fenotyper uten at man har klart å vise en sterk arvelig komponent [4].
Lungekreft oppstår i et stumt organ. Det er ikke smertefibre distalt for de store sentrale luftveiene og perifere svulster kan vokse i lang tid uten at å bli oppdaget. Det er derfor begrenset kunnskap om forstadiene til lungekreft. Rundt 10% av svulstene blir oppdaget tilfeldig og over 70% av pasientene har metastaserende sykdom ved diagnosetidspunktet. Screening for lungekreft har foreløpig ikke fått gjennomslag internasjonalt. Røntgen thorax viser seg å være for usikkert så det kreves CT undersøkelser. Den begrensede kunnskapen om sykdommens prekliniske forløp gjør det vanskelig å si hvor ofte den enkelte skal undersøkes. Dessuten er falsk positive micronoduli et hyppig funn ved CT-thorax etter 50 års alderen. Nyere studier kan tyde på en gevinst ved å begrense screeningen til personer i aldersgruppen 55-75 år med tung røykeanamnese [5]. Den amerikanske foreningen for klinisk onkologi kom nå i mai 2012 med en anbefaling basert på disse studiene [6].
Mens det for andre kreftsykdommer har skjedd en generell bedring av langtidsoverlevelse de siste tiårene, har det vært lite lystig for lungekreft. Bare pankreascancer har en dårligere 5-års overlevelse. Men etter årtusenskiftet har det begynt å lysne også for lungekreft, både 1 og 5 års overlevelsen har gått opp [7]. Hovedårsaken til den dårlige overlevelsen er at de eneste antatte kurative behandlingsformene, kirurgi og stereotaktisk stråleterapi, er tilgjengelig for et lite mindretall av pasientene. I Norge er andelen opererte under 20%. Flertallet, som har spredning ved diagnosetidpunktet, er overlatt til palliativ onkologisk behandling i form av livsforlengende kjemo- og/eller stråleterapi. På dette feltet har det skjedd et paradigmeskifte de siste ti årene, fra nærmest kun symptomatisk behandling til aktiv behandling av de aller fleste. Årsaken til dette paradigmeskiftet ligger i utvikling av nye typer cytostatika med dokumentert effekt på overlevelsen ved lungekreft. Noen av disse har doblet median overlevelse for pasienter med avansert lungekreft fra 6 til 12 måneder.
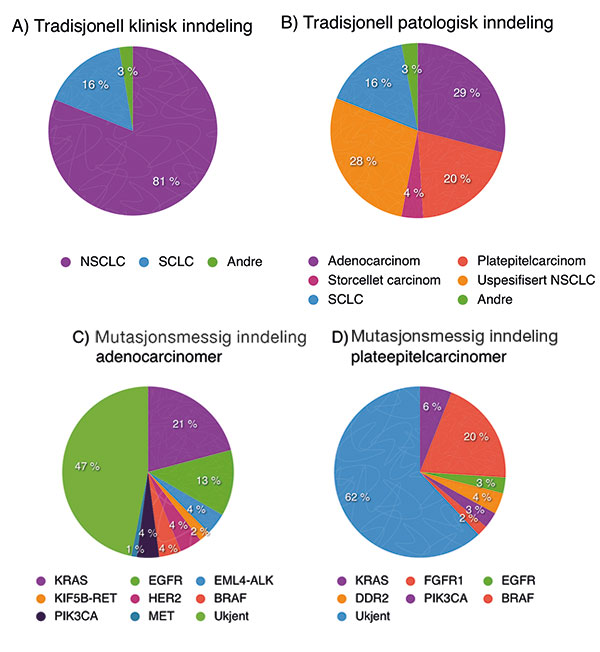
Figur 1: Inndelingen av lungekreft er i ferd med å endre seg. Fra gårsdagens enkle, kliniske variant (A), via patologenes versjon (B) til morgendagens sannsynlige biologiske versjon basert på mutasjonsbestemmelse (C og D). De enkelte mutasjonene omtales med forkortelser som langt fra er selvforklarende. Noen av dem er omtalt i teksten, de andre er foreløpig kun aktuelle i forskningsartikler og det henvises til artikkel nummer 10 og 11 i referanselisten for utfyllende opplysninger.
Tradisjonelt har lungekreft vært delt inn i småcellet- (SCLC) og ikke-småcellet lungekreft (NSCLC) (figur 1). Denne inndelingen, som stammer fra 1970-tallet, var knyttet til den tids behandlingstilnærming. Den gang kom det på markedet cytostatika som virket mot SCLC, mens det ikke var tilgjengelig tilsvarende behandling for NSCLC. Denne enkle, men praktiske inndelingen har holdt seg opp til de senere år. Nå har man begynt å etterspørre en mer spesifikk morfologisk inndeling av NSCLC da ny kunnskap har vist at histologitypen adenocarcinom i noen tilfeller skal behandles forskjellig fra plateepitelcarcinomer [8]. Dette setter større krav til kvaliteten på prøvematerialet, en utfordring til de som tar diagnostisk biopsi- og/eller cytologimateriale. Slik det har vært de siste årene er diagnosen ”uspesifisert ikke-småcellet lungekreft” en av de største morfologiske undergruppene i kreftregisterets database (Figur1) [7]. Målet er å komme helt bort fra denne diagnosegruppen og i stedet klassifisere de aller fleste svulstene som adeno- eller plateepitelcarcinomer. Nye teknikker med
immunhistokjemi gjør dette langt på vei mulig [9]. For resekterte svulster er det foreslått en enda mer omfattende histologisk inndeling av adenocarcinomer, bl.a. med karsinoma in situ som en ny undergruppe [9].
Den største forandringen i synet på behandling av lungekreft springer ut i fra ny kunnskap om sykdommens biologi. Grunnforskning har åpnet mange nye veier inn til forståelse av hva som aktiverer og hva som bremser kreftceller. Det er påvist onkogene mutasjoner som driver svulstene framover. Kjennetegnet for mange av disse mutasjonene er at de forekommer i undergrupper av histologiske ensartete tumorer og at de som oftest er ekskluderende. Det vil si at har du den ene mutasjonen så har du ikke den andre (Figur 1)[10, 11]. I og med at tradisjonell histologi i liten grad kan si noe om hvilken onkogen mutasjon som er aktiv i den enkelte svulst er man foreløpig tvungent til å teste alle pasienter for hver enkelt mutasjon. Dette setter igjen enda større krav til kvalitet og mengde av diagnostisk materiale hentet fra den enkelte pasient. Det vil også sette større krav til behandlere som må være oppdatert i en stadig mer omfattende og komplisert behandlingsalgoritme. Det blir heller ikke enklere at det ofte er aktuelt å gi pasientene flere runder med kjemoterapi og/eller biologisk behandling etterhvert som den initiale behandlingen ikke klarer å holde sykdommen i sjakk. Det er utviklet blokkerende medikamenter for flere av disse mutasjonene. Som vist i figur 2 er det mange nye medikamenter i utprøving. Per i dag er bare to av dem kommet i klinisk bruk, Erlotinib og Gefitinib, som begge blokkerer mutert, overaktiv epidermal growth factor receptor (EGFR).
Forskjellige mutasjoner i EGFR molekylet er vist å ha sammenheng med enten positiv eller negativ behandlingseffekt av småmolekylære, perorale medikamenter av typen tyrosin-kinase-hemmere (TKI). Både Erlotinib og Gefitinib er vist å øke progresjonsfri overlevelse hos pasienter med spesifikke mutasjoner [12, 13]. Disse mutasjonene forekommer bare ved ikke-småcellet lungekreft og hyppigst hos pasienter med adenocarcinomer. I en fersk norsk studie fant man at mutasjonsfrekvensen var 3,0% blant pasienter med morfologisk plateepitelcarcinom, mens den var 12,7% hos dem med ikke-plate-epitel morfologi (adeno-, storcellet- og uspesifisert ikke-småcellet lungecarcinom) [14]. Siden mutasjonene ikke har noen sikre samsvarende kliniske eller morfologiske trekk, anbefales det i Norge rutinemessig testing av alle med diagnosen ikke-småcellet lungecarcinom [14]. Mens ubehandlet metastaserende lungekreft har en median overlevelse på under seks måneder, har studier vist median overlevelse på over to år hos pasienter med EGFR mutasjoner [15]. I fase tre studier har TKI vist bedre progresjonsfri overlevelse enn tradisjonelle cytostatika hos pasienter med EGFR mutasjoner slik at det i Norge nå anbefales å bruke TKI som førstelinjebehandling hos denne undergruppen pasienter.
De aller fleste pasientene som får behandling med TKI utvikler resistens mot behandlingen og får derfor residiv av sykdommen. Det foregår mye forskning rundt problemet med resistensutvikling uten at problemet foreløpig er løst.
Den neste mutasjonen på vei inn, finnes i en annen kinase, EML4-ALK (echinoderm microtubule-associated protein-like 4 anaplastic lymphom kinase). Forekomsten av denne er ikke kjent i Norge, men internasjonale studier tyder på at den finnes hos rundt 5% av pasienter med primært adenocarcinom i lungene. Det er allerede utviklet et medikament, Crizotinib, med effekt på denne mutasjonen [16]. Crizotinib er foreløpig ikke registrert i Norge men har vært prøvd på en håndfull pasienter i regi av Radiumhospitalet. Heller ikke her er det kliniske eller morfologiske kjennetegn, utover adenocarcinom, som skulle tilsi hvem som skal testes. Påvisningen av denne mutasjonen er arbeidskrevende og det har derfor foreløpig ikke gått ut noen oppfordring om hvem som skal testes. Det enkleste er sannsynligvis å teste dem som er negativ for mutasjoner i EGFR og KRAS (Kirsten RAt Sarcoma viral ongogene homolog) jfr at disse mutasjonene nesten alltid er ekskluderende (Figur 1). KRAS, er et annet mutert gen i lungekreft som det foreløpig ikke finnes effektive medikamenter mot men som er enklere for patologene å teste i daglig rutine. Flere andre nye substanser kan bli aktuelle ved andre mutasjoner funnet ved lungekreft (Figur 1). De er foreløpig under utprøving (Figur 2).
Figur 2: Flere nye substanser er under klinisk utprøving mot forskjellige mutasjoner i lungekreft. Bildet (tatt fra tilhørerplass under foredrag på verdenskongressen for lungekreft 2011) viser medikamenter i fase én studier (gul ring), fase to (grønn ring) og fase tre (turkis ring). I sentrum finnes substanser i klinisk bruk. Helhetsinntrykket av bildet er viktigere enn navnet på de enkelte substansene.
I løpet av de siste hundre år har lungekreft utviklet seg fra å være en raritet til å være verdens vanligste kreftform. Fortsatt er prognosen meget alvorlig. Økt kunnskap innen molekylær biologi har ført til nye behandlingsformer. Dette fører til større optimisme blant forskere og klinikere om at det nytter å behandle også denne sykdommen. Stadig bedre resultater for andre kreftsykdommer som leukemi, lymfomer og brystkreft, har vist at forskning nytter. Kanskje det endelig er tid for pasienter med lungekreft å bevege seg ut av skyggenes dal? Skreddersydd biologisk behandling gir håp.