Det har vært økende fokus på diagnostikk og behandling av lungekreft de siste 15 år [1]. Har vi i dag et godt grunnlag for å vurdere kvaliteten av behandlingen i Norge, og er det tiltak som kan ivareta denne? Artikkelen bygger på prøveforelesningen til det oppgitte emne ved PhD graden ved Universitetet i Bergen våren 2012 [2].
Antall nye tilfeller av lungekreft i Norge er økende, og i 2010 var 2662 tilfeller registrert inntil september 2012 [3]. Andelen kvinner som får lungekreft er økende (figur 1).
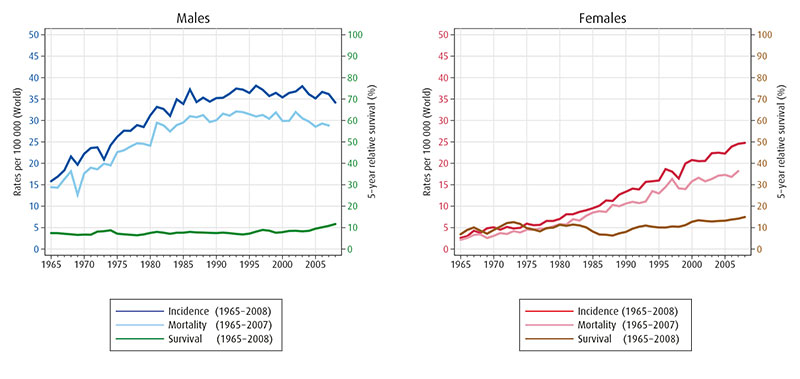
Figur 1. Insidensrater, mortalitet og 5-års relativ overlevelse av lungekreft i Norge (ICD-10, C33-34, fra Kreftregisteret (ref 42). Trykkes med tillatelse.).
Det er betydelige fylkesvise variasjoner i insidensen av lungekreft (figur 2), og Agder-fylkene og Finnmark har de fleste tilfellene, både av menn og kvinner [4]. Hva dette skyldes er uklart. Tobakksrøyking regnes som den viktigste årsaksfaktor, men det finnes ikke gode fylkesvise data om forbruket av tobakk fra den aktuelle tidsperiode som vanligvis er flere tiår forut for lungekreft. En annen mulig etiologisk faktor er radon, og målinger har vært utført [5]. En har imidlertid ikke funnet geografiske variasjoner i disse målingene som samsvarer med variasjonene i forekomst av lungekreft.
I en undersøkelse fra Kreftregisteret av nye pasienter med lungekreft fra 2005-09 ble det funnet betydelige forskjeller i antall nye tilfeller i forskjellige bydeler i Oslo. Tallene var høyest i de østre bydeler med insidensrater over landsgjennomsnittet [6] og dette blir bl.a. satt i sammenheng med lavere inntekt og utdanningsnivå i disse områdene. At sosiale faktorer er forbundet med økt risiko for lungekreft er også kjent fra andre studier [7, 8].
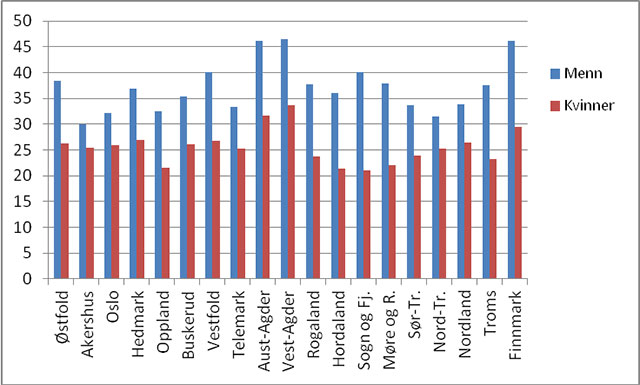
Figur 2. Aldersjusterte insidensrater av lungekreft fordelt på fylker i perioden 2006-2010
(Kilde: Kreftregisteret).
Lungekreft er den kreftformen som forårsaker flest dødsfall i Norge. Som vist i figur 1 har den relative 5-års overlevelsen vært på om lag 10 % de siste 40 årene, men steget litt hos kvinner de siste årene [9].
Dette er omtrent som i andre vesteuropeiske land, men det har vært forskjeller mellom landene. I en studie av lungekreftpasienter basert på data fra kreftregistre var 5-års relativ overlevelse i England 8,4%, mens Sverige hadde 13,9% [10]. Danmark har hatt en overlevelse på linje med England [8].
I en langtids oppfølging av hele populasjonen på 271 lungekreftpasienter i sykehusområdet til Haugesund sykehus inkludert i en 7-års periode fra 1990, fant vi en 5-års observert overlevelse på 8,5 %. Faktorer av betydning for langtids overlevelse var begrenset stadium, godt funksjonsnivå, ung alder og stabil vekt [11-13]. Lignende funn er gjort i andre studier [14].
Tiden fra diagnosen lungekreft er stilt til behandling blir iverksatt er blitt tillagt stor betydning i de nasjonale anbefalinger. Det er vanskelig å finne studier som bekrefter at et kortere tidsintervall gir bedre prognose. I en studie fra Sverige av pasienter med ikke-småcellet lungekreft (NSCLC) som fikk tumorrettet behandling fant Myrdal at overlevelsen av disse pasientene ble bedre jo lengre dette tidsintervallet var [15]. I en finsk studie av NSCLC var en lengre tid fra første konsultasjon hos lungespesialist, til start av behandling, positivt assosiert med lengre overlevelse [16]. I studien fra Haugesund fant vi ikke at tiden fra symptomenes begynnelse til diagnosen var bekreftet influerte på prognosen [11].
Etter år 2000 har det skjedd en betydelig endring av behandlingen av utbredt NSCLS hos pasienter i god almentilstand, og det har forlenget kort-tids overlevelsen [9]. Kravene til histologisk differensiering av den store gruppen NSCLC har økt. Påvisningen av biologiske markører som ’epidermal growth factor receptor ’ (EGFR) har gitt muligheter til mer individuelt rettet kjemoterapi. Dette er nylig utførlig omtalt i dette tidsskriftet [17].
Når det gjelder behandling med kurativt siktemål er det nå mulig å gjennomføre diagnostikk av glandler i mediastinum ved positronemisjonstomografi (PET)-skanning og endobronkial ultralyd (EBUS) med mindre bruk av mediastinoskopi enn tidligere. Transøsofageal endosonografi (EUS) av mediastinum med biopsitaking må nevnes her. PET-skanning har vist seg å redusere antall operasjoner hos pasienter med utbredt sykdom fordi diagnosen blir stilt preoperativt i stedet for peroperativt. [18]
I en undersøkelse (av Strand) ved Kreftregisteret av 19 582 nye pasienter med lungekreft i Norge i årene 1993 – 2002 ble operativ behandling av 3 211utført ved i alt 27 sykehus [19]. Det tilsvarer en reseksjonsrate på 16,4% for hele landet. Fem års relativ overlevelse var 46,4%. Tilsvarende fant Båtevik ved Haukeland Universitetssykehus hos 351 pasienter operert for lungekreft fra 1988 – 2002 en 5 års relativ overlevelse på 52,6% [20].
I en senere oppfølging av alle lungekreftopererte pasienter i Norge i tre to-års perioder (1994-95, 2000-01, 2006-07) var reseksjonsraten steget til 18,7% i siste periode fra 16,1% i første periode [21]. I samme tidsrom observerte man et fall i postoperativ mortalitet og en bedring i ett års overlevelse (tabell 1).
Det ble funnet fylkesvise forskjeller i reseksjonsraten i de tre tidsperiodene studien ble foretatt (tabell 2), men forskjellene var minst i den siste perioden [21].
Observert overlevelse hos pasienter med NSCLC behandlet med potensielt kurativ stråledose over 50 Gy var i en norsk multisenter studie 9% [22]. 70 % av pasientene hadde stadium IIIa og IIIB, men en del pasienter med dårlig prognose var ikke inkludert. Det var betydelig variasjon mellom sykehusene i stråledoser og antall fraksjoner.
Palliativ kjemoterapi av avansert NSCLC hos pasienter med god almentilstand er nå en del av standard behandling [23]. I en undersøkelse av behandling med kjemoterapi hos denne pasientgruppen i hele Norge fant von Plessen at bruken av tredje generasjons kjemoterapi var forbundet med noe forlenget levetid. Det var imidlertid betydelige fylkesvise forskjeller [23]. I det tidsrommet studien ble foretatt, 1994–2005, ble lungekreft behandlet ved 52 sykehus i Norge. En regner med at geografiske variasjoner kunne skyldes forskjellige behandlingstradisjoner, og det var dessuten før det kom nasjonale anbefalinger om lungekreft. Geografiske forskjeller i behandling av lungekreft er også observert i Sverige [24]
I Danmark hvor det har vært lav 5-års overlevelse i forhold til andre nordiske land [25], fikk man i 1998 nasjonale anbefalinger for diagnostikk og behandling av lungekreft. I 2002 ble lungekreft inkludert i det danske nasjonale indikator prosjektet (NIP). I en rapport fra dette kvalitetsregisteret ble det fokusert på indikatorer som beskriver utredning av stadium, kirurgiske prosedyrer, komplikasjoner og overlevelse [26]. Nasjonale og regionale resultater blir publisert årlig, og dermed kan en sammenligne regioner og sykehusavdelinger. I en 7-års periode fram til 2007 var det en forbedring i flere indikatorer, som for eksempel ett- og to-års overlevelse etter lungekreftkirurgi [26].
Et økende fokus og satsing på diagnostikk og behandling av lungekreft i samme tidsrom er antatt å være medvirkende årsak til disse positive endringene, men for å synliggjøre disse er et kvalitetsregister påkrevet.
I England ble 34 513 pasienter registrert i et nasjonalt kvalitetsregister (The National Lung Cancer Audit – NLCA) fra 2004 – 08 [27]. Et av funnene var at pasienter som initialt ble vurdert ved et kreftsenter hvor det var torakskirurg, hadde større sannsynlighet for å bli operert enn der hvor det ikke var kirurg. Kirurgi var den sterkeste enkelte prediktor for overlevelse. Det er dermed mulig at prognosen for en mindre gruppe pasienter kunne bedres ved øket tilgang på kirurgi.
Det er en utfordring å velge de rette kvalitetsindikatorer i diagnostikk og behandling av lungekreft [28]. En høy andel av pasienter som får histologisk /cytologisk bekreftelse av diagnose indikerer en god kvalitet på diagnostikken. I kirurgiske materialer blir graden av overensstemmelse mellom stadieinndelingen preoperativt og postoperativt, operasjonskomplikasjoner, per- og postoperativ dødelighet samt overlevelse (tabell 1) ansett som viktige kvalitetsindikatorer [26]. I Norge savner vi et nasjonalt kvalitetsregister for lungekreft. I den informasjon vi har i den nåværende kreftmelding for solide tumores er stadieinndelingen inndelt i lokalisert sykdom, regional eller fjernmetastaser. Dette er utilstrekkelig for et kvalitetsregister, som bør inneholde oppdatert stadieinndeling (TNM), informasjon om funksjonsnivå komorbiditet, behandling og overlevelse.
En rekke andre kvalitetsindikatorer som også omfatter ikke-kirurgisk behandling av lungekreft er foreslått [28, 29]. Det kan dreie seg om livskvalitetsmålinger [30] eller andre pasientorienterte indikatorer, som for eksempel hvor stor andel av pasientene er blitt spurt om sine symptomer eller psykososiale behov etc. [31].
Flere land går nå inn for dette, etter som det stilles krav til størrelsen på en behandlingsenhet. I Danmark [32] har man observert bedre behandlingsresultater i kirurgi på hospitaler med over 170 nye lungekreftpasienter i året sammenlignet med mindre enheter, og i Tyskland anbefales det at en slik enhet skal ha over 200 nye pasienter med lungekreft per år [33]. Avdelinger med et stort volum av pasienter har vist seg å ha bedre overlevelse ved lungekreftkirurgi sammenlignet med de som har mindre volum [34]. Videre vil en behandlingsenhet behøve et tilstrekkelig antall pasienter, for å kunne statistisk vurdere om forskjeller fra nasjonale behandlingsresultater eller andre enheter er signifikante [35].
For ikke-kirurgisk kreftbehandling finnes ikke tilsvarende data som viser at resultatene blir bedre med større volum av pasienter [36].
Som en følge av økte krav til organiseringen av diagnostikk og behandling av lungekreft har flere sykehus slått seg sammen i nettverk. Et større regions- eller universitetssykehus er det faglige tyngdepunktet, hvor det i tillegg til utredning med PET skanning og EBUS/EUS utføres lungekreftkirurgi og bestråling med kurativ intensjon. En slik organisering ble vurdert til å bidra til bedret behandling og overlevelse hos lungekreftpasienter i Skottland [37]. På tilsvarende måte er nå (lunge)kreftbehandlingen i England organisert i 28 slike nettverk. I Danmark har lungekreftkirurgi vært sentralisert til 5 universitetssykehus siden 2004 [26].
Tilsvarende endringer er sett også i Norge. Antall sykehus hvor man opererer lungekreft er redusert fra 27 på -90 tallet [19] til 8 i dag. I flere helseregioner er det ukentlige tverrfaglige møter på regionssykehusene med multidisiplinære team hvor thorax-kirurger, radiologer, patologer, lungespesialister og onkologer deltar og tar en beslutning om behandling. Det at en lungekreftpasient blir vurdert av et slikt team tillegges stor betydning og blir av mange benyttet som en kvalitetsindikator. Etter en beslutning av et slikt team om ikke-kirurgisk behandling, som for eksempel kjemoterapi, kan ofte selve behandlingen med fordel utføres på mindre sykehus så nær pasientens hjemsted som mulig. Dette sparer pasienten for anstrengende reising og ivaretar behovet for nærhet også til pårørende.
Det finnes flere anbefalinger om palliativ behandling ved lungekreft, både tumorrettet behandling (kirurgi, bestråling og kjemoterapi), og direkte symptomrettet behandling, for eksempel i de nyere norske [38] og de i engelske anbefalinger [39]. Gode og detaljerte anbefalinger for symptomlindrende behandling ved kreft finnes også i Helsedirektoratets publikasjoner [40]. Det legges her vekt på at pasientene skal ha tilgang på behandling av høy kvalitet uansett bosted. De fleste pasienter med langt kommet lungesykdom foretrekker å være hjemme hvis de er sikret en god palliativ behandling [41].
Insidens av lungekreft er økende hos kvinner i Norge. Selv om langtidsoverlevelsen fortsatt er lav, befinner Norge seg blant de bedre landene i Europa, og det er en liten stigning hos kvinner. Studier viser imidlertid betydelige geografiske variasjoner både i forekomst og behandlingen av lungekreft i Norge, og sier lite om kvaliteten av behandlingen for hele populasjonen av lungekreftpasienter.
Elementer for å ivareta kvaliteten: