Av Harald Langberg, seksjonsoverlege dr. med., Nyreavdelingen, Oslo Universitetssykehus, Ullevål
Magnus Trygve Røger, overlege dr. med., Patologisk-anatomisk avdeling, Oslo Universitetssykehus, Rikshospitalet
Ole Kristian H. Furulund, assisterende fylkeslege, Helseavdelingen, Fylkesmannen i Oslo og Akershus
Antinøytrofile cytoplasmatiske antistoffer (c-ANCA) rettet mot proteinase 3 forekommer hos omtrent 70 til 80 % av pasientene med generalisert Wegeners granulomatose (1), men positiv c-ANCA trenger ikke være ensbetydende med denne sykdommen. Vi presenterer sykehistorien til en ung kvinne med medikamentelt behandlet hyperthyreose som utviklet hematuri og positiv c-ANCA uten å ha klinikk forenlig med Wegeners granulomatose. Det var nødvendig med bred ekspertise for å løse de diagnostiske utfordringene. Hvorfor hadde pasienten hyperthyreose? hva var årsaken til at pasienten hadde hematuri? Og hvorfor var c-ANCA positiv?
Pasienten var en 22-årig kvinne. Fastlegen hadde målt forhøyet fritt T4 på 47 pmol/l og ikke målbar thyroideastimulerende hormon (TSH) forenlig med hyperthyreose. Videre var thyroperoxidase antistoff (anti-TPO) forhøyet til 556 kIE/l (referanseområde under 35) medio april 2005. TSH-reseptor antistoff (TRAS) var ikke målt. Trombocytter, nyrefunksjon og katekolaminer i urin var normal. Pasienten ble henvist til videre vurdering ved Ullevål universitetssykehus p.g.a. sin hyperthyreose.
Ved undersøkelse av endokrinkirurg hadde pasienten puls over 100 og et synlig, diffust moderat stort struma. Det ble startet opp behandling med karbimazol (Neo-Mercazole®) 5 mg
x 2 kombinert med propranolol 10 mg x 2 i mai 2005. Pasienten ville ha litt tid til å vurdere om hun ønsket kirurgisk behandling, radioaktivt jod eller medikamentell behandling for sin hyperthyreose.
Ved kontroll i juni 2005 var fritt T4 fortsatt forhøyet til 28,8 pmol/l med ikke målbart TSH, og karbimazol ble økt til 10 mg x 2 da pasienten ikke ønsket kirurgisk behandling.
Senere i juni 2005 ble pasienten lagt inn på gynekologisk avdeling p.g.a. smerter i nedre del av abdomen på høyre side. Det ble funnet en torkvert, multicystisk prosess med utgangspunkt i høyre ovarium, som ble operativt fjernet medio juni 2005. Den cystiske prosessen viste et modent cystisk teratom med foci med struma ovarii, områder med mørkt tett brunlig vev positivt for thyroglobulin forenlig med thyroideavev. På bakgrunn av dette fremstod det som om thyrotoksikosen kom fra teratomet som hadde blitt fjernet. Blodprøver i mai 2005 viste fritt thyroksin på 12,1 pmol/l og TSH på 14,9 mIE/l, slik at behandlingen med karbimazol ble planlagt avsluttet dersom videre blodprøver viste normalisering av thyroideaprøver.
Ved undersøkelse på Ullevål Universitetssykehus i april 2007, ble det funnet normal TSH og fritt T4, men forhøyet senkning på 73 mm. Hun ble henvist til videre utredning hos sin fastlege.
Den videre utredningen hos fastlege, viste at pasienten hadde hematuri og forhøyet c-ANCA over 3 ganger øvre referanseområde.
Ved time på nyrepoliklinikken i slutten av august 2007 fortalte pasienten at etter operasjonen for teratom i høyre ovarium, hadde hun 5 til 6 ganger sett rødlig urin, hatt ubehag over blæren og dysuri. Hun hadde derfor fått behandling for mistenkt urinveisinfeksjon flere ganger tidligere uten at det ble funnet bakterier ved urindyrkning.
Urinstix viste 2+ på røde blodlegemer og 1 + på hvite. Urinmikroskopi var ikke mulig fordi urinprøven ikke var merket med personnavn. Serologiske prøver viste positiv c-ANCA med anti-PR3 på 64 enheter. Øvrige immunologiske og serologiske prøver var negative (ANA, revmatoid faktor (RF), anti-GBM, anti-CCP) og elektroforese var normal. Hormonprøver viste at TSH var signifikant redusert mens fritt T4 var forhøyet til 45,3 pmol/l, thyroksin var på 197 nmol/l, fritt T3 på 23,7 pmol/l og trijodtyronin på 3,9 nmol/l med anti-TPO på 147 kIE/l (referanseområde under 35) og TRAS på 5,6 IE/l (referanseområde under 1,5).
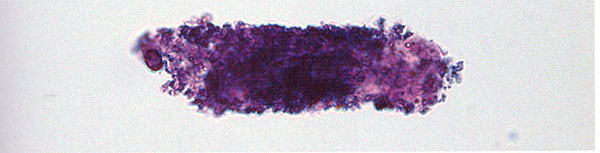
Bilde 1. Modifisert Sternheimer-Malbin farget urinmikroskopi preparat med kornet sylinder som er delvis sterkt lillafarget. Det antas at kornede sylindre består av degenerte cellerester slik at kornede sylindre kan ha forskjellig farge og struktur (10).
Det ble på ny startet med karbimazol i lys av pasientens hyperthyreose, og pasienten ble henvist videre til endokrinologisk avdeling på Aker Universitetssykehus. Thyroidea-scintigrafi viste hyperthyreose med ubetydelig og diffust forstørret glandula thyroidea uten at det ble påvist jod-akkumulerende vev i abdomen.
Kontroll i desember 2007 viste fortsatt positiv c-ANCA med anti-PR3 som hadde økt til 93 enheter. Urinstix var negativ; med unntak av spor av protein. Albumin-kreatinin ratio var 1,14 som var normalt. S-kreatinin var 63 umol/l og albumin 41 g/l med normale elektrolytter i april 2007. Urinmikroskopi viste noe plateepitel og en del leukocytter uten sylindere i urinen.
Serologiske prøver i forhold til AST, CMV og hepatitt A, B, C var negative mens kun IgG var positiv på Epstein-Barr virus; forenlig med tidligere gjennomgått infeksjon. Ingen oppvekst av bakterier eller mycobacterium tuberculosis i urin. CT-thorax, ultralyd nyrer og CT-urografi viste også normale forhold. Da det var uklart hvilken nyresykdom pasienten hadde og dermed hvilken behandling hun skulle ha, ble det ansett nødvendig med nyrebiopsi. Hun hadde normalt store nyrer slik at det forelå ingen kontraindikasjon mot nyrebiopsi.
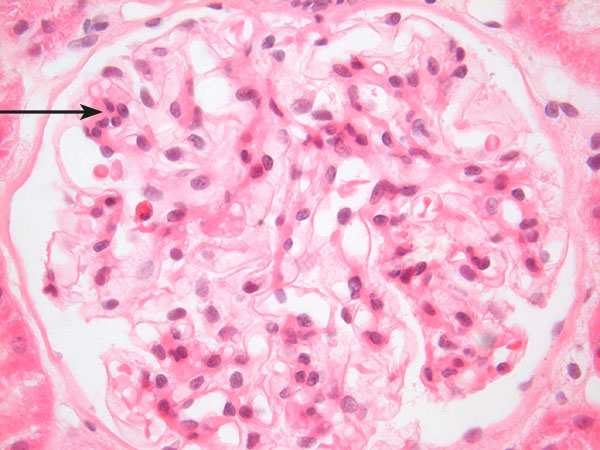
Bilde 2. Lysmikroskopisk bilde av ett av pasientens glomeruli. Mange mesangiale felt viser proliferasjon av celler og matrix; et vanlig funn ved IgA-nefritt. Pilen peker på et slikt område hvor man ser fem mesangiale celler mot normalt maksimum tre. H&E, x600.
Da pasienten møtte til nyrebiopsi i begynnelsen av januar 2008, var hun i god almenntilstand. Blodtrykket var 127/74 mmHg, og hun hadde puls på 88/min, var afebril og uten lymfeknutesvulst langs collum. Ingen ødemer i underekstremitetene. Urinstix viste mulig spor av protein, men var ellers normal. Urinmikroskopi viste en del krystaller og enkelte kornede (jfr. bilde 1) og hyaline sylindre.
Nyrebiopsi ble gjennomført uten komplikasjoner, og viste følgende (jfr. bilde 2).
Foreløpig svar på nyrebiopsien var en diffus proliferativ glomerulonefritt som kunne passe med immun-kompleksnefritt. Man avventet videre spesialundersøkelser.
Pasienten hadde hyperthyreose til tross for at hun hadde fjernet sitt thyroxinproduserende teratom. Hva var nå årsaken til pasientens hyperthyreose?
Det finnes flere årsaker til hyperthyreose; herunder Grave´s sykdom og ulike former for autoimmune thyroiditter (2). Grave´s sykdom er den vanligste årsaken til hyperthyreose. Dette er en form for autoimmun thyroiditt, der thyroidea-stimulerende immunoglobulin (TSI)/thyroidea-reseptor-antistoff (TRAS) binder seg til og stimulerer thyroidea-stimulerende hormon (TSH)-reseptor på thyroidecellemembranen, som resulterer i eksessiv syntese og sekresjon av thyroideahormon (3). Tegn til ødem og inflammasjon i de ekstraokulære musklene og en økning i binde- og fettvev i orbita (Graves oftalmopati) hos en pasient som også har hyperthyroidisme og diffust forstørret struma, er tilstrekkelig til å bekrefte diagnosen Graves sykdom (4). Denne pasienten hadde imidlertid ikke tegn til Grave´s endokrinopati slik at det talte mot at pasienten hadde Grave´s sykdom. 50 % av pasientene med Grave´s sykdom, har imidlertid ikke klinisk, erkjennbar oftalmopati initialt (5). Videre forkommer høy konsentrasjon av anti-TPO også hos omtrent 75 % av pasientene med Graves sykdom (4).
Pasienten hadde både forhøyet anti-TPO og forhøyet TRAS. Anti-TPO er gjerne forhøyet ved autoimmune thyroiditter, som kan gi opphav til hyperthyreose, men som også kan sees hos 3-10 % av friske og hos pasienter med Graves sykdom (6). TRAS vil være positiv hos 80 til 90 % av pasientene med Graves sykdom (7). Thyroideascintigrafien hadde ikke vist tegn til jod-akkumulerende vev i abdomen. Dette talte for at pasientens forhøyede thyroxinnivå ikke var forårsaket av produksjon fra rester av det tidligere thyoxinproduserende teratomet.
Konklusjon: Markert forhøyet TRAS kombinert med kraftig forhøyet anti-TPO og thyroideascintigrafien som viste diffust forstørret glandula thyroidea, talte derfor samlet for at pasienten hadde Graves sykdom. Pasienten ble på bakgrunn av dette behandlet med radioaktiv jod, og fortsatte med Neo-Mercazole p.g.a. vedvarende hyperthyreose, men med noe lavere doser enn tidligere.
Glomerulonefritt kan defineres som en sykdom karakterisert av intraglomerulær inflammasjon og cellulær proliferasjon assosiert med hematuri (8). Klinisk kan glomerulonefritter presentere seg på en av 5 måter (9):
1) asymptomatiske abnorme funn i urin slik som proteinuri i subnefrotisk område, og/eller mikroskopisk hematuri, uten nyresvikt, ødem eller hypertensjon.
2) nefrittisk syndrom med rask debut av hematuri og proteinuri, nyresvikt, salt og vannretensjon, som forårsaker hypertensjon
3) rask progressiv glomerulonefritt der nyresvikt utvikles i løpet av dager til uker, i de fleste sammenhenger ved en nefritisk debut, og som typisk assosieres med patologiske funn av uttalt halvmånedanning i glomeruli ved nyrebiopsi
4) nefrotisk syndrom med proteinuri på mer enn 3,5 gram pr 1,73 kvm i løpet av 24 timer, hypoalbuminemi, hyperlipidemi og ødem
5) kronisk glomerulonefritt med persisterende proteinuri med eller uten hematuri og langsom progressiv svikt i nyrefunksjonen. Ved nyrebiopsi hadde pasienten fått påvist en diffus proliferativ glomerulonefritt.
På bakgrunn av det foreløpige svaret på nyrebiopsien, ble det i mars 2008 startet opp med Prednisolon 15 mg x 2 da pasienten bare veide 45 kg og på denne behandlingen falt c-ANCA fra 93 til 52.
Pasienten hadde hatt intermitterende makroskopisk og mikroskopisk hematuri. Ved urinmikroskopi var det imidlertid kun funnet noen hyaline og kornede sylindre, og dette er ikke-spesifikke funn ved urinmikroskopi: Hyaline sylindre kan også sees hos pasienter uten nyresykdom, men da i et lite antall samt hos pasienter med akutt og kronisk nyresykdom. Kornede sylindre kan en se både ved akutt (for eksempel rhabdomyolyse) og kronisk nyresykdom (for eksempel kronisk glomerulonefritt) (10). Man hadde dessuten ikke sett dysmorfe erytrocytter eller erytrocyttsylindre ved urinmikroskopiene, som gjerne karakteriserer hematuri fra glomeruli (8). Erytrocyttsylindre regnes som særlig typisk for akutt glomerulonefritt, men kan også sees ved kronisk glomerulonefritt og ved andre akutte og kroniske nyresykdommer med høy sykdomsaktivitet (10).
Pasienten hadde altså intermitterende mikro- og makroskopisk hematuri, men hadde normal s-kreatinin, normoalbuminuri, ingen erytrocyttsylindre/dysmorfe erytrocytter i urinen eller halvmåner i nyrebiopsi. Det så derfor ut som pasienten tilhørte gruppen med pasienter med glomerulonefritt som bare hadde unormale funn i urinen. Samtidig var c-ANCA positiv i flere prøver. Antinøytrofile cytoplasmatiske antistoffer (c-ANCA) rettet mot proteinase 3 forekommer hos omtrent 70 til 80 % av pasientene med generalisert Wegners granulo-matose (1), men denne pasienten hadde ikke luftveissymptomer for tiden, selv om hun hadde hatt residiverende luftveisinfeksjoner som barn hvorav noen hadde vært alvorlige. Dette passet ikke helt med diagnosen Wegners granulomatose, som er en småkar vaskulitt som er karakterisert ved granulomatøs inflammasjon i luftveiene og nekrotiserende vaskulitt som affiserer små til mellomstore kar (for eksempel kapillærer, venuler, arterioler og arterier) og der nekrotiserende glomerulonefritt er vanlig (11). Øvre luftveissykdom inntreffer hos mer enn 90 % av pasientene og inkluderer symptomer som sinusitt, nasale skorper, blødning, obstruksjon og kollaps av nesebroen, serøs otitis media med konduktiv døvhet og tracheal stenose. Lungesykdom er vanlig med hoste, haemoptyse og dyspnoe og kan progrediere til livstruende lungeblødning. Nyrene er affisert i opptil 80 % av pasientene; blod, protein og sylindre er til stede i urinen. Hvis tilstanden ikke behandles, kan nyrefunksjonen gå tapt, ofte i løpet av dager (12).
At pasienten ikke hadde mer uttalte luftveissymptomer og ikke hadde nekrotiserende glomerulonefritt med halvmåner, talte således imot at pasienten hadde Wegners granulomatose.
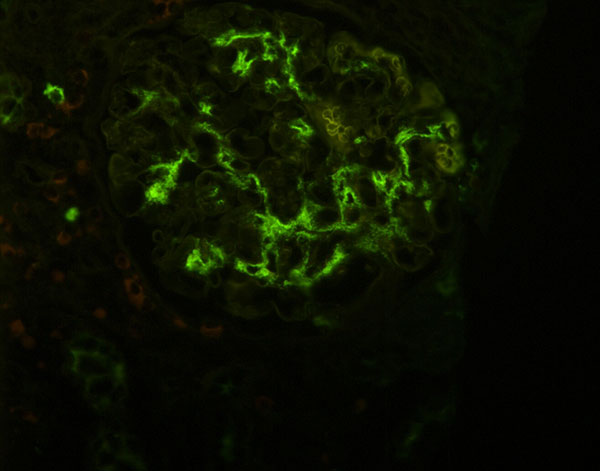
Bilde 3. Direkte immunfluorescens viser nedslag av IgA i mesangiale deler av glomerulus. FITC-konjugert anti-humant IgA, x400. Foto: Erik Heyerdahl Strøm.
Resultat av endelig histopatologisk undersøkelse kom rundt midten av februar 2008. Fra den fremgikk det at immunfluorescens-undersøkelsen var positiv for IgA (jf bilde 3) og sparsom kornet positiv for IgG og IgM. C1q, C3, kappa, lambda og fibrin var negative. Ved elektron-mikroskopi så man glomeruli med elektrontette immunkompleksnedslag lokalisert både i mesangiet og spredt subendotelialt. Det var normalt endotel og fokal fotprosessfusjon. M.a.o. ble den endelig diagnosen IgA-glomerulonefritt, (Haas subklasse IV) (13, 14).
Primær IgA-glomerulonefritt er en immun-kompleks-mediert glomerulonefritt som immunohistologisk er karakterisert av tilstedeværelse av glomerulære IgA nedslag sammen med en rekke andre histopatologiske lesjoner. IgA-nefropati ble først beskrevet i 1968, og antas nå å være en av de vanligste formene for primær glomerulonefritt i verden. I tidlig stadium av sykdommen har mange pasienter ingen åpenbare symptomer, men persisterende eller intermitterende mikroskopisk hematuri og proteinuri kan ha vært oppdaget gjennom flere år. Episoder med makroskopisk hematuri samtidig som pasienten har infeksjon i øvre luftveier, kan også være et debutsymptom hos pasienter under 40 års alder. Man må også være oppmerksom på at sykdommer som antinøytrofil cytoplasmatisk antistoff-assosiert vaskulitt, diabetes nefropati, membranøs nefropati og Wegners granulomatose kan forekomme samtidig med IgA nefropati (15).
Konklusjon: Utfra klinikk og biopsifunn, fremstod det ikke som sannsynlig at denne pasienten hadde Wegners granulomatose, og at årsaken til hennes hematuri var at hun hadde IgA-nefropati.
Pasientens predisolonbehandling ble gradvis nedtrappet og seponert i april 2008. Thyroideaprøvene normaliserte seg og Karbimazol ble seponert. Pasienten forble ANCA-positiv, men med ny analysemetode for PR3, var denne negativ (men positiv med den gamle metoden).
Fra Rikshospitalet ble det opplyst i april 2008 at behandling med Karbimazol kan gi positiv ANCA. Ved litteraturgjennomgang, ble det funnet at Grave´s sykdom kan indusere ANCA positiv medium vaskulitt (16, 17). Likeså kan thyroideasykdom i seg selv gi ANCA positiv vaskulitt (18). D´Cruz et al. publiserte i 1995 (19) 2 tilfeller av ANCA positiv vaskulitt med glomerulonefritt etter behandling av thyrotoksikose med propylthiouracil og Karbimazol der sistnevnte er virkestoffet i Neo-Mercazole. Nyrebiopsier viste i begge tilfellene halvmåner i glomeruli. Bedring kom etter immunhemmende behandling og seponering av antithyroidea medikamentene. I en artikkel i Lancet i 2006 av Bosch et al. (1) fremgår det at selv om bruk av medikamenter som Karbimazol har vært involvert i utvikling av ANCA-assosierte vaskulitter, er de ikke så alvorlige som de primære formene av sykdommene og at seponering av medikamentet generelt sett har ført til redusert ANCA-titre og resolusjon av sykdommen. Videre fremgår det at ANCA med eller uten vaskulitt forbundet med bruk av medikamenter mot forhøyet stoffskifte, gjerne vedvarer flere år etter behandling med medikamentene (1). En assosiasjon med Karbimazol, positiv ANCA og IgA glomerulonefritt, er så vidt vi kan se ikke tidligere beskrevet.
Konklusjon: Pasientens positive c-ANCA hadde sammenheng med hennes behandling med Karbimazol, og denne kasustikken demonstrerer det viktige i at når svar på prøver ikke samsvarer med pasientens klinikk, er det viktig å utrede pasienten videre før man konkluderer m.h.t. diagnose og igangsetter behandling.
Forfatterne ønsker å takke Cappelen Damm Høyskoleforlaget og bioingeniør Bente Urdal Vinje ved Sørlandet Sykehus Kristiansand for lån av urinmikroskopibildet av kornet sylinder og overlege Erik Heyerdahl Strøm ved patologisk avdeling på Oslo Universitetssykehus, Rikshospitalet for lån av immunfluorescens bildet av IgA-nefritt.
Pasienten har samtykket i den aktuelle kasuistikkpresentasjonen.