Hanne Løvdal Gulseth og Kåre I. Birkeland, Avdeling for endokrinologi, sykelig overvekt og forebyggende medisin, Oslo universitetssykehus og Institutt for klinisk medisin, Universitetet i Oslo.
Type 2 diabetes er en viktig folkesykdom, og i Norge behandles årlig i overkant av 130 00 slike pasienter med blodsukkersenkende medikamenter. Individualiserte behandlingsmål og nye diabetesmedikamenter gir gode muligheter for skreddersydd diabetesbehandling i 2013.
Behandling av høyt blodsukker ved type 2 diabetes har tre hovedformål:
Med tilgjengelige behandlings-metoder vil de fleste pasienter kunne holde blodsukkernivået gjennom dagen stort sett under 12-14 mmol/l og derved unngå symptomer som følge av hyperglykemi. Derimot vil en god del pasienter ikke nå de behandlingsmål som er nødvendige for å unngå blodsukkerrelaterte senkomplikasjoner. Dette skyldes både at tilgjengelige medikamenter ikke er effektive nok, at sykdommens natur bare er delvis kartlagt og ikke minst at opplæring, motivasjon og andre pasientrelaterte faktorer begrenser effekten av behandlingen (1).
Hyperglykemien ved type 2 diabetes skyldes en kombinasjon av mangelfull insulinvirkning (insulinresistens) og utilstrekkelig insulinsekresjon (insulinmangel). Hvordan de viktigste organene bidrar til det høye blodsukkeret er forsøkt illustrert i figur 1. Viktigst er kanskje overproduksjon av glukose fra leveren (og til en viss grad fra nyrene) gjennom økt glukoneogenese sammen med forsinket glukoseopptak i skjelettmuskulaturen. Når insulinsekresjonen fra pankreas er utilstrekkelig blir resultatet hyperglykemi. Andre organer bidrar også vesentlig. De siste års forskning har vist at tarmen og fettvevet spiller avgjørende roller og den sentralnervøse styringen av både insulinsekresjonen og insulinvirkningen ser ut til å være av stor betydning. Figur 1 illustrerer de viktigste organene som bidrar til utviklingen av hyperglykemi ved type 2 diabetes og angrepspunktene for antidiabetika (utenom insulin).
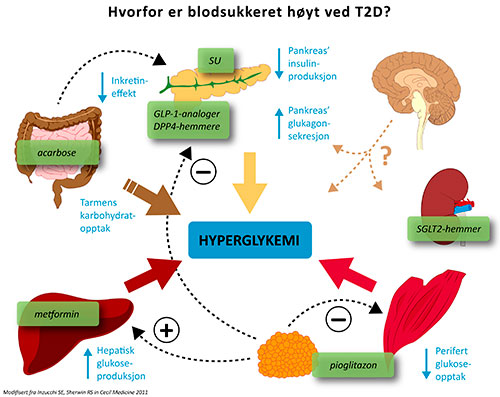
Figur 1. Oversikt over hvordan de ulike organene bidrar til hyperglykemi ved type 2 diabetes, og hvor de ulike klassene av antidiabetika (grønne bokser) virker. Insulin er utelatt fra figuren.
Dagens norske behandlingsanbefalinger ble utarbeidet i 2009 og publisert i Helsedirektoratets Nasjonale retningslinjer for diabetes (2). De bygget på og var stort sett samsvarende med internasjonale retningslinjer den gang, først og fremst anbefalingene fra det europeiske selskapet for diabetesforskning (EASD) og den amerikanske diabetesforeningen (ADA) (3). En behandlingsalgoritme som oppsummerer anbefalte valg av blodsukkersenkende tiltak fra disse retningslinjene er vist i figur 2 (2). Kort oppsummert anbefales livs-stilsråd med fokus på kost og fysisk aktivitet som hjørnestein i behandlingen. Dette startes hos alle pasienter når diagnosen er stilt, og 20-30% av pasientene vil nå behandlingsmålet med slik behandling alene (4). Når dette ikke er tilstrekkelig, anbefales metformin som førstevalgsmedikament hos de fleste pasientene. Metformin har fått en stadig mer sentral plass i behandlingen, og de fleste retningslinjene aksepterer nå også metforminbruk ved mild og moderat redusert nyrefunksjon med eGFR ned til 45 ml/min/1,73 m2. Når livsstilsråd og metformin ikke er tilstrekkelig til å kontrollere blodsukkeret, anbefales kombinasjon med et sulfonylurea eller en basal dose insulin. En alternativ behandlingsstrategi er angitt til høyre i figur 2 som ”mindre godt validerte behandlingsformer”, og kan prøves i utvalgte tilfeller. Den inkluderer de nyere medikamentene glukagon-liknende-peptid-1 (GLP-1)-analoger (exenatid, liraglutid og lixisenatid), dipeptidyl-peptidase-4-(DPP4)-hemmere (sitagliptin, vildagliptin, saxagliptin og linagliptin) og pioglitazon. Hos 10-20% av pasientene ender man med behov for insulin i flerdoseregime, stort sett på grunn av langvarig sykdom med svært redusert egenproduksjon av insulin. Behandlingsmålet, og indikasjon for å intensivere behandlingen, ble i disse retningslinjene anbefalt å være HbA1c ≤ 7%. Det fremgår imidlertid tydelig i teksten både i de norske og internasjonale anbefalingene at individuelle hensyn bør tas både i valg av medikamenter og når man skal bestemme seg for behandlingsmål.
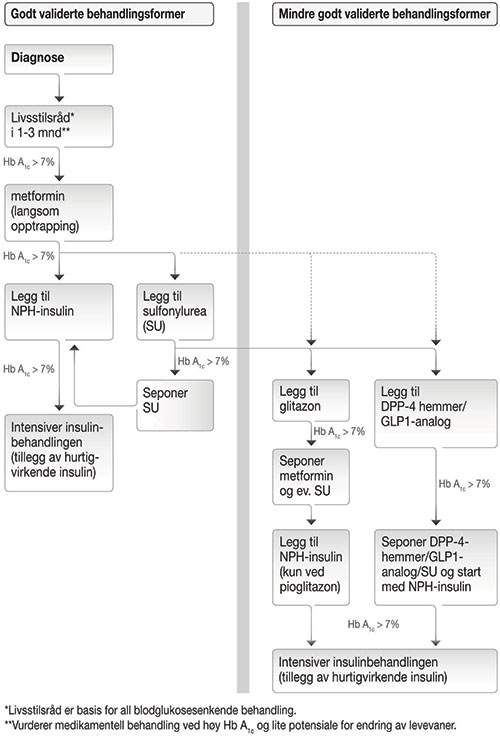
Figur 2. Behandlingsalgoritmen for blodsukkersenkende behandling ved type 2 diabetes fra Nasjonal faglig retningslinje – Diabetes i 2009 (2). Livsstilsråd med vekt på kosthold og økt fysisk aktivitet utgjør første steg, etterfulgt av metformin ved behov for medikamentell behandling. Deretter anbefales sulfonylurea eller en basal dose insulin i det godt validerte behandlingsalternativet (venstre side), eventuelt kan glitazon, DPP-4 hemmer eller GLP-1 analog velges i et mindre godt validerte behandlingsalternativ (høyre side).
Disse internasjonale retningslinjene (3) utløste en god del debatt, hovedsakelig begrunnet i at evidensen for å foretrekke ett medikament fremfor et annet var mangelfull. Mange kritikere, godt hjulpet av den farmasøytiske industri, ville løfte sterkere frem DPP4-hemmere og GLP-1 analoger som gode blodsukkersenkende medikamenter med dokumenterte resultater gjennom senere års forskning (5). Videre reiste man spørsmål om det var riktig å ha et så vidt strengt behandlingsmål som HbA1c < 7% for alle pasientene, særlig etter at ACCORD-studien ble stanset på grunn av økt mortalitet i en gruppe pasienter som ble intensivt behandlet med målsetning HbA1c < 6,5% (6). EASD og ADA nedsatte derfor en ekspertgruppe, som i 2012 fremmet forslag til nye og reviderte behandlingsanbefalinger (1). Behandlingsalgoritmen fra disse anbefalingene er vist i norsk oversettelse i figur 3. Det vesentlig nye er at man ikke lenger har klare prioriteringer for valg av tilleggsmedikament når livsstilsendringer og metformin ikke er tilstrekkelig. Alle tilgjengelige alternativer settes på samme nivå med angivelse av fordeler og ulemper for de enkelte medikamentgruppene. Det anbefales at legen i samråd med pasienten velger det medikamentet som best passer i det enkelte tilfellet. Individualisering så vel av behandlingsvalg som av behandlingsmål kan stå som overskrift over de nye retningslinjene.
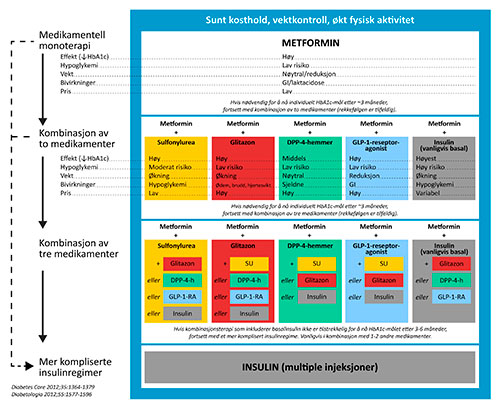
Figur 3: Norsk oversettelse av forslag til blodsukkersenkende behandling ved type 2 diabetes utgitt av EASD og ADA i 2012 (1). Sunt kosthold, vektkontroll og økt fysisk aktivitet er grunnlaget, følg deretter pilene trinnvis nedover. Medikamentgrupper på samme nivå er likestilt, og gradering av effekt, risiko for hypoglykemi, effekt på vekt, bivirkninger og pris er angitt for hver enkelt medikamentgruppe. Anbefalingene vektlegger i stor grad individuelle hensyn ved den enkelte pasient. Målet er best mulig blodsukkerkontroll med minst mulig bivirkninger og best samfunnsøkonomi. SU: sulfonylurea, DPP-4-h: Dipeptidylpepetidase-4 hemmer, GLP-RA: GLP-1 analog (reseptor agonist).
Denne oppsummeringen av de nye internasjonale behandlingsanbefalingene er selvsagt sterkt forenklet og yter ikke rettferdighet til det grundige arbeidet som er gjort og som fremgår av den leseverdige sluttrapporten (1). Her gis en oversikt over de ulike medikamentenes fordeler og ulemper og den evidens som ligger til grunn for anbefalingene. Den sterke betoning av individuelle pasienthensyn og –preferanser passer godt med den praksis norske leger har fulgt i mange år. Vektlegging av diabetesvarighet og forventet livslengde, pasientens motivasjon for god kontroll, komorbiditet og eventuelle komplikasjoner. I tillegg er kompleksiteten av behandlingsregimer og ikke minst kostnader for den enkelte og samfunnet viktige elementer som må tillegges vekt i valg av behandling.
En mulig ulempe ved den forenklede anbefaling som fremstår i figur 3, er at markedsførerne av legemidler nå har fått stort spillerom for påvirkning av leger til forskrivning av kostbare nye medikamenter med tvilsomme fordeler fremfor de eldre og billige. Et eksempel er diskusjonen om bruk av velkjente sulfonylurea versus nye DPP4-hemmere, hvor det i markedsføringen sterkt hevdes at de nye medikamentene er å fortrekke. Det er ingen holdepunkter for at den blodsukkersenkende effekten av DPP4-hemmere er bedre enn for sulfolynlurea, snarere er det en tendens til det motsatte (7). Bivirkningsprofilen kan imidlertid tale for å velge DPP4-hemmere, særlig hos pasienter som er utsatt for hypoglykemi eller hvor man frykter sulfonylurea-assosiert vektøkning. Det er foreløpig uavklart hvorvidt det er forskjell i sikkerheten ved langtidsbehandling med de to medikamentgruppene, og langtidsstudier for å avklare dette pågår. Inntil slik kunnskap foreligger, anbefaler vi å legge betydelig vekt på den lange erfaringen med bruk av sulfonylureapreparater og de store prisforskjellene mellom medikamentgruppene i valg av medikament.
Et annet behandlingsdilemma er valg av injeksjonspreparat når perorale midler ikke er tilstrekkelig for å kontrollere blodsukkeret. Tradisjonelt har vi anbefalt start av basal insulin, gjerne som en enkelt dose NPH-insulin til natten som er god behandling. Et alternativ er å forsøke GLP-1 analog som kan gis 2 ganger daglig (exenatid), en gang daglig (liraglutid og lixisenatid) eller en gang ukentlig (exenatid). Den blodsukkersenkende effekten av GLP-1 analog er i sammenliknende studier stort sett minst like god som av basalinsulin (1), men slike studier er svært avhengig av intensiteten i oppfølgingen og opptrappingen av insulindosene og er ikke så lette å tolke. Sannsynligvis har insulinbehandling større potensial for blodsukkersenkning ved riktig bruk og god motivasjon hos pasient og behandler, mens behandling med GLP-1 analog kan være enklere å gjennomføre. Bivirkningene er særlig kvalme og andre gastrointestinale plager ved GLP-1 analoger og hypoglykemi og vektøkning ved insulinbehandling. Risikoen for hypoglykemi er vanligvis lav ved begge behandlingsformer, men er nok noe lavere ved bruk av GLP-1 analog (8). Mens langtidseffektene av insulinbehandling er godt kjent og behandlingen må oppfattes som trygg, er det flere uavklarte forhold omkring bruken av GLP-1 analoger. Det gjelder særlig mulig økt risiko for pankreatitt og kreft i bukspyttkjertel og glandula tyreoidea. Disse spørsmålene og eventuelle fordeler eller ulemper i forhold til risiko for hjerte-/ karsykdommer forsøkes avklart i pågående langtidsstudier. Inntil slike foreligger anbefaler vi at basalinsulin er førstevalget når injeksjonsbehandling er nødvendig, mens GLP-1 analoger benyttes i spesielle tilfeller, særlig når det er viktig å unngå vektøkning og hypoglykemi.
En ny medikamentgruppe har nylig fått markedsføringstillatelse og vil bli tatt i bruk i behandlingen av type 2 diabetes. Det er medikamenter som hemmer tilbaketransporten av glukose fra preurinen til blodet, og således øker nyrenes glukoseutskillelse (selektiv natrium-glukose-kotransporter-2-(SGLT2)-hemmere). Det første medikamentet som kommer på markedet er dapagliflozin og studiene viser at det reduserer HbA1c med i størrelsesorden 0,5-1%, altså omtrent som DPP4-hemmere (9). Bruken er også assosiert med en viss vektreduksjon i størrelsesorden 2-3 kg over 6-12 mnd. De hyppigste bivirkningene er en økning av infeksjoner i urinveier og genitalia, særlig hos kvinner. Langtidseffektene er foreløpig ukjente. Flere nye medikamenter i klassen av GLP-1 analoger og DPP4-hemmere, samt nye insulinpreparater med endret farmakokinetiske egenskaper kommer snart i salg.
Et økende antall pasienter også i Norge opereres årlig for sykelig overvekt, og om lag 1/3 av disse har type 2 diabetes (10). Både norske og internasjonale erfaringer viser at mange av disse pasientene får normalisert blodsukkeret etter operasjon og kan seponere blodsukkersenkende medikamenter. Virkningen ser ut til være størst hos pasienter med kort diabetesvarighet (< 2 år) og i de første årene etter operasjonen. Operativ behandling er et alternativ som bør vurderes hos utvalgte motiverte pasienter med alvorlig fedme og metabolske risikofaktorer.
Det er en rekke behandlingsmetoder tilgjengelig for blodsukkerreduksjon ved type 2 diabetes. Grunnleggende er god opplæring om sykdommen, motivasjon og livsstilsrådgivning med fokus på fysisk aktivitet, et sunt kosthold og vektreduksjon hos overvektige. De nærmeste årene vil gi oss resultater av en rekke langtidsstudier med GLP-1 analoger, DPP4-hemmere og SGLT2-hemmere som vil avklare disse nye medikamentenes rolle. Individualiserte behandlingsmål og et stort utvalg av antidiabetika med ulik virkningsmekanisme og bivirkningsprofil gir gode muligheter for skreddersydd diabetesbehandling i 2013.
Forfatterne takker Øystein H. Horgmo, Foto- og videotjenesten, Institutt for klinisk medisin, UiO for hjelp med figur 1 og 3.