Kristian F. Hanssen, overlege prof. dr med, Endokrinologisk avdeling OUS.
Med diabetes kan følge komplikasjoner. Artikkelen går gjennom de vanlige komplikasjonene til sykdommen. Det er viktig å kjenne til disse og årsakene som ligger bak, både for å forebygge og for å forstå pasienten.
Både type 1 og type 2 diabetes er i sterk økning i Norge. For type 2 diabetes kjenner vi de grunnleggende årsakene, nemlig fedme, usunn kost og muligens mindre bevegelse. For type 1 diabetes kjenner vi ikke årsakene til sykdommen.
Diabetiske senkomplikasjoner er prinsipelt de samme ved begge diabetestyper, men farges av alderen, de med type 2 diabetes er eldre og har mer koronarsykdom og har mer makulaødem.
Senkomplikasjonene er av to typer:
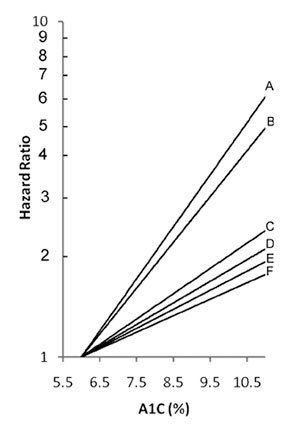
Figure 1. The relationship between updated A1c and the multivariable adjusted hazard of various chronic consequences of diabetes in participants in the UKPDS based on the reported difference per 1% higher A1c level.1 The hazard ratio of an A1c of 6% was set at 1.0. Line A, Amputation or death resulting from peripheral vascular disease (43% per 1%); B, retinal or renal disease (37% per 1%); C, cataract extraction (19% per 1%); D, heart failure (16% per 1%); E, myocardial infarction (14% per 1%) and all-cause death (14% per 1%); and F, stroke (12% per 1%). The same results are shown on a linear scale (left) and a log scale (right).
(Bildet trykkes med tillatelse).
Hyperglykemi er den avgjort viktigste årsaksfaktoren for mikrovaskulære komplikasjoner (1), og kan anslagsvis forklare 60-70 % av komplikasjonene både ved type 1 og type 2 diabetes. Senkomplikasjoner oppstår vanligvis ved lang varighet av diabetes, dvs det er en akkumulert opphopning av glukose (glykemisk belastning). Et interessant forhold er kroppen “husker” høyt blodsukker i årevis selv om blodsukkeret i mellomtiden er blitt lavere (glycemic memory or legacy effect). Hvordan hyperglykemi skader blodårene er ikke endelig kartlagt, men kombinasjonen glykering av proteiner (Advanced Glycation Endproducts (AGE)) og oksydativt stress er viktigst. Det synes vesentlig å være gjennomsnittsnivået av blodglukose (bedømt ved HbA1c) og ikke svingningene i blodsukkeret som er viktigst. (fig.1).
Andre viktige faktorer er kardiale risikofaktorer (hypertensjon, hyperlipidemi, lavgradig inflammasjon) og genetiske faktorer.
Dette er vesentlig skade av blodårene i retina, men for eksempel katarakt er også hyppigere. Skaden i retina begynner som utposning av arteriolene (mikroaneurysmer) og etter hvert lekkasje av plasma (harde eksudater), blødninger og evt bløte eksudater (som er mikroinfarkter i nervetrådlaget i retina). Den fryktede utviklingen er nydannede blodårer (proliferasjoner) i retina. (bilde). Dette skyldes hypoksi i retina og formidles vesentlig via sekresjon av Vaskular Endotelial Growth Factor (VEGF). Disse nydannete blodårene er skjøre og blør lett inn i glasslegemet. Dette fører til akutt synstap og er en skremmende opplevelse for pasienten. Makulaødem er lekkasje av plasma særlig ved makula som også kan føre til synsnedsettelse. Forekomsten av proliferativ retinopati og nefropati er i dag mindre enn for 20-30 år siden (2-4). Proliferativ retinopati er nå redusert fra 47 til 13 % etter 20-25 års diabetesvarighet og nefropati fra 28 til 6 % i et dansk materiale (2). Tilsvarende tall er funnet i Norge (3,4). Dette skyldes mest bedre blodsukkerregulering og hypertensjonsbehandling.
Behandling av diabetisk retinopati: Det er en eksplosjon i muligheter for å behandle diabetes retinopati. Det viktigste er å oppdage den. I motsetning til hva mange pasienter tror, er synsforandringer ved diabetes retinopati et sent fenomen. En må altså gå til regelmessig kontroll. (faktarute 1).
Laserbehandling, brukes ved uttalt ikke proliferativ retinopati og proliferativ retinopati. Dette har vist seg å være noe effektivt, men laser fører til destruksjon av av de flekkene som er laserbehandlet.
Ved blødning inn i glasslegemet som ikke klarer opp, bruker en vitrektomi hvor en fjerner glasslegemet.
Dette kan være en synsreddende behandling. Det gjøres mange flere glasslegeme-operasjoner i Norge enn i våre naboland, sannsynligvis fordi vi ikke har like gode rutiner for å oppdage retinaskader tidlig som de har: nemlig rutinemessig retinafotografering uten besøk hos øyelege hos alle med diabetes! Dette bør vi innføre snarest i Norge!
Ny behandling ved proliferativ retinopati og makulaødem er injeksjon av antistoff mot VEGF i øyet og injeksjon av steroider. Dette synes å kunne redusere behovet for vitrektomi.
Dette er den vanligste årsak til dialyse og nyretransplantasjon i de fleste vestlige land, men er ikke fullt så hyppig i Norge. Den begynner som en sykdom i glomerulus med nedslag av glykerte proteiner og forandringer i podocyttfunksjonen som gi økt albuminlekkasje over glomerulusmembranen. Derfor er litt økt mengde albumin i urinen (mikroalbumin)(30-300 mg/døgn) første tegn på diabetisk nefropati. Vi måler det i dag vesentlig som albumin/kreatinin-ratio i spoturin (>2.5 mg/mmol er økt).
Diabetisk nefropati utvikler seg bare hos de som har økt HbA1c (>7.5-8.0 %) og kommer vanligvis først etter 10-15 års diabetesvarighet. Diabetes-nefropati er en reversibel tilstand i den tidlige mikroalbuminuriske fasen ved god blodsukker- og blodtrykksbehandling. Selv når det er utviklet makroalbuminuri (> 300 mg albumin/døgn) kan sykdommen i noen tilfelle reverseres eller stanse opp. For 20 år siden fikk alle progresjon med økende nedsatt GFR; slik er det ikke lenger med god behandling. De siste årene er det imidlertid økende oppmerksomhet at noen med diabetes får tiltakende nedsatt GFR uten å ha hatt albuminuri tidlig. Disse har nok oftere andre nyresykdommer som årsak til den nedsatte GFR, særlig ser vi her nefrosklerose.
Behandling av diabetisk nefropati. Alle med albuminuri skal ha ACE hemmer eller A2 antagonist, også de uten hypertensjon. Blodtrykksmålet er < 130/80. En bruker gjerne ACE hemmer eller A2 blokker som førstevalg, men det kreves ofte en kombinasjon av flere antihypertensive medisiner (diuretika, kalsiumblokker, alfa-/beta-blokker). Kombinasjonen av ACE hemmer og A2 blokker bruker en mindre nå. Det ser ut som albuminurien i seg selv bidrar til progresjon av nyresykdommen, og en forsøker derfor å redusere albuminurien ved antihypertensiv behandling. Diabetisk nyresykdom er i enda større grad enn andre nyresykdommer assosiert med hjertesykdom, så her er det svært viktig å behandle andre risikofaktorer for hjertesykdom effektivt (LDL kolesterol, hypertensjon effektivt).

a) Pasienter med påvist retinopati kontrolleres av øyelege etter individuelt opplegg. Optimalt bør øyeundersøkelsen bestå av både fundusfotografering og oftalmoskopi. Fundusfoto kan også beynttes i organiserte screeningprosjekter. Bildene kan som regel tas av tekniker, men skal vurderes av øyelege.
b) Hvis det foreligger mikroalbuminuri bør undersøkelsen gjentas etter 3-4 måneder.
Symptomer ved diabetisk nevropati: nedsatt følelse, prikking eller stikking I føttene, brennende eller verkende smerter. Definisjon av sannsynlig perifer diabetisk nevropati: to eller flere av følgende: nevropatiske symptomer, nedsatt følelse distalt og nedsatt eller opphevede ankelreflekser.
Det er to typer perifer nervefibre: tykke fibre og tynne fibre. De tykke fibrene har grovt sett mest med motorisk funksjon og enkelte sensoriske funksjoner. De tynne fibrene er flest i antall, har bl.a. med kulde-/varme-følelse og smerter. Disse har tidligere vært vanskelige å undersøke, men nye avanserte tekniker har gitt oss ny kunnskap. Dessverre er det tidkrevende å kartlegge en diabetisk nevropati fordi ikke alle pasienter har samme kombinasjon av utfall. Det betyr at en må undersøke både motoriske og sensoriske funksjoner. Nerveledningshastighetsbestemmelse er en god måte å kartlegge funksjonen til de tykke fibrene ), men sier ikke noe om tynnfibrestatus. Kombinasjon av hudfølelse, vibrasjonssans, symptomer og tegn er her viktige.
Symptomene er oftest prikking og stikking, evt følelsestap med følelse av å gå på puter. Polynevropati begynner alltid lengst perifert, og er symmetrisk. Det finnes også diabetiske monopatier som har annen utbredelse.
Ca 20 % av de med diabetisk nevropati har smerter som kan være svært plagsomme. Smerteintensiteten kan variere betydelig. Ved smertefull nevropati virker vanlige smertestillende medisiner dårlig. De medisinene som har vist noe virkning er særlig Imipramin, Sarotex og Cymbalta. Ved svært dårlig blodsukkerkontroll (HbA1c > 9-10 %) over minst fem år, kan det komme en akutt smertefull nevropati som synes å skyldes direkte toksisk virkning av det høye blodsukkeret på perifere nerver.
Diabetisk nevropati er en utelukkelsesdiagnose. Differensialdiagnostisk må man altså utelukke andre årsaker, som for eksempel alkohol, vitaminmangel, cancer, og arvelige nevropatier.
Diabetisk autonom nevropati er viktig, men kan være vanskelig å oppdage. Vi har relativt grove tester for formålet. Autonom nevropati omfatter både sympatisk og parasympatisk innervering. Vi bruker oftest kardiovaskulære tester til formålet: Beat to beat variasjon i EKG, ortostatisk test og forsinket ventrikkeltømning, blæretømning og diabetisk diarre kan være tegn på autonom nevropati.
Det er spekulert mye om kardial autonom nevropati er en selvstendig årsak til hjertedød. Det er vanskelig å avgjøre, fordi de som har uttalt kardial autonom nevropati oftest også har andre senkomplikasjoner fra hjertet, og evt.nyrer.
Behandling: Vi har ingen behandling rettet mot årsaksforholdene ved diabetisk nevropati annet enn god blodsukkerkontroll.
Diabetes impotens: Er en kombinasjon av nevropati og vaskulære komplikasjoner som dessverre er vanlig ved langvarig diabetes. Kan i ca 70 % behandles med fosfodiesterasehemmere.
Sår på de vektbærende deler av føttene er hyppig og kan være farlig ved diabetes. Diabetisk nevropati fører til svekket musklatur som gjør at en i første omgang får hard hud på vektbærende deler av foten og senere lettere sår. Kombinasjonen av diabetes nevropati, perifer aterosklerose og infeksjon er spesielt farlig og kan medføre amputasjon av foten i løpet av få dager, hvis den ikke behandles skikkelig (5). Det er svært viktig å ha tverrfaglige team (fotterapeut, diabetessykepleier, indremedisiner, kirurg (ortoped/karkirurg) og ortopediingeniør. Fotsår kan forebygges med fotsenger (individuelt tilpassede fotsåler som fordeler trykket under foten bedre (ref. av NAV). Mange vil ha glede av å gå regelmessig til fotterapeut.
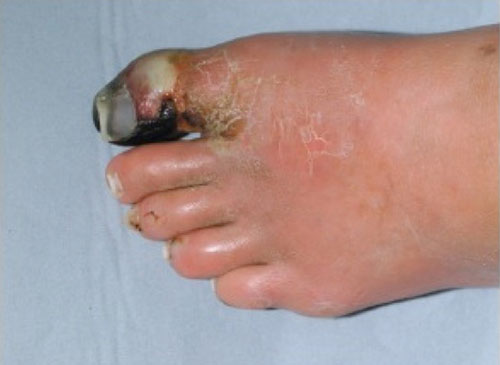
Fig. 2: Diabetisk fot med infeksjon, såret begynte under foten pga trykk og utviklet seg videre med infeksjon.
10 % av pasienter med diabetes i Nord-Trøndelag hadde hatt et diabetisk fotsår. Det var assosiert med høy HbA1c, varigheten av diabetes og insulinbehandling, og de hadde doblet dødelighet ved oppfølging (6). I et materiale fra Hedmark hadde 50 % av de som ble amputert diabetes, og de hadde betydelig dødelighet etter operasjonen (7).
De mikrovaskulære komplikasjonene opptrer ofte sammen. Det er ikke overraskende fordi alle har en “glykemisk belastning” som hovedårsak. Diabetisk retinopati er hyppigst, men ofte forekommer her bare noen mikroaneurysmer uten funksjonell betydning. Diabetisk nefropati opptrer nesten ikke uten at det er diabetisk retinopati samtidig, og dette kan brukes differensialdiagnostisk:
Nyresykdom hos pasienter med diabetes, men uten retinopati skyldes oftest andre nyresykdommer enn diabetisk nefropati.
Etablert type 1 og type 2 diabetes har betydelig oversykelighet og overdødelighet av koronarsykdom. Det skyldes at pasienter med diabetes får tidligere og mer uttalt arteriosklerose i koronarkarene. De vulnerable plakk er vanligere. Forskjellen mellom kvinner og menn i forekomst av koronar dødelighet er stort sett opphevet ved diabetes. Det betyr at den relative risiko for hjertesykdom er mest økt hos kvinner. Unge kvinner under 40 år med type 1 diabetes har hatt ca 5 ganger høyere dødelighet av koronarsykdom, sammenlignet med kvinner i bakgrunnsbefolkningen, men dette er i bedring. Omvendt har over 50 % med nyoppdaget hjertesykdom nedsatt glukosetoleranse eller diabetes når en gjør en glukosebelastning (8).
HUNT studien har vist halvert dødelighet av koronarsykdom både i bakgrunnsbefolkningen og blant de med diabetes i løpet av 20 år. Det betyr at den 2 ganger økte overdødeligheten ved diabetes dessverre har holdt seg nokså uforandret (9). De viste også at overdødeligheten særlig var knyttet til de med høy HbA1c, og dødeligheten økte med 30 % for hvert prosentpoeng HbA1c (10).
Etter tre nye studier (ACCORD, ADVANCE og VADT) har man diskutert om det er “farlig” å ha HbA1c under 7 %. Disse studiene pågikk bare i 2-3 år. Jeg er enig med del Prato (11) som mener at dårlig blodsukkerkontroll i en årrekke ikke lar seg korrigere gunstig i løpet av 2-3 år. Derfor tror jeg resultatene fra disse tre studiene ikke er så avgjørende for diabetikerne i sin alminnelighet.
Diagnostikk av koronarsykdom ved diabetes kan være vanskelig, arbeids-EKG er ikke god som screeningtest, da diabetikere har mindre brystsmerter som tegn på sin koronarsykdom (12). Symptomene kan bare være tretthet og moderat dyspnoe ved anstrengelser. En må derfor benytte andre tester som scintigrafi, koronar CT med kontrast og koronarangiografi med en videre indikasjon enn hos personer uten diabetes.
Det er omdiskutert om det eksisterer en spesifikk diabetisk kardiomyopati, altså en hjertemuskellidelse uten signifikant koronarsykdom. I dyreeksperimentelle modeller kan en lett vise dette, men det er usikkert om det finnes i ren form hos menneske. Jeg mistenker at subklinisk koronarsykdom i mange tilfeller har vært årsak til forstyrrelser som er blitt tolket som diabetisk kardiomyopati.
Vi ser nå ved type 1 diabetes at de alvorlige komplikasjonene er i sterk nedgang, særlig på grunn av bedre blodglukoseregulering og effektiv hypertensjons- og lipidbehandling. Vi har nå en stor gruppe “overlevere” med langvarig type 1 diabetes av mer enn 30 års varighet. Men en del av dem har uklare symptomer på mindre “reservekrefter” enn normalt, og gruppen fortjener større forskningsmessig oppmerksomhet enn de har fått til nå.
Det er to viktige spørsmål angående diabetes og hjernepåvirkning:
Til 1: Den eneste randomiserte studien som er utført, tyder ikke på at de med mange hypoglykemier får mer kognitive forstyrrelser enn de uten hypolykemier. Men en studie fra Trondheim tyder på at barn med type 1 diabetes som har hatt alvorlige hypoglykemier (bevisstløshet og/eller kramper) kan få moderat redusert kognitiv funksjon etter mange år. Dette er imidlertid ikke funnet sikkert hos voksne.
Til 2: Epidemiologiske studier tyder på ca 50 % økning av demens ved type 2 diabetes. Dette dreier seg om vaskulær demens knyttet til mikro- og makrovaskulær sykdom. Det er usikkert om ren Alzheimers demens er økt ved type 2 diabetes (14).
Frossen skulder, Dupuytrens kontraktur, spring-finger, stiv hånd/fot og karpaltunel syndrom er vanligere hos personer med diabetes enn hos andre. Årsaken er ukjent, men det er nærliggende å tro at forandringer med kryssbinding av kollagen med glukosemetabolitter (glykering) forklarer en del. Forekomsten øker med diabetesvarigheten, og pasienter som har mikrovaskulære komplikasjoner, har oftere slike forandringer. Det er ikke funnet spesielle karakteristika ved de som har slike forandringer og diabetes, og behandlingen er den samme som hos mennesker uten diabetes. Mye tyder på at stiv hånd er blitt mindre vanlig ved diabetes de senere år med bedre blodsukkerregulering. Det er behov for betydelig mer forskning når det gjelder bindevevet.
Det er viktig å behandle både lipider, hypertensjon og blodsukkeret for å forebygge diabetiske senkomplikasjoner. Behandlingsmålet for blodsukkeret er oppnå HbA1c omkring 7.0% og ca 8.0 % hos de over 75 år. Dette kan være lett ved relativt nyoppdaget type 2 diabetes, men kan være vanskelig ved langvarig type 1 og type 2 diabetes. Det er viktig å etablere god blodsukkerkontroll helt fra starten ved begge diabetesformer fordi kroppen åpenbart “husker” blodsukkernivåer flere år tilbake og høye blodsukkernivåer tidlig kan derfor gi grunnlag for komplikasjoner.
En stor del av kostnadene ved diabetes er knyttet til senkomplikasjonene. I Canada er det beregnet at diabetes koster ca 12-15 % av de totale helsekostnadene. En stor andel av dette går til å behandle senkomplikasjoner (14). 50 % av dette synes å være sykehusomkostninger i henhold til en europeisk studie. Mest kostnadsdrivende er hjertesykdom og diabetisk fot. All sannsynlighet taler for at den store økningen vi har av type 2 diabetes vil føre til økte kostnader, men kan bedre behandling og forebyggelse av senkomplikasjoner minske økningen i kostnader? Det eneste som virkelig nytter i et større perspektiv, er å forebygge diabetes. Dette er også et samfunnsansvar (15).
Behandlingen av senkomplikasjoner ved diabetes er blitt mye bedre og dødeligheten er falt sterkt. Men slaget er ikke vunnet! I Norge er den relative dødeligheten av hjertekarsykdom ved diabetes nærmest uforandret. Vi ser også at en del med langvarig diabetes får vanskelig tolkbare symptomer med mindre energi og “reservekrefter” og økte plager fra bindevevet. Dette kan kanskje sammenlignes med sen plager etter andre sykdommer?