Av Erik Fink Eriksen, overlege, professor dr.med. Avd. for Endokrinologi, Sykelig Overvekt og Forebyggende Medisin, Oslo Universitetssykehus
Vi har sett en stor utvikling i osteoporosebehandlingen de siste 30 år, og det har nå kommet et stort antall behandlingsalternativer. Mens østrogen nå kanskje får en renessanse, er calcitonin trukket fra markedet som osteoporosebehandling. De nye spesifikke terapiene for osteoporose viser størst relativ og absolutt risikoreduksjon.
Formålet med denne korte oversikt er å beskrive de nyeste behandlinger av osteoporose, som er kommet på markedet de siste 3 år eller fortsatt er i fase 3 testing (Tabell 1), men også å gi en oppdatering på nye data i relasjon til etablert behandling av osteoporose.
For 30 år siden hadde man kun tilgang til hormonbehandling med østrogen og calcitonin for behandling av osteoporose. Siden har utviklingen gitt oss mange nye behandlingsmuligheter (Tabell 1). Dette omfatter forskjellige perorale og parenterale bisfosfonater, som primært hemmer osteoklastaktiviteten, så vel som et monoklonalt antistoff (Denosumab (Prolia)), som nesten totalt hemmer differensiering av osteoklaster (Figur 1). Utviklingen har også gitt oss anabole terapier i form av parathyreoidea hormon, som ved intermitterende subkutan administrasjon bygger opp til 60% mer ben i skjelettet etter 2 års behandling (Figur 1). Enda et nytt konsept basert på et annet monoklonalt antistoff ser ut til å kunne gjøre samme jobb på skjelettet som PTH på bare 6 måneder.
Til denne gruppen hører: østrogener, testosteron, selektive østrogen reseptor modulatorer (SERMs), bisfosfonater og anti-RANK ligand monoklonalt antistoff (Denosumab). Deres primære effekt på ben er å redusere remodelleringsaktiviteten, som medfører et mer stabilt skjelett, uten å bygge inn mer ben. Behandlingen reduserer risiko for brudd i ryggen med opp til 70 %, hoftebrudd med 40-50 % og andre brudd i det perifere skjelettet med 20-25 %. Størst relativ risikoreduksjon er sett etter behandling med Zoledronsyre (1) og Denosumab (2), men direkte sammenliknende studier av antiresorptive farmaka med frakturer som endepunkt er ikke publisert.
Mens DXA (Dual-energy x-ray absorptiometry)-måling fortsatt er førstevalg ved kontroll av behandlingseffekt, kan effekten av disse stoffene også monitoreres ved måling av benmarkører i serum. Benmassen forventes å øke de første 2-3 år, for deretter å forbli rimelig stabil. Hvis man bruker benmarkører, vil optimal behandlingseffekt gjerne karakteriseres av nivåer omkring nedre referansegrense hos premenopausale kvinner. Økninger i benmarkørene på mer enn 30 % kan karakteriseres som signifikante, idet den klinisk meningsfulle endring (”least significant change”) ligger i nivået 21-28 % (3).
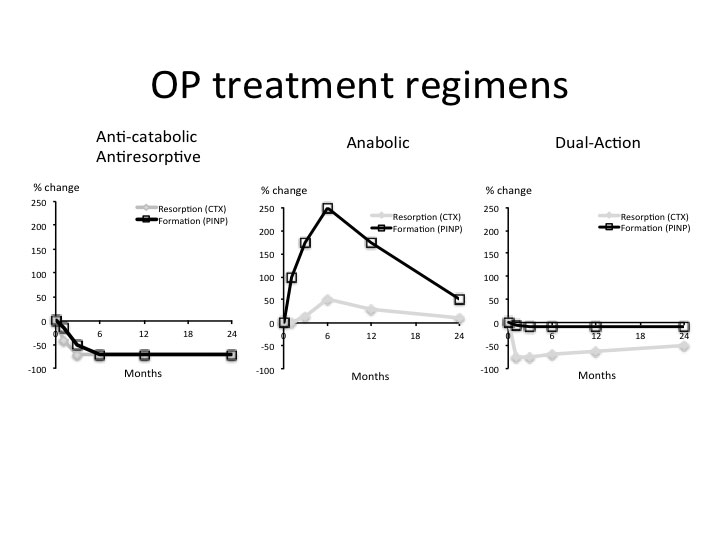
Figur 1. De 3 forskjellige behandlingsprinsipper for osteoporose, vist ved endringer i 2 spesifikke benmarkører: C-terminal Cross Linked Telopeptide of Collagen Type I (CTX), som er et mål for benresorption (osteoclastaktivitet), og N-terminal Propeptide of Collagen Type I (PINP), som er et mål for bendannelse (osteoblastaktivitet). Ved antiresorptive (anti-katabole) regimer (østrogen, bisfosfonater, denosumab) minker både den resorptive og den bendannende aktiviteten, slik at skjelettet blir mer stabilt. Ved anabole regimer (PTH, anti-RANKL) skjer en stimulering primært av bendannelse og i mindre grad av benresorption, hvilket skaper en positiv balance (anabolic window) og økning av benmassen. Dual-action prinsippet sikter mot selektiv hemning av benresorpsjon med uendret bendannelse, som er basis for virkningen av Kathepsin-K hemmeren Odanacatib.
Etter publikasjonen av resultatene av Womens Health Initiative (WHI) studien i 2002 (4) ble bruken av hormonbehandling kraftig redusert. Siden har subgruppeanalyser av studien og data fra andre studier differensiert oppfatningen av nytte-/kostnadsforholdet for hormonbehandling.
Den første WHI-studien testet effektene av kombinert behandling med hormonpreparatet Premarin, som er ekstrahert fra urinen fra gravide hopper og består av 13 forskjellige østrogenkomponenter, og gestagenet medroxyprogesteron (MPA). Etter 7 års behandling fant man signifikant reduksjon av osteoporotiske brudd, men økt forekomst av brystkreft, dyp venetrombose (DVT), hjerteinfarkt og slag (7-8/10,000 kvinneår).
En senere studie, hvor hysterektomerte kvinner ble behandlet med østrogen alene, viste en helt annen risikoprofil med grensesignifikant reduksjon av brystkreftrisiko og ingen økning i risiko for hjerteinfarkt (5). Risiko for slag og DVT var fortsatt økt (5). Senere analyser av de to studiene viste at langt størstedelen av de kardiovaskulære bivirkningene ble sett i aldersgruppen 70-79 år, mens kvinner som startet før 60 års alder viste en nøytral risikoprofil (6). Disse analysene taler derfor for at det primært var gestagen-komponenten, som økte risiko for brystkreft i WHI-studien, og at hormonbehandling startet før 60 års alder vil ha et positivt nytte-/kostnadsforhold.
En dansk langtidsstudie (Danish Osteoporosis Prevention Study (DOPS)) publiserte i 2012 data fra en langtidsoppfølging av kvinner som var behandlet med 17β- østradiol kombinert med norethisterone acetate (7). I denne randomiserte studien, som varte 10 år, fant man 52% redusert risiko for hjertesykdom hos hormonbrukere uten økt risiko for brystkreft eller slag. DVT viste en tallmessig, men ikke-signifikant, økning. Etter publikasjonen av WHI-studien ble DOPS stoppet, og kvinnene kunne velge om de ville fortsette på hormon eller slutte. Oppfølging av kvinnene som fortsatte på hormon vs. ubehandlede kvinner, viste stort sett samme risikoprofil også etter 16 år (7).
Resultatene av de nyere sub-analyser av WHI og DOPS studien har medført en utvikling mot mindre restriktive internasjonale retningslinjer de senere år (8, 9).
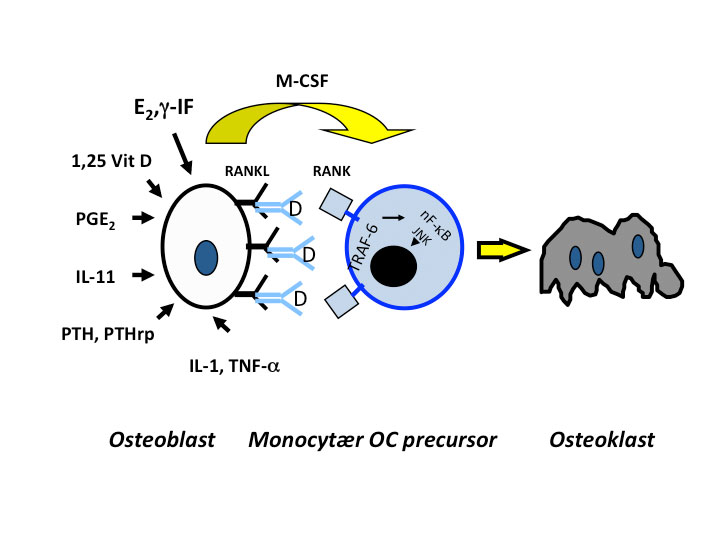
Fig. 2. Denosumab (D) er et monoklonalt antistoff, som blokkerer interaksjonen mellom Receptor Activated Nuklear Factor Kappa B (RANK) på monocytære forstadier til osteoklaster og dennes reseptor RANK-ligand (RANKL) som er membranbunden på osteoblaster. Interaksjonen moduleres av et stort antall hormoner og cytokiner, som vist på figuren.
Den potensielle negative påvirkning av koagulasjonen og dermed økte risiko for DVT, som ses etter ”first pass”-metabolisme av peroralt tilført østrogen, kan nøytraliseres ved transdermal administrasjon av hormonet. Derfor anbefales nu som optimalt hormonregimetransdermal østrogen kombinert med intrauterin gestagen spiral for de kvinner, som kan akseptere det. Dette optimerer de positive effekter av østrogen komponenten og minimerer de negative effektene gestagenet har på brystkreftrisiko.
I et forsøk på å unngå de negative effekter av peroralt gestagen, har man i nyere studier forsøkt å kombinere østrogen med en såkalt ”Selektiv Østrogen Reseptor Modulator” (SERM). I en nyere studie sammenliknet man derfor effektene av Premarin/MPA med Premarin/SERM. SERM komponenten var Bazedoxifene, som reduserer brystkreftrisiko og er nøytral på endometrier. Man fant at Premarin/Bazedoxifene-kombinasjonen hadde mindre endometriebivirkninger, og mindre hetetokter (10). Denne kombinasjonen (Duavee®) ble i oktober 2013 godkjent av FDA (www.fda.gov/drugs/newsevents/ucm370679.htm) til behandling av hetetokter og osteoporose, men med de samme restriksjoner som klassisk HRT hva angår kontraindikasjoner og varighet av behandling.
Denosumab (Prolia®) er et monoklonalt antistoff rettet mot RANK ligand – en faktor som er involvert i differensieringen av osteoklast forstadier til modne osteoklaster (Fig. 2).
Antistoffet gis som subkutan injeksjon hver 6. måned. På vevsnivå blokkerer behandling med Denosumab nesten totalt differensieringen av osteoklaster, og stoffet er derfor det antiresorptivum som har den største effekt på benremodelleringen (> 90% reduksjon). Denosumab er vist å redusere brudd i rygg, hofte og det perifere skjelettet like effektivt som de mest potente bisfosfonater (Figur 3) (2).
De viktigste bivirkningene som ble registrert i registeringsstudien for Denosumab (FREEDOM) var hudinfeksjoner, mest erysipelas (2). Men studier med lengere observasjonstid har ikke bekreftet denne bivirkningen som et signifikant problem. Som tilfellet er for bisfosfonater, kan også Denosumab i meget sjeldne tilfeller fremkalle hypokalsemi, kjeve-osteonekrose og atypiske frakturer. I motsetning til bisfosfonater kan Denosumab gis til pasienter med nedsatt nyrefunksjon, men man må monitorere intensivt for hypokalsemi når man behandler denne pasientgruppe. I Norge er Prolia bare godkjent på blå resept hos kvinner over 75 år med osteoporose.
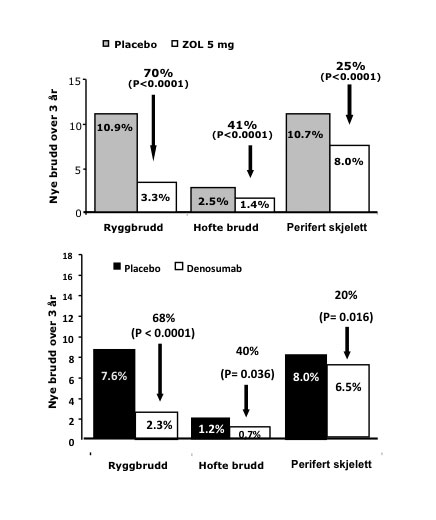
Figur 3. Effektene av iv. Zoledronsyre (Aclasta) og s.c. Denosumab (Prolia) på brudd i rygg, hofte og perifert skjelett. Fraktur risiko ved baseline var forskjellig med noe lavere risiko i populasjonen behandlet med Denosumab. Basert på data fra ref. (1,2).
Anabole terapier øker benomsetningen og bygger ben ved å stimulere osteoblastene og deres evne til å danne nytt ben. Denne virkning vil derfor direkte motvirke en osteoblasthemming, som er den primære årsak til bentap med økende alder og osteoporose.
Inntil nå er kun to rekombinante parathyreoideahormon analoger, PTH(1-34) og PTH(1-84), godkjent som anabole terapier (11, 12). Begge analogene administreres som daglige subkutane injeksjoner med penn. Dette øker nivået av parathyreoideahormon i serum markant over en periode på 3 timer. Det er denne skarpe toppen som stimulerer bendannelsen. Denne effekten er helt motsatt det benmassetapet man ser ved kronisk hypersekresjon av PTH, ved for eksempel primær og sekundær hyperparatyreoidisme, og er relatert til store forskjeller i genaktivering mellom de to doseringsregimene.
Subkutan administrasjon har PTH-analoger har multiple virkninger på skjelettet, idet de: 1) øker benmassen, 2) forbedrer benstrukturen i både kortikalt og trabekulært ben og 3) øker dimensjonene av lange rørknokler. Behandling med PTH(1-34) øker BMD i ryggen med gjennomsnittlig 9,7 % og i hoften med 2-3 % (11). I motsetning til antiresorptiva ser man en økning av både benformasjon og benresorpsjon etter behandling med PTH. Det er store individuelle variasjoner i bendannelsen (de fleste øker mellom 50 % og 300 %). Maksimal stimulasjon ses etter 6 måneder, for deretter å avta og nærme seg baseline etter 2 år.
PTH(1-84) (Preotact®) ble testet med en høyere relativ dose enn 20 ug dosen som ble valgt som terapeutisk dose for PTH(1-34). 100 ug som ble brukt av PTH(1-84) svarer til 40 ug (PTH(1-34), en doseøkning som anses å være årsaken til den økte forekomsten av bivirkninger, primært i form av hyperkalsemi, som man så i registreringsstudien for Preotact® (12). PTH(1-84) har også lengre halveringstid i serum enn PTH(1-34), som også kan ha bidratt til bivirkningsprofilen. Den kliniske studien med PTH(1-84) viste 38-40% reduksjon av ryggbrudd, men ikke reduksjon av non-vertebrale brudd. Om det skyldes den høyere dose eller andre faktorer er fortsatt uklart.
Hva så med vertebrale brudd??
Anabol terapi monitoreres best med benmarkører det første året, idet DXA-målinger undervurderer effekten på skjelettet. PINP er en markør for osteoblastisk kollagendannelse, og er den beste markøren. Etter 2 års behandling med PTH, bør pasienten ha behandling med antiresorptiva (oftest i.v. bisfosfonat) for å motvirke tap av benmasse etter seponering.
Registreringsstudien for PTH(1-34) ble avbrutt midtveis etter at langtidsstudier i rotter viste en doseavhengig økt risiko for osteosarkom. Med mer enn 1 million pasienter som nå er behandlet med PTH(1-34), har man ikke funnet at slik behandling øker risiko for osteosarkom. De sjeldne tilfellene som er beskrevet hos pasienter på PTH-behandling, resulterer i en risiko på omkring 1/250000, som er lik risikoen i bakgrunnspopulasjonen. Posthoc analyser av registreringsstudien (”Fracture Prevention Study”) viste at lang behandlingstid var assosiert med bedre frakturreduksjon. Pasienter behandlet lengre enn 14 måneder viste ca. 75 % reduksjon av ryggbrudd og 80 % reduksjon av non-vertebrale brudd (Figur 4) (13).
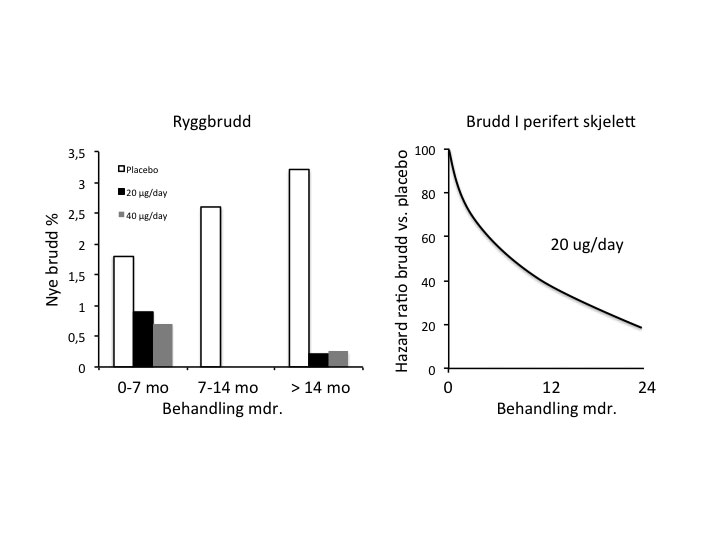
Figur 4. Post hoc analyse av effekten av PTH(1-34) på brudd i rygg og perifert skjelett i relasjon til behandlingstid. Adaptert fra ref. 13.
Sclerostin er et protein som dannes i osteocyter og som hemmer bendannelsen. Sclerostin menes å spille en sentral rolle i signalveiene når mekanisk påvirkning stimulerer benremodelleringen. Genetiske polymorfismer, som fører til minket effekt av sclerostin, er årsak til sykdommer karakterisert ved svært store økninger i benmasse (Sclereostose og Van Buchems sykdom). Karakteriseringen av disse genetiske polymorfismer førte til utviklingen av et monoklonalt antistoff (anti-sclerostin), som spesifikt hemmer effekten av sclerostin. Dyreforsøk og senere humane fase 1 og 2 studier har vist at dette antistoffet er i stand til å øke benmassen like mye som PTH, men mye fortere (ca 6 måneder vs. 24 måneder for PTH) (14). I motsetning til PTH, som øker både benresorpsjon og bendannelsen, vil behandling med anti-sclerostin hemme benresorpsjonen, slik at det såkalte ”anabole vindu” (perioden hvor bendannelsen er større enn benresorpsjonen) blir større.
Anti-sclerostin er i øyeblikket i fase 3 testing, og forutsatt man ikke finner alvorlige bivirkninger, vil dette nye konseptet bli et stort fremskritt i osteoporosebehandlingen.
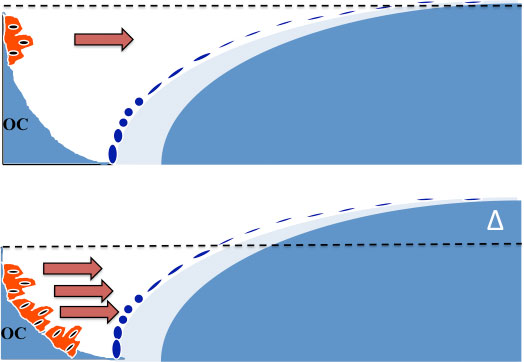
Fig. 5.”Dual-action” konseptet. Konvensjonelle antiresorptiva minker antallet av osteoklaster ved å øke apoptose av disse celler. Dette medfører nedsatt benresorpsjon, men også nedsatt benformasjon pga. nedsatt mengde kopplingsfaktorer. Behandling med Kathepsin K antagonister medfører tvert imot en økning av antallet av osteoklaster, men de har nedsatt aktivitet, slik at mindre ben resorberes. Det økte antall celler sikrer økt sekresjon av kopplingsfaktorer (piler) og dermed en benformasjon som ligger langt over benresorpsjonen. Dette medfører en pos. remodeleringsbalanse (Δ) i hver remodelerings syklus.
Konvensjonell antiresorptiv terapi reduserer benomsetningen og medfører derfor også nedsettelse av bendannelsen på vevsnivå. Derfor skjer det ingen netto tilvekst av ben under antiresorptiv behandling. Hvis man kunne hemme benresorpsjonen uten samtidig å hemme bendannelsen, ville man få en netto tilvekst av ben. Dette er bakgrunnen for utviklingen av de såkalte “Dual-Action Agents” (Figur 1). Målet med slik behandling er å hemme aktiviteten av de tilstedeværende osteoklaster, i motsetning til konvensjonell anti-resorptiv terapi, som virker via økning av programmert celledød (apoptose) av osteoklaster og dermed minker antallet av resorptive celler (Fig. 5). Behandling med disse Dual-action-stoffene medfører faktisk en økning av osteoklastantallet på vevsnivå, og hvis stoffene seponeres vil flere celler bli aktivert og medføre et aksellerert bentap. Dette er vist i fase 2 studiene, men det er ikke kjent om disse endringer i benremodelleringen medfører økt frakturrisiko.
Flere firmaer har utviklet ”Dual-Action” farmaka med disse egenskaper, men foreløpig er det bare Odanacatib fra MSD, som er i fase 3 testing. Odanacatib er en selektiv hemmer av Kathepsin K, som er et av de viktigste enzymene som nedbryter kollagen ved osteoklastisk resorpsjon.
Tidligere studier av en kandidat fra Novartis med mer bredspektret hemning av de forskjellige Kathepsin K varianter (mer enn for Odanacatib), ble stoppet pga økt forekomst av morphoea, som jo skyldes akkumulert kollagen i huden. Det er derfor spesielt fokus på denne bivirkningen i de pågående fase 3 studiene.
Odanacatib har i fase 2 studiene vist en kontinuerlig og nærmest lineær økning av benmineraltettheten over 3 år til verdier som ligger over hva man ser for antiresorptiva (15). Dette kunne tyde på en netto økning av benmassen. Dette bekreftes også av at benmarkører viser det forventede mønster med isolert hemning av resorpsjonsmarkøren CTX, uten samtidig hemming av markører for bendannelse, som benspesifikk alkalisk fosfatase (BAP) eller N-terminalt type I prokollagen propeptid (PINP)(15). Ved seponering av Odanacatib ses signifikante økninger av begge markørene, som uttrykk for bentap i denne perioden (15) .
Osteoklaster oppløser benmineral ved å secernere syre under osteoklasten. Denne syredannelsen kan hemmes med farmaka, som hemmer kloridkanaler i osteoklastene, og det er bakgrunnen for et annet ”Dual Action” konsept i tidlig testing (16).
Utviklingen de siste 20 år har gitt oss en lang rekke nye effektive terapeutika med stor nytteeffekt til behandling av osteoporose. Det finns få andre medisinske intervensjoner som har resultert i så store reduksjoner i absolutt og relativ risiko som disse. Fortsatt er antiresorptive terapier mest brukt. De er billige, og flere er blitt generiske. Den ideelle osteoporoseterapien ville være en initial kortvarig behandling (6 måneder – 2 år) med benoppbyggende terapi fulgt av antiresorptiv terapi for å konsolidere bedringen av skjelettstatus, men fortsatt er dette alternativet for dyrt til at være førstevalg hos alle pasienter.