Av Trond S. Halstensen, Professor dr. med., Institutt for Oral Biologi, Universitetet i Oslo.
Cøliaki er en glutenindusert systemisk autoimmun sykdom som rammer ca 1 % av befolkningen, men bare 1/4 er diagnostisert. De resterende ca 35-40.000 individene er udiagnostiserte, syke cøliakere. Utfordringen er å komme på tanken om at pasienten har cøliaki da symptomatologien kan være diffus. Tradisjonell patologisk undersøkelser av tynntarmsbiopsi har vært gullstandarden i diagnostiseringen av cøliaki, men bør suppleres med immunhistokjemisk undersøkelse av frysesnitt. Økningen av gamma-delta T-celler i slimhinnen og påvisningen av IgA-transglutaminase-2 immunkomplekser i tarmveggen øker den diagnostiske sikkerheten. Dette er spesielt viktig i tvilstilfelle hvor tynntarmsforandringene er små og ukarakteristiske, noe som ofte skjer fordi pasientene setter seg selv på glutenfrikost i ventetiden til biopsi blir tatt.
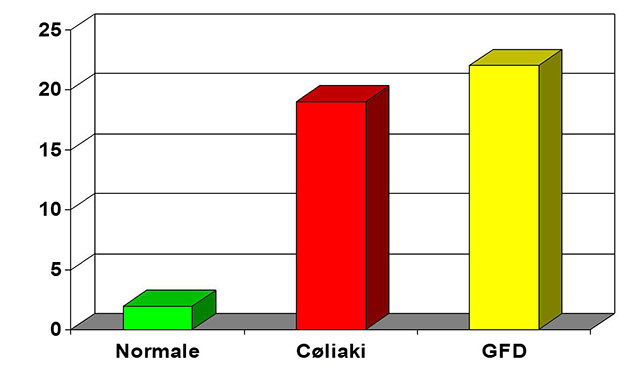
Figur 1. Mens normale kun har noen få gamma-delta T celler i overflate-epitelet, er det et betydelig økt prosentandel av de intraepiteliale T-cellene som uttrykker gamma/delta T-celle reseptoren, både ved ubehandlet og glutenfri diett (GFD) behandlet cøliaki. Dette kan brukes til å sannsynliggjøre en cøliakidiagnose selv etter at pasienten har startet med GFD.
I juni 2006 fikk 10 527 personer grunnstønad p.g.a. cøliaki (arbeids og velferdsdirektoratet), mens det bodde 4,64 millioner mennesker i Norge (statistisk sentralbyrå). Dette gir oss en diagnostisert cøliakiforekomst på 0,23 % eller 1/440. Ved undersøkelser av friske blodgivere har man funnet at mellom 1/157 (Israel) til 1/400 (Italia) av blodgivere hadde udiagnostisert cøliaki. Undersøker man personer med annen sykdom, så har hele 1/10-50 cøliaki (1, 2). Finske befolkningsundersøkelser var først til å påvise at 1/99 av den generelle befolkningen hadde cøliaki. Tilsvarende undersøkelser i andre land har bekreftet at fra 1/17 til 1/167 har cøliaki (Tabell 1). På samme måte som ved allergier og auto-immune sykdommer, øker sykdomshyppigheten av cøliaki, og hele 3 % av 12 åringer i Umeå som ble født under «cøliakiepidemien» i Sverige har cøliaki (3). Tilsvarende nyere populasjonsstudier i Finland har påvist en cøliakifrekvens varierende fra 1,5 % hos barn, til 2,4 % i den eldre befolkningen (Markku Mäkki, personlig meddelelse). Selv i Danmark hvor befolkningen lever på en glutenfattig brøddiet (mye rug), er den diagnostiserte forekomsten av cøliaki (1/2174) (4) vesentlig lavere enn den reelle siden 1/394 av friske blodgivere hadde cøliaki (5). Det var altså fem ganger flere cøliakere blant de friskeste av de friske (blodgivere) enn diagnostisert i Danmark.
Den reelle forekomsten av cøliaki i Norge er ukjent, men dersom vi har tilsvarende høye forekomster som Sverige og Finland, går minst 35 000 personer rundt med udiagnostisert cøliaki. Legger vi de høye tallene til grunn kan så mange som 85-120 000 personer ha udiagnostisert cøliaki. Vi er nå i gang med en befolkningsundersøkelse hvor serum fra 12000 personer som deltok i helseundersøkelsen Tromsø VI inngår. Pasienter som fikk påvist forhøyet IgA-anti TG2 og/eller forhøyet IgG mot deamidert–gliadin har fått tilbud om full diagnostisk utredning med intestinal biopsi (JM Kvamme, J Florholmen, TS Halstensen; pågående undersøkelse, upublisert).
Ubehandlet har personer med cøliaki en høyere morbiditet enn resten av befolkningen, noe som gjenspeiles i den økte cøliakiforekomsten ved andre sykdomstilstander. Tidligere var cøliaki betraktet som en barnesykdom med fettholdig diare, avmagring og redusert lengdevekst, en sykdom man ”vokste av seg”. Nå vet vi at cøliaki er en livslang sykdom som kan debutere i alle aldre og som ubehandlet gir en forhøyet risiko for karsinomer og lymfomer i gastrointestinal tractus (6). Desto lengre man har gått udiagnostisert, desto større risiko er det for å utvikle cancer (7). I tillegg har ubehandlete pasienter ofte mer diffuse plager som tretthet, leddsmerter, magesmerter og i sjeldnere tilfeller psykiske symptomer inkludert psykose. Disse plagene er så ukarakteristiske at de ofte kun kan relateres til cøliaki etter at man er blitt symptomfri på glutenfri kost, for det er først da de forstår hvordan livet skulle ha vært. Slike diffuse plager fører gjerne til gjentatte undersøkelser i primærhelsetjenesten og på sykehus, men uten at diagnosen nødvendigvis blir stillet. Foruten de personlige lidelsene, langvarige sykemeldingene, og den økte kreftrisikoen, vil de gjentatte, ofte resultatløse undersøkelser belaste helsevesenets økonomi (8).
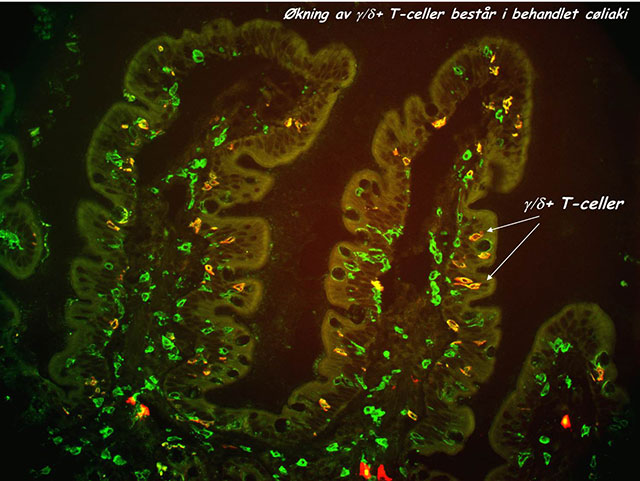
Figur 2. Eksempel på økningen av de intraepiteliale gamma/delta T-celler (gule TCRγ/δ+ T-celler, piler) ved diettbehandlet cøliaki. Dette cøliakispesifikke fenomenet står selv etter langvarig GFD med fullstendig morfologisk normalisering av tarmen. To-farget immunhistofluoresense farging for T-celler (CD3-grønn) og TCR γ/δ (rødt).
Cøliaki er en glutenindusert auto-immun sykdom som kun forekommer hos personer med en spesiell HLA-type (9, 10). Hele ~90 % av cøliakerene har vevstypen HLA DQ-2.5, de resterende ~10 % har HLA-DQ8. Begge vevstypene er vanlige i Norge, hele 25 % har HLA-DQ2.5, så selv om dette er en nødvendig genetisk predisposisjon er det ikke tilstrekkelig. Flere ulike genområder som koder for viktige molekyler i immunreguleringen, er assosiert med cøliaki og mange andre autoimmune sykdommer (11), men deres immun-patogene rolle er ennå ukjent. Det spesielle med HLA-DQ2.5 er at HLA-gropa binder det cøliakiinduserende de-amidert gliadin peptid spesielt godt. Videre antar man at det er kompleksdannelsen mellom tTG/TG2 og gliadin som fører til brudd på toleranse og dannelse av autoantistoffene (12). Det cøliakispesifikke IgA (eller IgG) anti-transglutaminase-2 (tTG = TG2) auto-antistoffene lager også lokale immunkomplekser i tarm (13) og andre steder i kroppen som hjernen. Alle med ubehandlet cøliaki danner slike autoantistoffer. Personer med IgA mangel har økt cøliaki risiko, men danner IgG mot TG2, noe man tar hensyn til ved screeningsundersøkelser ved å teste for IgG mot deamidert-gliadin. IgG mot deamidert gliadin må ikke forveksles med IgG/IgA mot gliadin som er lite egnet for å diagnostisere cøliaki. IgG mot deamidert-gliadin er vesentlig mer spesifikk.
I tillegg til gliadin-spesifikke T-celler, er det andre gliadiner som induserer lokal inflammatorisk respons via aktivering av det naturlige immunsystemet. Muligens induserer dette proliferasjon av T-celler i overflate epitelet (14), og er med på å ødelegge tynntarmsepitelet (15).
Selv om de typiske cøliakiforandringene med tynntarmstottatrofi er lett gjenkjennelige lysmikroskopisk, så er dette ikke en spesifikk reaksjon, men kan sees ved en rekke andre tilstander som parasittinfeksjon (for eksempel den som rammet Bergen i 2004 med parasitten Giardia Lamblia). Ved tvilstilfeller og hos barn som i praksis går på glutenfattig diett, har immunhistokjemisk karakterisering av betennelsesforandringene i tynntarmsbiopsiene vist seg å gi svært viktig diagnostisk tilleggsinformasjon. Særlig har den cøliakispesifikke økningen av de uvanlige gamma/delta T-cellene i tynntarmsepitelet (Figur 1) (16) vist seg å øke den diagnostiske nøyaktigheten(17), noe som spesielt er viktig ved moderate morfologiske forandringer (Figur 2). I tillegg binder lokalt dannet anti-TG2 autoantistoffer seg til TG2 i tarmmucosa. Disse immunkompleksene kan identifiseres ved immunhistokjemisk undersøkelser av tynntarmsbiopsier (Figur 3), selv hos dem som ikke har påvisbare autoantistoffer i blodet (13).
Selv med forhøyet IgA anti-TG2 antistoff nivå og riktig HLA-vevstype, må diagnosen verifiseres med tynntarmsbiopsi. Hos barn kan man nå tillate seg å diagnostisere cøliaki på kombinasjonen av riktig HLA-type, over 10 ganger høyere nivå av anti-tTG antistoffer (eventuelt påvist antiendomycium antistoffer) og kliniske symptomer. Videre forutsetter den biopsifrie diagnostiseringen at det kommer klinisk respons på glutenfri diett og at autoantistoffnivået synker. NAV godtar bare legeattest fra spesialist.
En del av de voksne cøliakipasientene som får diagnosen i godt voksen alder og som ikke blir bra på glutenfri kost, kan ha utviklet refraktær cøliaki, enten som et forstadium til intestinalt lymfom (refraktær cøliaki grad I) eller lymfom (grad II) (18). På tross av helt flat tarmslimhinne og mange intraepiteliale T-celler, skiller refraktær cøliaki seg fra cøliaki ved at de mangler økningen av de cøliakispesifikke γ/δ T cellene (18). Videre kan B-celle lymfomene danne autoantistoffer på GFD med hudforandringer som kan ligne Dermatitis Herpetiformis (DH), men skiller seg klinisk fra DH ved at utbruddene kommer på GFD, noe DH ikke gjør.
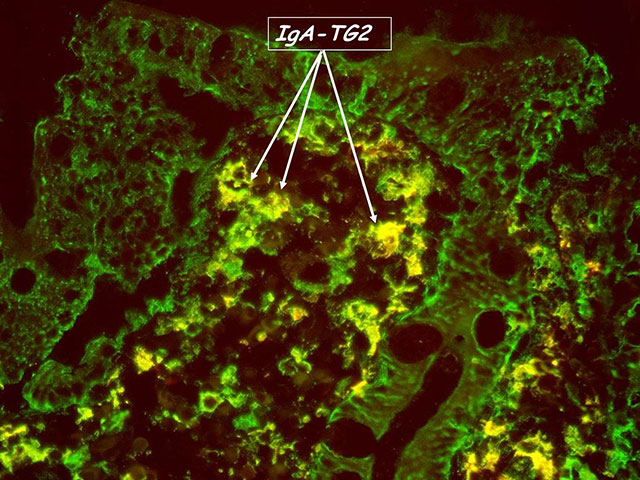
Figur 3. Ved ubehandlet cøliaki kan man påvise lokale immunkomplekser ved at IgA (grønn) er samlokalisert med transglutaminase 2 (rødt) noe som vises som gule granulære nedslag i mukosa. Slike immunkomplekser kan også påvises i de tilfeller der pasientene ikke har økt IgA-anti TG2 i serum.
Cøliaki er mye vanligere enn det man tidligere antok, minst 1% av befolkningen har cøliaki , og 4/5 deler av disse er ikke diagnostisert. Det er de udiagnostiserte cøliakerne som er syke da de går på glutenholdig diett uten å vite at det er dette som er årsaken til plagene. De fleste cøliakipasienter som oppdages i dag er normalvektige, ofte med diffuse plager som gjør det vanskelig å komme på tanken om at det kan være cøliaki. Den diagnostiske prosedyren burde inkludere immunhistokjemi på frysesnitt. Økningen av γ/δ-T-celler og/eller samlokalisering av IgA og TG2 i tarmslimhinnen øker den diagnostiske sikkerheten. Slik tilleggsinformasjon er særlig viktig i de tilfeller der de morfologiske forandringene er flekkevis og vanskelig å identifisere eller man mistenker refraktær cøliaki.