Av Smittevernoverlege Jon Birger Haug, Seksjon for smittevern, Sykehuset Østfold. Redaktør for ”Nasjonal faglig retningslinje for antibiotikabruk i sykehus” (2013).
Denne oversikten redegjør for at Norge er i den gunstige situasjon at aminoglykosider fortsatt kan anbefales for empirisk behandling av sepsis. Effekten av aminoglykosider er størst ved alvorlig sepsis (1). Toksisitet krever aktsomhet ved bruk. Med dette menes begrenset behandlingsvarighet, dosering én gang i døgnet og hyppige, korrekt utførte serumkonsentrasjonsmålinger.
På 1990-tallet ble forekomsten av sepsis i USA anslått til ca tre tilfeller per 1000 innbyggere (2, 3), mens en norsk studie i 1999 fant 1,5 sepsistilfeller per 1000 (4). Antall tilfeller har økt i USA de siste 10 år (5), og trolig også i vårt land som følge av mer avansert behandling og flere eldre, immunsvekkede pasienter. Et forsiktig estimat kan derfor være at det i Norge nå oppstår rundt 10 000 sepsistilfeller årlig.
Dette høye antallet sepsispasienter behandles i Norge ved samtlige somatiske sykehus av et stort antall leger med ulik bakgrunn. Det er derfor viktig at man forholder seg til gode og oppdaterte retningslinjer, og for de alvorligste tilfellene gjelder dette fremfor alt den organunderstøttende behandlingen. Men tidligst mulig administrasjon av et adekvat antibiotikaregime, gitt i høye nok intravenøse doser, har også stor betydning for å redusere mortaliteten (6, 7).
I Norge har standard empirisk behandling av sepsis med ukjent utgangspunkt i mange år vært kombinasjonen av benzylpenicillin og et aminoglykosid, for tiden gentamicin og i et mindre omfang tobramycin. Faren for pasientskade som følge av feil bruk av aminoglykosider er vel kjent i norske sykehus og gode rutiner for medikamentmonitorering er på plass. Likevel hevdes fra toneangivende intensivmedisinsk miljø at å anbefale empirisk bruk av aminoglykosider ved sepsis er uforsvarlig og medfører et stort antall nyreskader (8). Nye prinsipper for behandling, detaljert redegjort for i nye norske antibiotikaretningslinjer (Figur 1), gjør imidlertid at faren for nyreskade er liten selv ved alvorlig sepsis med akutt organsvikt. Et bredt sammensatt panel av leger fra ulike spesialiteter, inkludert intensivmedisin, har stått bak de norske anbefalingene.
Sepsis defineres som alvorlig når et eller flere vitale organ svikter (annet enn ett som er antatt utgangspunkt for infeksjonen). Septisk sjokk er definert som sepsis med vedvarende hypotensjon og hypoperfusjon av organer tross adekvat væsketerapi (9). Risikoen for å påføre nyreskade ved bruk av aminoglykosider er reell, og rundt 10–25% av behandlede pasienter antas å bli affisert (10). Det er dog store variasjoner i slike angivelser, blant annet fordi kriterier for hva som regnes som nyreaffeksjon angis ganske forskjellig i ulike oversikter. Det er viktig å huske på at nyreaffeksjon ved bruk av aminoglykosider som oftest er reversibel i motsetning til en mer sjelden, men irreversibel ototoksisitet som trolig bør vies større oppmerksomhet (11).
Faren for nyreskade etter én høy initial dose ved sepsis er meget liten. Aminoglykosider forårsaker celledød i proksimale tubuli. Denne effekten er konsentrasjonsavhengig, men i nyrenes tubulusceller nås et metningspunkt for opptak av aminoglykosider. Dette gjør at skaden som oppstår ved en høy dose én gang i døgnet er mindre enn ved flerdoseregimer (12). For inntil fem døgns behandling med aminoglykosider antas risikoen for varig nyreskade å være minimal ved riktig bruk (13). Man skal avstå fra bruk ved kronisk nyresvikt og ved etablert, fulminant flerorgansvikt og unngå samtidig bruk av andre nyretoksiske midler. Det forutsettes også at korrekt måling og tolkning av serumkonsentrasjon blir utført.
Ved alvorlig sepsis er en akutt oppstått organsvikt i hovedsak knyttet til selve infeksjonen. I denne situasjonen er bruk av maksimalt effektive antibiotika et vesentlig virkemiddel for å oppheve en livstruende tilstand. Aminoglykosider har hurtig innsettende baktericid effekt som er konsentrasjonsavhengig. Ved høye endoseregimer som er anbefalt i dag, er vevspenetrasjonen rask og pålitelig, og man oppnår dessuten en mye lengre postantibiotisk effekt enn ved tidligere flerdoseregimer (14).
Et vesentlig patofysiologisk forhold ved alvorlig sepsis er at pasientens distribusjonsvolum ofte er større enn normalt. En risiko for å underdosere aminoglykosider foreligger derfor i den viktige initiale behandlingen – spesielt dersom forskrivende lege er engstelig for nyretoksisitet (15). Den første dosen må alltid være høy, og skal gis uavhengig av GFR eller kreatininverdier som ikke gir pålitelig informasjon i akuttfasen hos disse pasientene. Det er svært viktig å måle serumkonsentrasjonen allerede etter første dose ved alvorlig sepsis. Betydningen av daglige serumkonsentrasjonsmålinger med nitid oppfølging av resultatene hos disse pasientene, presiseres på flere steder i de nye antibiotikaretningslinjene.
Ved dosering av aminoglykosider én gang i døgnet gjelder ellers at måling av bunnkonsentrasjon (”trough”-verdi) er en følsom indikator på akkumulasjon og fare for nyreskade (16). Serumkonsentrasjon målt etter 8 timer er vanligvis ikke nødvendig, annet enn for å kontrollere – i gitte situasjoner – at dosen som gis er tilstrekkelig høy for aminoglykosidet å ha effekt. Verdien bør være 8-10 ganger høyere enn minimal inhiberende konsentrasjon (MIC) for den aktuelle mikroben.

Figur 2. Aminoglykosid gentamicinresistens hos Escherichia coli og Klebsiella spp. i blodkulturer og urinprøver i Norge, 2003- 2012.
Det som for alvor gir grunn til bekymring i forhold til behandling av norske sepsispasienter er ikke deres nyrer, men den generelle resistensutviklingen i Norge i et makroperspektiv slik det er rapportert i Norsk overvåkningssystem for antibiotikaresistens NORM (17). For Escherichia coli i blodkulturer er det påvist en økning i gentamicin resistens fra 1,6 % i 2002 til 5,9 % i 2012 (Figur 2). Dette kan etter hvert bli problematisk hvis man skal stole på et aminoglykosid som eneste virkningsfulle medikament ved en alvorlig sepsis. Ekstendert spektrum betalaktamase (ESBL)-produserende gramnegative bakterier viser en foruroligende økning i norske sykehus. Det har vært en 10 ganger relativ økning av disse multiresistente stammene fra 2002 til 2012. ESBL-produksjon finnes nå hos 5,5 % av alle E. coli og 2,3 % av Klebsiella-isolater i et representativt utvalg blodkulturer fra norske laboratorier (17).
Det som også gir grunn til uro i Norge som i andre land, er økningen i kinolonresistens. For Norge har økningen i cipofloksacinresistens for E. coli i blodkulturer vært fra 4,5 % i 2002 til 10,7 % i 2012. Sammenhengen mellom en økning i resistens og økt bruk av dette medikamentet, i og utenfor sykehus, er overbevisende. Norske mikrobiologer advarer generelt mot at økt forbruk av bredspektrede antibiotika kan true den fremtidige nytteverdien også av aminoglykosidene – sitat:
”Aminoglykosidbruken har de siste ti år vært stabil og lav, mens resistensen har økt. Det er derfor nærliggende å tenke seg at utviklingen kan skyldes ko-seleksjon som følge av økt bruk av kinoloner (ciprofloksacin) og tredje-generasjons kefalosporiner” (18).
Alle lærebøker, retningslinjer og oversiktsartikler sier at empirisk antibiotikavalg ved sepsis og andre alvorlige infeksjoner skal foretas på grunnlag av lokale resistensforhold. Norske mikrobiologiske laboratorier bør derfor prioritere å kartlegge den lokale resistenssituasjonen på en regelmessig basis, slik at det kan vurderes om overordnede retningslinjer for initiale antibiotikavalg må tilpasses.
Tillegg av aminoglykosider ved empirisk behandling av alvorlig sepsis og septisk sjokk anbefales nå i et flertall utenlandske guidelines (11, 15, 19). En autorativ referanse er den såkalte Surviving Sepsis Campaign (6) som i 2013-utgaven støtter seg på nyere litteratur. Se også figur 3 som er et eksempel fra en kjent amerikansk håndbok. Håndboken er en del i bruk blant norske leger, hvilket generelt må betraktes som uheldig fordi anbefalinger gis med bakgrunn i helt andre resistensforhold enn de vi har i Norge. En stor metaanalyse/metaregresjon fra 2010 viser gunstigere effekt av kombinasjonsbehandling ved sepsis mht overlevelse for de aller sykeste pasientene (20).
En hyppig sitert Cochrane metaanalyse fra 2006 viste manglende effekt av monoterapi med betalaktam-antibiotika versus en kombinasjon med aminoglykosider ved sepsis. Analysen kom i et nytt opplag i 2009, og ble oppdatert med seks studier i 2014 (21). I en subanalyse som undersøkte nyretoksisitet fant man høy grad av nyreaffeksjon ved bruk av kombinasjonsregimenet. Det samme utvalg av studier ble brukt i alle tre utgivelsene.
Det er en rekke forhold som gjør at retningslinjepanelet ikke har funnet å kunne legge avgjørende vekt på denne metaanalysen:
Det er også slik at overførbarheten av Cochrane-analysen til våre norske forhold er dårlig. Dette er fordi bredspektrede betalaktamantibiotika har vært benyttet i studiene og ikke smalspektret benzylpenicillin som inngår i det ”norske” sepsisregimet. Internasjonalt er det, i tillegg til den hurtige baktericide effekten, dessuten en begrunnelse for å bruke aminoglykosider at det er et supplement til for eksempel 3. generasjon kefalosporiner og karbapenemer. Da må det ikke glemmes at i Norge har aminoglykosider ivaretatt hoveddekningen mot gramnegative bakterier – og gjør det fortsatt. Slik har man inntil nå unngått å måtte ta i bruk svært bredspektrede antibiotika i et unødig omfang. I en autorativ oversiktsartikkel om aminoglykosider i klinisk bruk sier Leibovici (en av medforfatterne til Cochrane-analysen) at man « – i land med moderate resistensproblemer … kan vurdere å gi anbefalinger om utstrakt bruk av aminoglykosider som erstatning for bredspektrede betalaktamantibiotika og fluorokinoloner». (22).
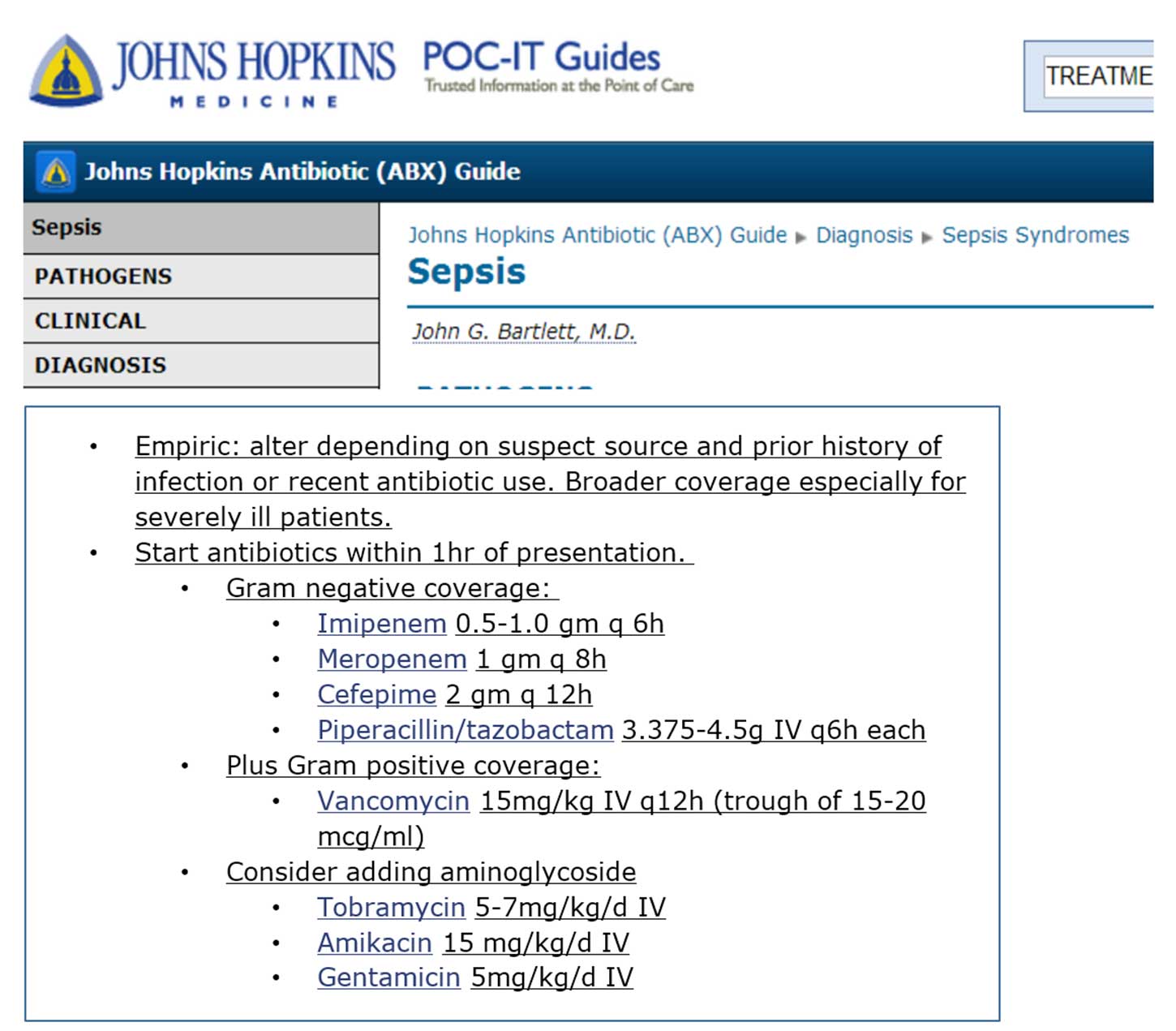
Figur 3. Johns Hopkins guideline for antibiotikabruk (2013) – angir aminoglykosider som aktuell behandling ved alvorlig sepsis. Lignende formuleringer finner man i Danmark, Sverige UK, Tyskland, Australia.
Aminoglykosider brukt sammen med bredspektrede betalaktamantibiotika er vist å gi mer pålitelig empirisk dekning ved antatt Pseudomonas etiologi og hos pasienter med nøytropen feber (23). Den synergi-effekt som antas å foreligge ved kombinasjonen – eller ønsket om å motvirke ytterligere resistensutvikling – tillegges en mindre betydning (24), men er viktige tilleggsargumenter i norsk behandlingstradisjon.
En randomisert, kontrollert studie av vårt sepsisregime satt opp mot bredspektrede regimer som anbefales i resten av verden er aldri gjennomført og bør prioriteres.
Problemstillingen kan raskt bli uaktuell dersom norsk antibiotikaresistens øker til over et visst nivå etter unødig overforbruk av bredspektrede antibiotika (25). En dansk observasjonsstudie fant den samme mortalitet ved sepsisregimer med og uten aminoglykosider, og med kun moderat risiko for kreatininøkning (26). En oversiktsartikkel som beskriver gode erfaringer med penicillin og aminoglykosid brukt ved febril nøytropeni er nylig publisert (27).
I Norge forblir aminoglykosider en hjørnesten i empirisk behandling av sepsis. Vi kan derved fortsatt unngå å bruke svært resistensdrivende antibiotika til et stort flertall av våre pasienter. Aminoglykosider har hurtig baktericid virkning, er fortsatt effektive mot aktuelle norske bakteriestammer, og har lav grad av nyretoksisitet ved endose-regimer og bruk i et begrenset tidsrom. Alternative regimer med bredspektrede antibiotika som kinoloner, kefalosporiner og karbapenemer vil gi en raskere resistensutvikling.
Spesialavdelinger som får henvist særlig kompliserte pasienter fra andre sykehus, må i stor utstrekning velge bort aminoglykosider til fordel for mer bredspektrede midler. Dette er på grunn av en hyppigere forekomst av allerede etablert nyreskade og fordi resistensforholdene ofte vil være mer ugunstige i slike sentra. Det frarådes sterkt å ekstrapolere ”ryggen-mot-veggen” behandling av et lite mindretall langvarig og kritisk syke pasienter til empirisk og initial sepsisbehandling i en generell sykehuspopulasjon.
Når en septisk pasient uten kronisk nyresvikt (og ikke overført fra utenlandsk sykehus) innlegges i et norsk sykehus med ”normale” resistensforhold, kan vi fortsatt stole på vårt anbefalte sepsisregime. En viktig forutsetning for bruk av aminoglykosider er at gode rutiner for serumkonsentrasjonsbestemmelser er etablert.