Av Rune Bjørneklett, overlege, medisinsk avdeling, Haukeland Universitetssykehus og leder for Norsk Nyrebiopsiregister
Norsk Nyrebiopsiregister ble etablert i 1988 og utgjør i dag en rik kilde til klinisk nefrologisk forskning. I denne artikkelen presenteres data om IgA-nefropati og membranøs nefropati der registeret har bidratt med publikasjoner og har pågående prosjekter.
Norsk nyrebiopsiregister (NNBR) ble etablert i 1988 og hadde 25 års jubileum i mai 2013. Forskningsaktiviteten i NNBR har vært økende de siste årene (1-5), og flere doktorgradsstipendiater har basert sine avhandlinger på data fra registeret om ulike nyresykdommer, f. eks. ANCA-assosiert nyresykdom, Fabry sykdom, IgA-nefropati. For tiden er flere stipendiater i full sving med prosjekter. Også forskerlinjestudenter er meget aktive. I Norge har vi unike muligheter for registerforskning ettersom alle innbyggere lett kan spores i offentlige registre. Kobling av registerdata mot data i bl.a. fødselsregister, dødsårsaksregister og Norsk nefrologiregister gir oss unike muligheter for oppfølgingsstudier med vurdering av risiko og prognose. Slike solide data er svært etterspurt internasjonalt. Lang oppfølgingstid gjør at antallet pasienter kan bli betydelig høyere enn i mange studier fra land som er langt større enn Norge. I det følgende presenteres data om den vanligste formen for glomerulonefritt, IgA-nefropati (IgAN), og om assosiasjonen mellom kreftsykdom og membranøs nefropati (MN). Her har NNBR bidratt med data som er av internasjonal betydning og som har avstedkommet nye forskningsprosjekter.
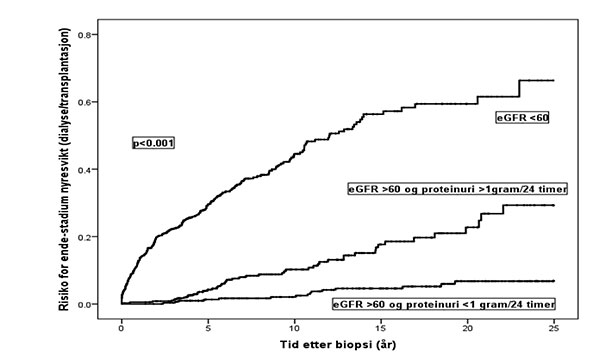
Figur 1: Risiko for endestadium nyresvikt med behov for dialyse eller transplantasjon i forskjellige prognostiske grupper av IgAN pasienter definert etter eGFR og proteinuri på diagnosetidspunkt.
IgAN er den vanligste primære glomerulonefritt både i Norge og i resten av verden. Patogenesen er ikke fullstendig forstått, men IgAN kan oppfattes som en systemsykdom som rammer nyrene. Dette illustreres godt ved følgende observasjoner. Når nyrer med IgAN transplanteres til mottakere uten denne sykdommen, går forandringene i remisjon, og når pasienter med IgAN får friske transplantatnyrer, vil IgAN utvikles i de fleste av disse (6).
IgAN kan foreløpig kun diagnostiseres ved hjelp av nyrebiopsi, og anslagsvis 50-100 pasienter diagnostiseres årlig i Norge. Den reelle forekomsten av IgAN i befolkningen er mye høyere. I en tysk serie på 250 fortløpende autopsier ble IgAN påvist i 5 %, og i en japansk serie av 510 nyretransplantasjoner ble IgAN forandringer funnet i hele 16 % av donornyrene ved protokollbiopsi (7, 8). De aller fleste av disse har IgA-nedslag i nyrene uten klinisk betydning. Det er imidlertid også sannsynlig at en del pasienter med IgAN utvikler uremi uten at diagnosen noen gang stilles med nyrebiopsi. Disse tilfellene blir i så fall oftest klassifisert som kronisk nefrittsyndrom eller hypertensiv nefropati.
IgAN er i startfasen vanligvis en symptomfattig sykdom. De fleste pasientene har på diagnosetidspunktet kun mikroskopisk hematuri og eventuelt proteinuri, hypertensjon og/eller nedsatt eGFR. Noen pasienter med IgAN har episodisk makroskopisk hematuri, typisk opptrer dette 1-2 dager etter infeksjonsepisoder. Vanlig alder ved diagnose er 20-40 år og menn er overrepresentert. Tross dette i utgangspunktet lite dramatiske sykdomsbilde, progredierer 20-40 % av IgAN pasienter til uremi innen 20 år etter diagnosen stilles. Dette spekteret i sykdommens alvorlighetsgrad har vært kjent lenge, men sykdomsmekanismer og modeller for klassifisering av risiko har vært lite kartlagt og dels noe forvirrende. Årsaken til sprik i risiko for uremi mellom forskjellige studier er trolig klassiske feil i studiedesign i form av lead time bias og varierende andel pasienter med mild IgAN som følge av forskjeller i terskel for nyrebiopsi (6).
Våre studier viser at IgAN er assosiert med ca. en dobling av dødelighetsraten, men dødeligheten er primært økt etter etablering av nyreerstattende behandling.
I pre-dialytisk fase av sykdommen er dødeligheten ikke signifikant økt. Dette er i motsetning til mange andre nyresykdommer, hvor kardiovaskulær dødelighet er økt ved alle grader av redusert nyrefunksjon (4).
En god prognostisk vurdering av hver enkelt pasient med IgAN er viktig med tanke på god pasientinformasjon og riktig valg av behandling. Gjennomsnittsrisikoen for utvikling av uremi ved IgAN er til lite hjelp i denne sammenheng. De viktigste risikofaktorer på diagnosetidspunktet er:
Endring av eGFR, proteinuri og blodtrykk de første månedene etter IgAN-diagnosen er stilt, gir ytterligere prognostisk informasjon. Lav eGFR på diagnosetidspunktet er vanligvis assosiert med dårlig prognose, men ikke når funnet er knyttet til makroskopisk hematuri som av og til gir akutt obstruktiv nefropati. Hos slike pasienter normaliseres vanligvis eGFR. Pasienter med høy proteinuri og hypertensjon som normaliseres under observasjon og behandling, har også ganske god prognose (6). I slike tilfelle skal blodtrykket senkes til <130/80 mmHg og eGFR og albumin-kreatinin ratio (AKR) følges opp regelmessig.
Flere forskergrupper har etablert prognostiske modeller der forskjellige risikofaktorer kombineres og risiko for uremi predikeres (1, 9, 10). For praktiske formål kommer man langt ved å risikostratifisere IgAN-pasientene ut ifra initial eGFR under eller over 60 ml/min/1.73m2, og blant pasienter med initial eGFR > 60 ytterligere ut ifra proteinuri ± 1 gram/døgn. Figur 1 og tabell 1 viser resultatet ved denne metoden applisert på IgAN-kohorten i Norsk Nyrebiopsiregister. Ved valg av behandling er en initial inndeling av IgAN-pasientene i 3 grupper en fornuftig strategi. Dette er også foreslått av glomerulonefrittgruppen i KDIGO (Kidney Disease Improving Global Outcome), http://www.kdigo.org/clinical_practice_guidelines/pdf/KDIGO-GN-Guideline.pdf:
Gruppe 1 har vanligvis benign sykdom, men BT > 130/80 bør behandles. Blodtrykksbehandlingen bør inkludere en ACE-hemmer eller angiotensin-reseptor-blokker (ARB). Langvarig observasjon anbefales da enkelte pasienter i denne prognostiske gruppen over tid vil få progredierende sykdom.
Gruppe 2 har potensielt progredierende sykdom. De bør på grunn av proteinurien behandles med ACE-hemmer eller ARB uansett blodtrykk. Dersom proteinuri > 1 gram/døgn vedvarer tross slik behandling i 3-4 måneder, bør 6 måneders høydose steroidbehandling forsøkes. Hos slike pasienter kan også fiskeolje vurderes, selv om dokumentasjon for slik behandling ikke er svært god, jfr. diskusjon i retningslinjene fra KDIGO.
Gruppe 3 har avansert sykdom. Behandlingsmål er å forsinke progresjon av nyresvikt ved hjelp av blodtrykksbehandling med ACE-hemmer aller ARB og forberede pasienten til uremibehandling. Slike pasienter anbefales ikke belastet med langvarig høydose steroidbehandling.
Foretrukket uremibehandling for IgAN pasienter er nyretransplantasjon. Resultatene etter nyretransplantasjon er gode også for IgAN pasienter, men en del pasienter mister transplantatfunksjon pga. residiv av IgAN. Vanligvis skjer dette mange år etter transplantasjon, men hos pasienter med særlig aggressivt forløpende IgAN kan tap av transplantatet komme ganske raskt (2).
Membranøs nefropati (MN) er den vanligste primære nyresykdommen som gir nefrotisk syndrom hos voksne i Norge. En mulig assosiasjon mellom MN og kreft ble beskrevet allerede i 1966 (11). Siden er det publisert mer enn 400 artikler om dette temaet (PubMed). I mange år ble assosiasjonen oppfattet som kontroversiell. Mange trodde MN kunne oppstå som et paraneoplastisk fenomen, mens andre mente at det dreide seg om tilfeldig sammentreff mellom 2 sykdommer (12, 13). I 2006 og 2007 ble det publisert 2 artikler som langt på vei avklarte denne kontroversen. En fransk studie viste standardisert insidens rate (SIR) for kreft 0-1 år etter MN diagnosen på hele 9.8 (5.5-16) hos menn og 12.3 (4.5-27) hos kvinner. Ganske mange av disse pasientene hadde kjent kreftsykdom på tidspunkt for MN diagnose (14). Dette funnet passer godt med oppfattelsen av MN som et paraneoplastisk fenomen. I 2007 viste vi i en studie fra Norsk Nyrebiopsiregister og Kreftregisteret at risikoen for kreft hos MN pasienter var moderat økt, SIR 2.3 (1.4-3.3), i hele perioden 0-15 år etter MN diagnosen. Risikoøkningen var like stor 5-15 år, som 0-5 år, etter MN diagnose (3). Dette funnet indikerte at også andre mekanismer enn paraneoplasi kan spille en rolle, f.eks. kan omfattende bruk av immunosuppressive medikamenter hos MN pasienter forklare økt langtids risiko for kreft. Med disse studiene ble den kvantitative assosiasjonen mellom kreft og MN bekreftet ved hjelp av anerkjent epidemiologisk metode. Mekanismen(e) for assosiasjonen forble fortsatt uavklarte.
I 2009 kom en viktig oppdagelse, assosiasjonen mellom primær MN og auto-antistoffer mot fosfolipaseA2 reseptor (PLA2R) (15). Dette åpnet for en mer detaljert kausal inndeling av MN, se tabell 2. PLA2R positiv primær MN oppfattes nå som en klassisk autoimmun sykdom, måling av PLA2R antas å kunne være veiledende for dosering av immunsuppressiva. Analyse av PLA2R er således på vei inn i standardrepertoaret ved diagnostikk og behandling av MN. Foreløpig gjøres ikke denne analysen i Norge, men den tilbys på kommersiell basis ved flere utenlandske laboratorier.
Med oppdagelsen av PLA2R-antistoffene kunne følgende hypoteser angående kreft og MN fremsettes (13):
MN opptrer som et paraneoplastisk fenomen hos pasienter med tilsynelatende primær MN. Disse vil være PLA2R-antistoff negative. I praksis vil dette være sekundær MN der årsaken er en okkult kreftsvulst.
I følge en nylig publisert artikkel fant en nederlandsk gruppe en signifikant og mye høyere kreftrisiko de første årene etter diagnosen hos PLA2R-antistoff negative versus PLA2R-antistoff positive MN-pasienter. Dette funnet støtter ovennevnte hypoteser (16). Ved nyrebiopsiregisteret planlegges nå å gjøre en ny analyse av langtidsrisiko for kreft hos MN-pasienter. Vi vil måle SIR for kreft hos dem som har fått, versus de som ikke har fått, behandling med immunosuppressive medikamenter. Dersom vi finner at langtidsrisiko for kreft utelukkende er økt hos immunsupprimerte MN-pasienter, vil det også støtte ovennevnte hypotese.