Av Helge L. Waldum, overlege, professor dr.med, Det medisinske Fakultet, NTNU og Gastromedisinsk avdeling, St. Olavs Hospital, Trondheim
Magesekkens funksjon, spesielt produksjonen av magesyre, har gjennom tidene vært tillagt stor betydning. Den sure magesaftens evne til å drepe nedsvelgede mikroorganismer, gjør at det er lite mikrobielt mangfold i dette organet. Helicobacter pylori er en av de få mikroorganismer som kan leve i dette miljø, og samspillet mellom denne bakterien og magesekkens eget hormon, gastrin, kan forklare patogenesen for de fleste lidelser i øvre gastrointestinal traktus.
Forut for magen, møter det vi spiser og drikker, et flerlaget plateepitel, som er relativt ugjennomtrengelig for passasje av mikroorganismer.
Magesaften er normalt meget sur med pH ned mot 1.0. I tillegg til magesyre, inneholder magesaften pepsin, et proteolytisk enzym med aktivitet i det sterkt sure området, samt en lipase. Denne unike væsken er utviklet for å kunne drepe nedsvelgede mikroorganismer og fungerer med andre ord som en barriere mot videre passasje av mikroorganismer nedover i tarmkanalen.
Indirekte demonstreres betydningen av magesaften og dens surhet av den omfattende regulering av syresekresjon slik at pH i ventrikkelen, selv etter måltid ikke overskrider 4.0. Når pH heves over denne verdi faller magesaftens baktericide effekt bratt, hvilket kan ha sammenheng med at pepsins enzymatiske effekt avtar raskt når pH heves over pH 4.0.
Hos menneske er gastrin fra magesekkens utløpsdel den viktigste regulator av syresekresjonen. Vagusnerven er også viktig i syresekresjonsreguleringen, hvilket en benyttet seg av i behandlingen av duodenal sår før en hadde effektive hemmere av syresekresjonen. Den relative betydning av n. vagus versus gastrin varierer mellom forskjellige arter. Generelt er det slik at vagusnerven er viktigst hos de arter som spiser mest bedervet føde, hvilket er rasjonelt siden magesaften da alt er til stede ved starten av måltidet via den nervøse reguleringen.
Mens den normale reguleringen av magesaftens surhet er et sterkt argument for at dette er en biologisk viktig funksjon, kan en omvendt hevde at siden pasienter med redusert eller opphevet syresekresjon på grunn av atrofisk gastritt tilsynelatende ikke har noen plager, tyder på det motsatte. Imidlertid må en her huske på at atrofisk gastritt er en sykdom som vesentlig affiserer middelaldrende og eldre individer og at langtidskonsekvensene ikke nødvendigvis trenger å komme for dagen. Jeg vil her minne om de lange latenstider for sykdommer som forårsakes av prioner (for eksempel kuru-kuru), visse virus sykdommer som HIV og hepatocellulær cancer ved hepatitt B infeksjon. Det er ellers et faktum at personer som mangler magesyre er mer tilbøyelig til bakterielle gastrointestinale infeksjoner. En bør derfor regne med at dette er en viktig biologisk funksjon (1). Imidlertid kan magesyre medføre sykelighet i form av ulcus pepticum og refluksøsofagitt. I behandlingen av disse tilstandene, bør en derfor redusere syresekresjonen minst mulig, dog slik at en får tilfredsstillende klinisk effekt.
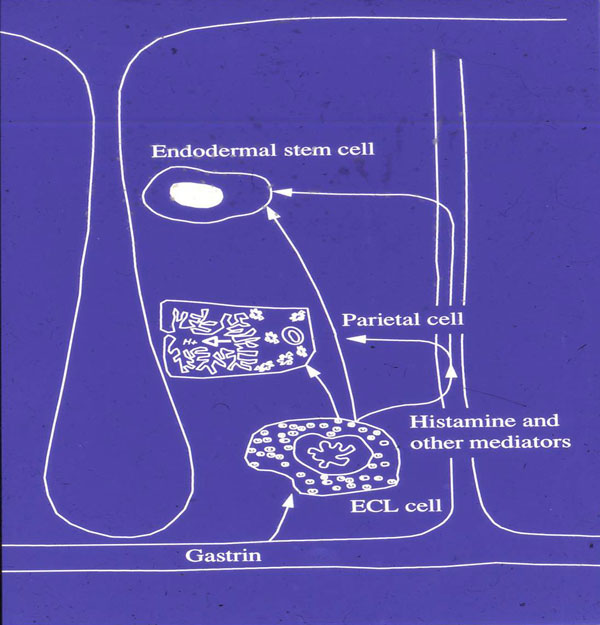
Fig.1. Regulering av ventrikkelens syresekresjon. Tidligere publisert i Yale J Biol Med 1998, 71: 325-335 og retrykkes med tillatelse.
Helicobacter pylori (Hp) er en av få mikroorganismer som kan leve i den sure magesaften. Denne bakterien graver seg ned i slimlaget, og der påvirker den sitt nærmiljø ved produksjon av ammoniakk (NH3) fra urea via urease-produksjon. Det var et svært fremskritt da Marshall og Warren viste at Hp var årsak til gastritt, og at Hp via denne mekanismen, var hovedårsak til ulcus pepticum (2). Hp-infeksjon i canalis-slimhinnen disponerer for ulcus duodeni via sin lokalt alkaliserende effekt. Dette gir økt gastrin frigjøring, lett økt gastrin konsentrasjon i blod og derigjennom økt syresekresjon.
Når infeksjonen også affiserer den syreproduserende slimhinnen, vil dennes motstandsmekanismer mot angrep fra magesaften (bikarbonat og slim produksjon) avta og disponere for ulcus ventriculi. På grunn av atrofi av de oksyntiske (slimproduserende) kjertler, faller syreproduksjonen, og det blir etter hvert en betydelig sekundær hypergastrinemi, som uttrykk for organismens forsøk på å holde mageinnholdet surt.
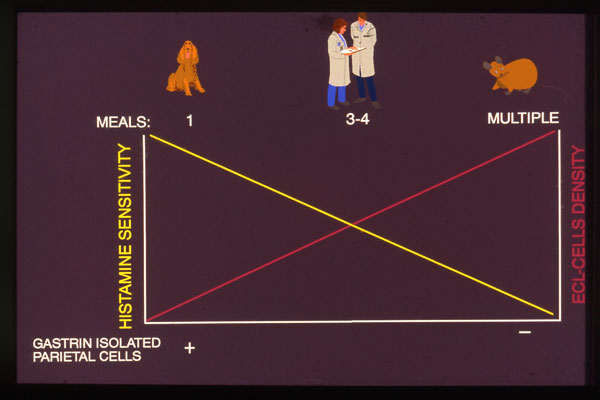
Fig. 2. Hyppigheten av fødeinntak bestemmer magesekkens sensitivitet overfor de forskjellige mediatorer.
Gastrins målcelle er den histaminproduserende enterokromafin-liknende (ECL) cellen. Gastrin stimulerer syresekresjonen ved å stimulere histamin-frigjøringen fra denne cellen. Histamin virker så på den syreproduserende parietalcellen (Fig. 1). Det er kun kvantitative, og ikke kvalitative forskjeller i syresekresjonsregulering mellom dyreartene. Hyppighet av fødeinntak bestemmer sensitiviteten for de forskjellige mediatorer (Fig.2). Langtids hypergastrinemi medfører ECL-cellehyperplasi og etter hvert ECL-celleneoplasi i form av ECL-cellecarcinoider. ECL-cellecarsinoider ved langvarig hypergastrinemi ,ser en så vel hos gnagere som menneske. Hypergastrinemi alene synes å være tilstrekkelig til å utvikle slike svulster, i det en ser slik forekomst ved langvarig hypergastrinemi, uansett årsak og uansett syresekresjon. Hos menneske ser en ECL-cellecarsinoider ved sporadiske gastrinomer med høy syresekresjon og hos pasienter med achlorhydri (1).
Langt mer omdiskutert har ECL-cellens rolle i utviklingen av magekreft hos menneske, vært. Vi fattet interesse for dette på åttitallet med de første beskrivelsene av maligne svulster i den oksyntiske mukosa hos gnagere etter langvarig uttalt syrehemning. langvarig behandling med kraftige hemmere av syreseksjonen. Både protonpumpehemmeren omeprazol og den irreversible histamin-2 blokkeren loxtidin, ga samme type svulst. Disse svulstene ble først klassifisert som adenokarsinomer, men Nilo Havu, Astra (elev av professor Sture Falkmer som virket her i Trondheim over en 10 år periode) reklassifiserte disse til nevroendokrine karsinomer (3), utgående fra ECL-cellen med hypergastrinemi som felles patogenetisk mekanisme. Også andre svulster ble tilsvarende reklassifisert, eksempelvis svulstene som oppstår i den oksyntiske slimhinnen hos den afrikanske gnageren Mastomys (4). Det fantes også enkelte rapporter om tilsvarende reklassifisering av magekreftsvulster hos menneske.
Vi spurte oss selv om dette også kunne være en mer utbredt feilklassifisering av magekreft, hvilket ville ha stor betydning for medikamentell behandling av syrerelaterte sykdommer. I 25 år har vi nå undersøkt magekreftsvulster med de til enhver tid mest sensitive og spesifikke metoder, og har kunnet vise at en betydelig del av disse magesvulstene, og særlig de som klassifiseres som diffuse etter Lauréns klassifisering (5), i realiteten er nevroendokrine carsinomer hvorav de fleste i ventrikkelen er ECL-cellederiverte (6) (Fig.3). På bakgrunn av dette har vi lenge advart mot uttalt, langvarig syrehemning, spesielt hos barn og unge (7). Vi kunne også som de første, vise at syrehemning med protonpumpehemmer i vanlig dosering over noen få måneder, etter seponering førte til høyere syresekresjon enn før oppstart, altså såkalt «rebound hypersekresjon» (8). Den kliniske konsekvens av dette ble vist i en dansk studie der friske forsøkspersoner utviklet dyspepsi etter 3 måneders bruk av protonpumpehemmer.
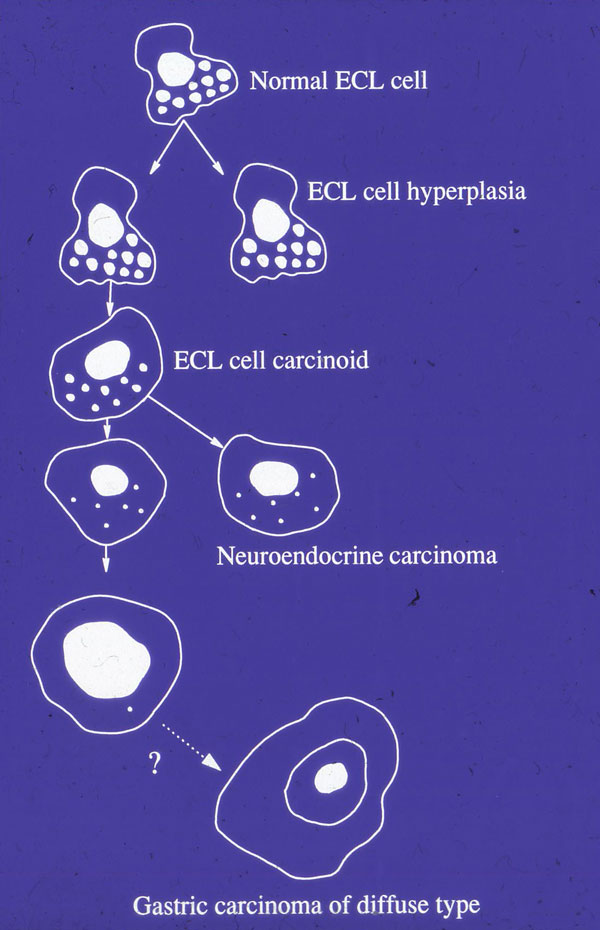
Fig.3. Under malignisering skjer det en dedifferensiering som kan gjøre det vanskelig å erkjenne utgangscellen. Tidligere publisert i Yale J Biol Med 1998, 71: 325-335 og retrykkes med tillatelse.
Pasienter med syrerelaterte sykdommer, trenger behandling som reduserer syresekresjonen. Ulcus pepticum skyldes som regel Hp infeksjon, og sykdommen kan helbredes med Hp eradikasjon. Syrehemmende behandling er derfor nødvendig kun i akuttstadiet og ved komplikasjoner. Langtidsbehandling med syrehemmer blir derfor sjeldent nødvendig. Pasienter som må bruke antiflogistika, en medikamentgruppe som brukes i altfor stor grad, kan trenge langtids syrehemning for å redusere risikoen for ulcus og ulcus blødning. Dette bør imidlertid være en liten gruppe, siden antiflogistika ikke har noen helbredende effekt, kun symptomatisk effekt. Hovedindikasjonen for langtidsbehandling med syrehemmende medisiner er gastroøsofageal reflukssykdom. Ved valg av terapi av denne tilstanden bør en ha følgende fakta in mente: På grunn av «rebound» hypersekresjon av syre bør en starte med histamin-2-blokker hos alle med mild til moderat øsofagitt. Histamin-2-blokkere har redusert effekt etter bruk av protonpumpe hemmer. Siden reflukssykdom er en kronisk tilstand, vil det som regel bli nødvendig med langtidsbehandling med syrehemmer.
Carsinogenese er en langvarig prosess, hvilket forklarer at kreftsykdom som regel forekommer hos eldre individer. Jeg har derfor ingen betenkeligheter med bruk av protonpumpe hemmere hos pasienter over 60 år. Dess yngre pasientene er, og spesielt hos barn, er betenkeligheten stor på grunn av muligheten for induksjon av premaligne endringer, som kan manifestere seg senere i livet. En bør som et generelt prinsipp satse på lavest mulig hemming av syresekresjonen, det vil si prøve histamin-2-blokker for å se om dette bedrer pasientens symptomer tilstrekkelig, samt at øsofagitten tilheler. I all behandling bør vi tilstrebe å endre normal biologi minst mulig. Biologien har dessverre som regel større «innsikt» enn legestanden. I den forbindelse vil jeg også påpeke at «evidence based medicine» bare gir opplysninger om observasjonsperioden, og ikke om langsiktige bivirkninger. Kun langtids dyretoksikologiske studier kan si noe om dette, men en bør også her huske på begrensingene som ligger i at forsøksdyrene lever i et beskyttet miljø.
I all behandling må vi ta sikte på å gjøre minst mulige inngrep i normal biologi. Så også i syredempende behandling. På grunn av neoplasirisiko ved langvarig hypergastrinemi må en være forsiktig med slik behandling av barn og unge og tilstrebe bruk av histamin-2-blokkere framfor protonpumpehemmere når dette er mulig.