Av Håvard Midgard, lege og stipendiat, Akershus Universitetssykehus (Ahus)/Universitet i Oslo (UiO) og gastromedisinsk avdeling, Oslo Universitetssykehus (OUS) og Olav Dalgard, overlege dr. med., infeksjonsavdelingen, Akershus Universitetssykehus.
Hepatitt C er en viktig årsak til kronisk leversykdom og en ”stille” epidemi med stor sykdomsbyrde som i stor grad rammer en underpriviligert og marginalisert populasjon. Vi opplever nå et paradigmeskifte hvor de aller fleste pasientene kan få kurativ behandling med minimale bivirkninger, men det gjenstår fremdeles utfordringer.
Infeksjon med hepatitt C-virus (HCV) er et globalt folkehelseproblem og en av de viktigste årsakene til kronisk leversykdom. WHO anslår at nærmere 200 millioner er smittet på verdensbasis. I Norge er prevalensen av HCV-antistoffer blant voksne 0.7 % (1) og vi antar av minst 20 000 personer er kronisk infiserte. HCV smitter gjennom perkutan eksponering for infisert blod, og i vestlige land har HCV vært endemisk blant sprøytemisbrukere siden 1960-tallet. I Norge har omlag 80 % av smitteoverføringen skjedd hos personer med ruserfaring, mens et mindretall ble smittet via blodprodukter før diagnostiske tester forelå i 1989. I ikke-vestlige land er imidlertid gjenbruk av ikke-sterilisert medisinsk utstyr fortsatt en av de viktigste smitteveiene, og økende migrasjon gjør at dette også reflekteres i den norske HCV-populasjonen.
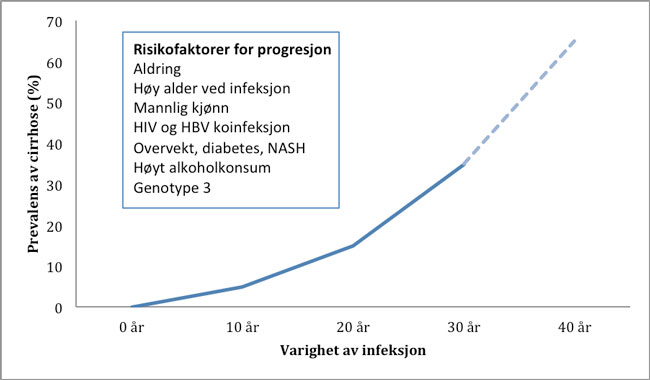
Figur 1. Cirrhoseprevalens de første 30 år etter eksponering med projisert videre utvikling samt risikofaktorer for progresjon.
Etter eksponering vil 20-30 % spontant bli virusfri, mens resten utvikler en lavgradig og oftest asymptomatisk kronisk infeksjon som over tid kan gi progressiv leverfibrose. Det naturlige forløpet av kronisk hepatitt C er imidlertid bare delvis kjent, og prevalensen av levercirrhose etter 20 år varierer fra 3-30 % i studier av ganske ulike populasjoner (2). Få studier har kunnet belyse det naturlige forløpet utover dette, men i en norsk kohortstudie av opiatavhengige med kronisk HCV hadde en tredjedel utviklet avansert fibrose eller cirrhose 25-35 år etter eksponering for viruset (3). Risikofaktorer for sykdomsprogresjon fremgår av figur 1, og det er en viktig erkjennelse at slike kofaktorer ofte er tilstede hos HCV-pasienter og kan være reversible. Pasienter med etablert levercirrhose har høy risiko for komplikasjoner og halvparten vil utvikle leverdekompensasjon (ascites, variceblødning, encefalopati, hepatorenalt syndrom eller leversvikt) eller hepatocellulært karsinom innen 10-15 år. Når dekompensasjon først har inntruffet er overlevelsen betydelig redusert, og i de fleste vestlige land har HCV-cirrhose lenge vært den viktigste årsak til levertransplantasjon. Som en konsekvens av lavt behandlingsopptak, spesielt hos pasienter med ruserfaring, ser man derfor nå at aldrende kohorter av pasienter med ubehandlet HCV bidrar til økende sykdomsbyrde for individ og samfunn.
Alle som er eksponert for viruset vil ha HCV-antistoffer, men kronisk hepatitt C verifiseres ved påvisning av HCV RNA ved PCR-metodikk. Alle med perkutan eksponering for potensielt HCV-smittet blod bør undersøkes, og alle med positiv HCV RNA bør tilbys utredning hos spesialist i infeksjonssykdommer, gastroenterologi eller pediatri uavhengig av om det er utfall i leverprøver. En sentral del av utredningen består i å fastslå sykdommens stadium (tabell 1), noe som er av betydning for både prognose og behandlingsvalg. Stadium av leverfibrose vurderes tradisjonelt invasivt ved leverbiopsi (METAVIR-systemet), men kan i dag i de fleste tilfeller gjøres raskt og non-invasivt ved elastografi av leveren med FibroScan®. Leverelastisitet (benevnes i kPa) korrelerer med mengden av leverfibrose som igjen korrelerer med hastigheten av en vibrasjonsbølge utløst av apparatet. Elastografi er aller best egnet for diagnostikk av cirrhose, men en vesentlig styrke ved metoden er at verdier i cirrhosespekteret (12-75 kPa) korrelerer med graden av portal hypertensjon og derfor gir informasjon om risiko for komplikasjoner og død av leversykdom i mye større grad enn METAVIR-systemet ved leverbiopsi (4). Etter vår mening er bruken av elastografi fortsatt for lite utbredt i Norge.
Det overordnede målet for HCV-behandling er ved eradikasjon av viruset å hindre utvikling av levercirrhose samt å redusere sannsynligheten for at det oppstår komplikasjoner til allerede etablert cirrhose. Surrogatmarkøren for vellykket behandling benevnes sustained virological response (SVR) – varig virusfrihet – og er definert ved ikke-påvisbart HCV RNA 12 uker etter avsluttet behandling. Pasienter som oppnår SVR kan i utgangspunktet betraktes som friske og trenger ingen videre oppfølging med mindre det foreligger cirrhose. Selv om det er holdepunkter for at SVR kan føre til regresjon av leverfibrose, vil disse pasientene ha behov for regelmessig oppfølging, ikke minst fordi de fortsatt vil ha økt risiko for å utvikle hepatocellulært karsinom.
Siden mange pasienter med kronisk hepatitt C sannsynligvis aldri vil utvikle leversykdom av betydning, har det på grunn av medikamentkostnader og bivirkninger av behandlingen vært konsensus om at det er behandlingsindikasjon kun dersom det påvises signifikant leverfibrose (F≥2 eller elastografi >7 kPa). Fra et samfunnsperspektiv er imidlertid utsiktene til å kunne å kontrollere epidemien gjennom behandling (”treatment as prevention”) en besnærende tanke, noe som dog ville kreve effektiv behandling tilgjengelig for alle uavhengig av fibrosestadium. Matematiske modellstudier har vist at ved å oppskalere HCV-behandling hos aktive rusmisbrukere kan man oppnå reduksjon i smittepresset med påfølgende fall i prevalensen over tid (5).
Siden de første forsøkene med interferon monoterapi på slutten av 80-tallet har HCV-behandlingen vært i stadig utvikling (figur 2). Vi opplever nå et paradigmeskifte med overgang til interferonfri behandling med perorale direktevirkende antivirale midler (DAAs) som kan gi SVR hos over 90 % med minimale bivirkninger. Interferonbasert behandling er utfordrende da den ofte er langvarig og beheftet med plagsomme og til dels alvorlige bivirkninger med influensalinkende symptomer, benmargssuppresjon, autoimmune fenomener og psykiatriske manifestasjoner. Den interferonfrie æra innebærer derfor et betydelig medisinsk fremskritt som burde kunne gi økt behandlingsopptak i alle pasientgrupper og nytt håp til pasienter med interferon-intoleranse eller mislykkede behandlingsforsøk bak seg. En annen fordel med interferonfri behandling er at pasienter med dekompensert cirrhose kan behandles relativt risikofritt med gode resultater, noe som forhåpentligvis kan redusere behovet for levertransplantasjoner. Interferonfri behandling muliggjør også trygg behandling av reinfisert graft etter levertransplantasjon.
Indikasjon og tidspunkt for oppstart av HCV-behandling må individualiseres på bakgrunn av aktuelt fibrosestadium, viral genotype, alder, tidligere behandlingseksponering (naiv vs. erfaren) og risikofaktorer for progresjon av leverfibrose. Det er fortsatt relevant å identifisere pasienter med kontraindikasjoner eller intoleranse for interferon (tabell 2). Per i dag består HCV-behandlingen av ulike kombinasjoner av følgende medikamenter: pegylert inferferon alfa (PEG), ribavirin (RBV), sofosbuvir (SOF), simeprevir (SMV) og daclatasvir (DCV). De nye direktevirkende antivirale midlene SOF, SMV og DCV har alle nådd det norske markedet i 2014 . Ulike aktuelle regimer er sammenfattet i tabell 3, men for nærmere behandlingsalgoritme vises det til den nasjonale veilederen for utredning og behandling av hepatitt C (6). Behandling av genotype 4,5 og 6, som er svært sjeldne i Norge, omtales ikke her da det foreligger lite data.
Sofosbuvir (SOF) er en nukleosidanalog polymerasehemmer med pangeno-typisk effekt (7). Ved genotype 1 er effekten god med 89 % SVR hos behandlingsnaive etter 12 ukers behandling med SOF+PEG+RBV. Ved genotype 2 er resultatene svært gode med hele 95 % SVR hos behandlingsnaive etter 12 ukers behandling med SOF+RBV. Effekten er dårligere ved genotype 3 med 83 % SVR hos behandlingserfarne etter 12 uker med SOF+PEG+RBV. Etter 24 ukers behandling med SOF+RBV kan opptil 94 % oppnå SVR, men resultatene er dårligere hos behandlingserfarne, spesielt hos pasienter med cirrhose.
Simeprevir (SMV) er en førstegenerasjons proteasehemmer (”second wave”) med effekt mot genotype 1 (8). Resultatene av behandling med SMV+PEG+RBV er brukbare med rundt 80 % SVR hos behandlingsnaive. Det interferonfrie alternativet SMV+SOF er imidlertid bedre med 93 % SVR etter 12 ukers behandling uavhengig av både behandlingserfaring og fibrosestadium.
Daclatasvir (DCV) er en NS5A-hemmer med pangenotypisk effekt som har vist gode resultater (9). 12-24 ukers behandling med DCV+SOF har gitt 98 % SVR for genotype 1 og opptil 90 % SVR for genotype 3, men igjen er resultatene dårligere (SVR 60-70 %) for pasienter med genotype 3 og cirrhose.
PEG+RBV vil fremdeles kunne gi svært gode resultater til en brøkdel av prisen på de nye regimene, og den norske veilederen anbefaler derfor at vi fortsatt bruker dette alternativet hos utvalgte pasienter, selv i fravær av signifikant leverfibrose. Hos behandlingsnaive genotype 2/3-pasienter under 40 år med rask virusrespons (RVR = ikke påvistbart HCV RNA ved uke 4) vil faktisk 95 % oppnå SVR etter 12 ukers behandling (10).
En kombinasjon av den ritonavir-boostede proteasehemmeren ABT-450, den non-nukleosidanaloge polymerasehemmeren dasabuvir og NS5A-hemmeren ombitasvir er utprøvd med og uten ribavirin for behandling av genotype 1 med 95-100 % SVR etter 12-24 ukers behandling (11). NS5A-hemmeren ledipasvir (LDV) kombinert med SOF har også gitt SVR hos 95-100 % (12). Pasienter med genotype 3 har oppnådd noe dårligere respons på de nye regimene, men både DCV og LDV har vist imponerende resultater i kombinasjon med SOF og vi venter at SOF+LDV formulert som én tablett daglig blir markedsført i Norge i første halvdel av 2015.
Med utsikter til enkle behandlingsregimer med minimale bivirkninger som kan kurere opp mot 100 %, kunne man være fristet til å tro at hepatitt C-problemet er løst. Så enkelt er det nok ikke. Første bud er å nå fram til pasientene, og globalt står millioner av HCV-pasienter i dag uten tilbud om diagnostikk eller behandling. Her hjemme er det spesielt hos pasienter med aktivt rusmisbruk at behandlingsopptaket fortsatt er svært lavt, noe som skyldes multiple barrierer på flere nivåer. Hvis HCV-epidemien skal kunne kontrolleres må slike barrierer påvises og håndteres systematisk. En viktig barriere er åpenbart de høye prisene på de nye medikamentene, men en nullvisjon for hepatitt C i Norge er innen rekkevidde.