Av Torgun Wæhre, overlege dr med, Infeksjonsmedisinsk avdeling, OUS Ullevål
Osteomyelitt er en heterogen gruppe alvorlige infeksjoner som byr på betydelige diagnostiske og terapeutiske utfordringer. Gode vevsprøver til mikrobiologisk diagnostikk er avgjørende for målrettet og vellykket antibiotisk behandling.
Osteomyelitt – infeksjon i benvev – har forekommet til ”alle tider”. Spor etter osteomyelitt er funnet i dyrefossiler fra før menneskets tid og i arkeologiske utgravinger fra gamle kulturer (1). Ofte fulgte disse infeksjonene i forløpet av åpne frakturer – en hyppig forekommende lidelse i mennesket tidlige, ”ville” liv. Osteomyelitt kan knapt kalles én sykdom ettersom det kliniske spekteret er svært variabelt, noe som også vanskeliggjør gode kliniske studier.
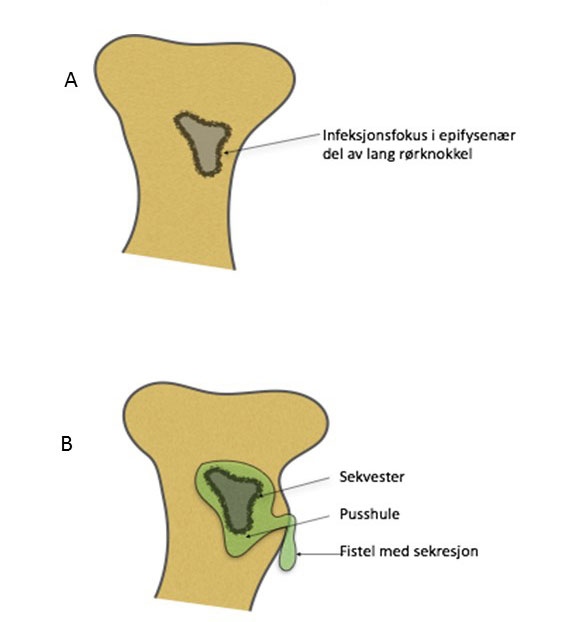
Figur 1. Skjematisk tegning av osteomyelitt i lang rørknokkel. Fra det initiale infeksjonsfokus (A) utvikles etter hvert et devaskularisert benlegeme (sekvester) med omkringliggende pusshule og gjennombrudd til hud (fistel) med kronisk eller intermitterende sekresjon.
Normalt benvev er i utgangspunktet motstandsdyktig mot infeksjon. Mikroorganismene når benvevet enten hematogent ved bakteremi eller ved direkte spredning i forbindelse med traumer, kirurgi eller fra infisert hud/ bløtvev.
Store inokuler av mikroorganismer, skadet benvev etter traumer eller degenerative prosesser og fremmedlegemer er faktorer som fremmer infeksjonsutvikling. Utvikling av osteomyelitt kjennetegnes av bakterieadhesjon og intracellulær invasjon. Ofte vil bakteriene leve i biofilm – et spesialisert bakteriesamfunn med langsom celledeling som er motstandsdyktig både mot vertens forsvar og antibiotika (1).
Inflammasjonsresponsen vil forstyrre den normale balansen mellom benresorpsjon og nydannelse. Pussdannelse vil tette til kanalene i benvevet, gi økt trykk og redusert blodforsyning til det infiserte vevet. Opphevet blodforsyning gir nekrose og dannelse av døde benlegemer – sekvester – et viktig kjennetegn på kronisk osteomyelitt. I eksperimentelle dyremodeller har dannelse av sekvester vist seg å ta 10 dager.
Underliggende sykdommer som diabetes, kronisk alkoholisme, nyresvikt og immunsuppresjon øker risikoen for alle undergrupper av osteomyelitt.
Klassifikasjonssystemer for osteomyelitt er foreslått av blant annet Cierny/Mader og Lew/Waldvogel (Tabell 1). Cierny og Mader klassifiserer infeksjonene anatomisk, d.v.s. etter hvilken del av ben som er affisert (medulla, spongiosa, cortex), og fysiologisk ut fra pasientens status og lokale forhold i infeksjonsområdet. Denne stadieinndelingen kan gi implikasjoner for behandling, antibiotika alene eller antibiotika+kirurgi, og i tilfelle hva slags kirurgi (2). Lew og Waldvogels inndeling er mer ”etiologisk” og kan ikke brukes for å veilede terapeutiske valg. Den baserer seg på varighet av sykdom (akutt vs. kronisk), infeksjonsmåte (hematogen vs. spredning fra nærliggende infeksjon) og om det foreligger vaskulær insuffisiens (3).
Med en mer praktisk ”indremedisinsk” tilnærming kan man si at akutt osteomyelitt er infeksjoner som oftest oppstår etter bakteremi eller eventuelt direkte inokulasjon, som er nylig erkjent og som ofte er karakterisert av akutte infeksjonstegn som feber (Tabell 2). Prognosen er som regel god ved antibiotikabehandling alene; kirurgisk behandling er sjelden nødvendig.
Kronisk osteomyelitt sees i all hovedsak som et sekundærfenomen etter traumer, kirurgi eller hud-/bløtdelsskader slik som decubitalsår. Risikoen er størst ved innsetting av osteosyntesemateriale og proteser. Kronisk osteomyelitt kan også oppstå ved manglende tilheling / forsinket behandling av akutt osteomyelitt. Typiske karakteristika for kronisk osteomyelitt er forekomst av dødt ikke-vaskularisert benvev (sekvester), og fistler mellom ben og hud med kronisk eller intermitterende sekresjon (ur 1). Det foreligger alltid makroskopisk eller histologisk devitalisert benvev. Smerter og eventuell sekresjon er dominerende symptomer, mens generelle infeksjonstegn som feber og kraftig forhøyede inflammasjonsparametre er mindre framtredende. Behandlingen vil som regel være en kombinasjon av kirurgi og antibiotika.
Akutt hematogen osteomyelitt i lange rørknokler forekommer først og fremt hos barn, og er lokalisert nær epifyseskiven.
Spondylodiskitt er den vanligste akutte hematogene osteomyelitten hos voksne. Forekomsten er ca 3-4/100 000 innbyggere pr år, hyppigst hos personer over 50 år. Infeksjonen affiserer nesten alltid en mellomvirvelskive og de to nærliggende virvlene. Vanligste lokalisasjon er lumbalkolumna, deretter cervikalt.
Proteseosteomyelitt er en fryktet komplikasjon til innsettelse av leddproteser og rammer ca 0.5-1% av pasienter som får innsatt hofteprotese og det dobbelte ved kneproteser. Infeksjonsfaren er betydelig høyere ved protesekirurgi i forbindelse med traumer og brudd.
Diabetiske fotinfeksjoner er ofte komplisert med kronisk osteomyelitt.
Staphylococcus aureus er dominerende agens ved alle former for osteomyelitt (3, 4).
Ved akutt hematogen osteomyelitt/spondylodiskitt forekommer også betahemolytiske streptokokker, pneumokokker, viridans-streptokokker og gramnegative stavbakterier (Enterobacteriaceae og Pseudomonas spp).
Etter innsetting av fremmedmateriale forekommer også infeksjon med lavvirulente bakterier slik som koagulasenegative stafylokokker. Ved kroniske infeksjoner etter traumer, dekubitalsår eller kirurgi er benvevet kontaminert utenfra, og ulike typer bakterier fra hud- eller tarmflora kan forekomme, ofte i blanding.
Candida sp. og andre gjærsopper er beskrevet som årsak til osteomyelitt hos intravenøse stoffmisbrukere og immunsupprimerte.
Mycobacterium tuberculosis er globalt en viktig årsak til osteomyelitt og spondylodiskitt, og forekommer også i Norge, i all hovedsak blant personer som er født i høyendemiske områder. Brucellose er en annen importsykdom som kan forårsake beninfeksjoner. Syfilitisk osteomyelitt er blitt en sjeldenhet.
Mikrobiologisk diagnostikk, inkludert resistensbestemmelse, er avgjørende for målrettet og vellykket behandling av osteomyelitt. Slike prøver tas før oppstart av antibiotika, eventuelt etter en tids antibiotikapause; minst 2 døgn, helst lenger hvis klinisk mulig. Ved akutt osteomyelitt/spondylodiskitt tas alltid blodkulturer som kan være positive hos 50–60 %. Ved negative blodkulturer og ved kronisk infeksjon bør det tas biopsi/aspirater fra infisert bein eller mellomvirvelskiver. Dette kan gjøres under radiologisk veiledning, eventuelt kirurgisk. Sannsynligheten for positiv prøve ved radiologisk veiledede prøver ved spondylodiskitt er beskrevet i området 30-75 % (4, 5). Det kan være aktuelt å gjenta prøvetakning ved negativt resultat ved første forsøk.
Ved proteseinfeksjoner kan det gjøres leddaspirat og/eller tas flere (5–6) biopsier peroperativt i forbindelse med revisjon.
Materialet må undersøkes mikrobiologisk med direkte mikroskopi, aerob og anaerob dyrkning med resistensbestemmelse, og evt genteknologisk (PCR og sekvensering av 16S RNA). Eventuelt gjøres også sopp- og mykobakteriediagnostikk. Histologisk undersøkelse kan også være nyttig, særlig ved kronisk osteomyelitt. Prøver tatt fra fistelåpninger, eller i overflaten av sår, er i regelen uten verdi da disse områdene som oftest er kontaminert med andre mikrober enn de som forårsaker osteomyelitten. Ved leddnære affeksjoner kan det etiologiske agens påvises i aspirat av leddvæske i opptil 85 % av tilfellene, og celletallet i leddvæsken er forhøyet.
Serologisk undersøkelse er indisert ved mistanke om infeksjon med Brucella species.
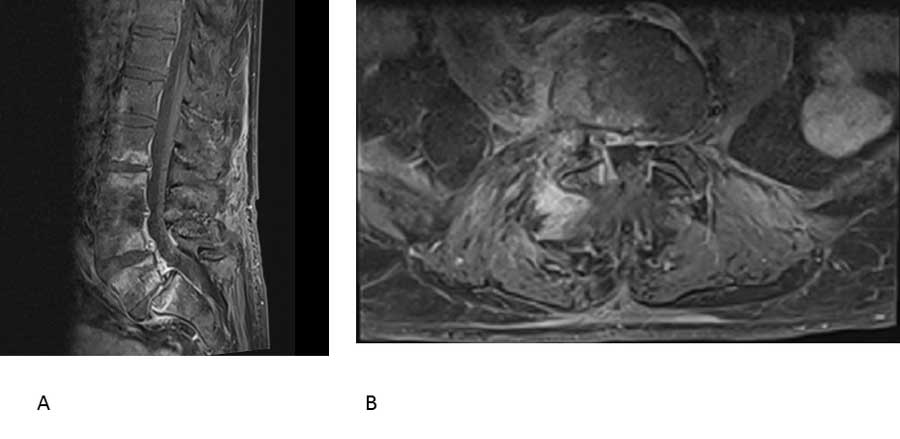
Figur 2. MR-bilde (T1-vektet) med kontrast av spondylodiskitt i lumbalcolumna. Sagittalsnitt (A) viser ødem (hvitt) i virvlene L2-S1 med mellomliggende skiver, og kraftig kontrastoppladning (hvitt) i skive L5/S1, samt både foran og bak columna. I aksialsnitt (B) ses ødem og kontrastoppløsning rundt fasettledd og i rygg- og psoasmuskulatur på høyre side. (Bilde ved Hans Einar Treidene, Radiologisk avdeling, OUS).
Alle bildediagnostiske modaliteter har lav sensitivitet tidlig i forløpet av akutt osteomyelitt (5,6). MR er regnet som viktigste modalitet med høy sensitivitet for osteomyelitt, kanskje særlig ved diabetiske fotinfeksjoner og spondylodiskitt. Ved spondylodiskitt sees typisk benmargsødem og kontrastoppladning, i tillegg fremstilles eventuelle epiduralabscesser godt (Figur 2). Skjelettscintigrafi har god sensitivitet, men lav oppløselighet. Konvensjonell røntgen er mest nyttig for differensialdiagnostikk og ved kroniske infeksjoner. CT kan gi god informasjon om sekvester og bløtvev.
Antibiotika og kirurgi er hjørnesteiner i behandling av osteomyelitt. Ved akutt hematogen osteomyelitt og spondylodiskitt, kommer man som regel til målet ved antibiotikabehandling alene, ved behov supplert ved perkutan, radiologisk veiledet drenasje av abscesser. Epiduralabscesser kan gi avklemning av medulla spinals og nevrologiske utfall som krever nevrokirurgisk intervensjon. Ved kronisk osteomyelitt vil det oftest være behov for kirurgi for revisjon og fjerning av dødt ben- og bløtvev, fiksering, fylling av dødrom og for tilstrekkelig bløtdels- og huddekning. Cierny/Mader-klassifikasjonen kan være et nyttig verktøy for å vurdere hvorvidt pasienten er kandidat for kirurgi og eventuelt hvilken type (2). Hos noen pasienter er amputasjon nødvendig. Ved svært kompliserte infeksjoner og hos svekkede pasienter hvor infeksjonen ikke kan saneres, kan kronisk antibiotikabehandling (suppresjonsbehandling) være løsningen.
Antibiotikabehandling er alltid indisert ved verifisert eller mistenkt infeksiøs osteomyelitt. Vi har få gode, kliniske studier som kan gi klare svar på hvilke typer antibiotika som bør brukes, om behandlingen skal gis intravenøst eller peroralt, og hva som er ideell varighet av behandlingen. Ved valg av behandling er det viktig å ta hensyn til de ulike antibiotikas penetrasjon til benvev og biotilgjengelighet ved peroral behandling.
Betalaktamantibiotika, som har vært hjørnesteiner i osteomyelittbehandling, penetrerer dårlig til benvev. Ved å gi høye doser parenteralt overkommes dette problemet. Peroral betalaktambehandling har tradisjonelt ikke vært anbefalt p.g.a. svært varierende biotilgjengelighet. Disse anbefalingene er opprettholdt i nyere internasjonale retningslinjer (4, 5,7). Høye perorale doser kombinert med probenecid som forsinker renal utskillelse har vært foreslått, i alle fall i sluttfasen av behandlingen, men mangler god klinisk dokumentasjon (8). Fluorokinoloner, trimetoprim, klindamycin, fusidin og rifampicin har god biotilgjengelighet og benpenetrasjon, og kan være egnede perorale midler avhengig av agens og resistensforhold. Hverken rifampicin, fusidin eller kinoloner skal brukes i monoterapi ved stafylokokkinfeksjoner pga stor fare for resistensutvikling. I motsetning til de fleste andre antibiotika har rifampicin vist seg å ha god effekt på bakterier som lever i biofilm. Kombinasjonsbehandling med rifampicin og et annet peroralt middel er derfor særlig aktuelt ved proteseinfeksjoner der målet er at protesen ikke skal fjernes (9,10). Sekvensiell terapi, der en kortere intravenøs behandling, etterfølges av peroral behandling er også aktuelt. Aminoglykosider brukt parenteralt har bare plass i en akutt septisk fase, men kan benyttes lokalt i kjeder, matter, spacere og sement.
Kriterier for behandlingsvarighet og indikasjon for skifte fra peroral til intravenøs behandling er dårlig definert. Tradisjonelle anbefalinger er delvis basert på dyrestudier som viser at sterilisering av beinvev er en langsom prosess. De senere år har det kommet noen studier som indikerer at behandlingsvarighet ofte kan være kortere enn det som tradisjonelt har vært anbefalt, og at peroral behandling er like bra som parenteral, i alle fall ved kronisk infeksjon (7, 11, 12). Et problem både i studier og klinisk praksis er at kriterier for helbredelse og remisjon kan være vanskelig å definere.
Generelt kan det anbefales, på bakgrunn av studier fra senere år, at akutt hematogen osteomyelitt hos barn kan behandles i 3 uker, spondylodiskitt i 6 uker, og kronisk osteomyelitt i 4-12 uker (7,11,12). Tabell 4 foreslår antibiotikavalg og dosering ved ulike agens.
Behandling av kronisk osteomyelitt er et teamarbeid mellom ortoped og infeksjonsmedisiner. Ved vellykket behandling normaliseres evt forhøyet CRP raskt, mens SR faller til normalverdi over måneder. Det er ikke et krav at SR skal være normal før behandlingen avsluttes. Dersom CRP eller SR stiger under behandling, kan dette være et uttrykk for ineffektiv antibakteriell behandling, slurv med legemiddelinntak, legemiddelreaksjon eller inadekvat kirurgisk behandling. Seponering av antibakterielt middel og kirurgisk revisjon er da aktuelt. Tilbakegang av forandringer med CT/MR er uegnet som kriterium for avslutning av antibiotikabehandling da forandringene vedvarer etter klinisk tilheling.
Referanser