Kristiane Birkeland Bleskestad, stud.med, Universitetet i Bergen
Kåre I. Birkeland, avdelingsleder/professor, Oslo universitetssykehus/Universitetet i Oslo
Trygve Hausken, overlege/professor, Gastroenterologisk seksjon og Nasjonal kompetansetjeneste for funksjonelle mage-tarmsykdommer, Haukeland Universitetssykehus/ Universitetet i Bergen
Fekal mikrobiotatransplantasjon (FMT) er vist å gi gode resultater ved behandlingen av tarminfeksjon forårsaket av bakterien Clostridium difficile. Flere studier viser at FMT kan bedre symptomer også hos pasienter med IBS. Teorien er at slik behandling kan ha gunstig effekt på tarmmikrobiota og bidra til å gjenopprette homeostase. Denne artikkelen belyser publisert forskning på området. Den er basert på generell bakgrunnslitteratur om IBS funnet gjennom pyramidesøk på Helsebiblioteket og mer spesifikke søk i de tilfellene det har vært nødvendig.
Funksjonelle gastrointestinale forstyrrelser er utbredt og det antas at 20-30% av befolkningen er rammet. En av de hyppigst forekommende undergruppene er irritabel tarmsyndrom (irritable bowel syndrome, IBS). Patogenesen er multifaktoriell, og endringer i tarmens bakterieflora undersøkes nå som en mulig årsak (tabell 1). Det kan også ha behandlingsmessige konsekvenser.

Ved å ta i bruk moderne molekylærbiologiske metoder er det blitt mulig å kartlegge tarmens bakterieflora på en helt annen måte enn tidligere. Den samlede bakterieflora i tarmen kalles gjerne tarmmikrobiota.
Tarmene til et nyfødt spedbarn er sterile, men kolonisering av bakterier begynner umiddelbart etter fødsel og påvirkes av blant annet type fødsel, spedbarnets diett, hygiene og medikamentbruk. Innen barnet fyller ett år er tarmen kolonisert med bakterier, og denne bakteriesammensetningen er svært stabil gjennom individets levetid. Enterobakterier og bifidobakterier koloniserer tidlig. Det er observert forskjeller i bakteriekolonisering mellom spedbarn som får brystmelk og de som får morsmelkerstatning (1). Dette er områder aktuelle for videre forskning.
Tarmbakteriene tilhører i hovedsak delgruppene Firmicutes, Actinobacteria, Bacteroides, Proteobacteria og Verrucomicrobia. Bruk av moderne genteknologiske metoder, spesielt sekvenseringsteknikker, har gjort det mulig å bekrefte teorien om at mennesket har en unik og stabil sammensetning av mikrobiota i tarmen. Bakterieflora i tarm ser ut til å være mer stabil enn den vi finner på andre vevsoverflater, slik som bakterieflora i hud og munnhule. Andre studier bekrefter dette, og viser hvordan avføringsprøver til studieobjekter fulgt gjennom 10 år opprettholdt en karakteristisk personlig mikroflora, selv om den varierte mellom studieobjektene (2).
Tarmbakteriene har metabolsk aktivitet, de produserer kortkjedede fettsyrer, vitamin K, folsyre og biotin, som er viktig i normal metabolisme. Bakteriene bidrar også til immunfunksjon i tillegg til å påvirke celledifferensiering og proliferering. Disse metabolske prosessene gjenvinner verdifull energi og næringsstoffer for bakteriell vekst og proliferering (1). Longitudinelle studier tyder på at mikrobiotasammensetningen kan påvirkes av diett, antibiotikabruk og tarmtransport, men også kanskje av andre, mindre undersøkte livsstilsfaktorer (2).
Sammensetningen av tarmmikrobiota avhenger også av diett. Tidligere har denne sammenhengen vært lite kjent, men i en komparativ studie fra Italia i 2010 ble fekal mikrobiota av barn fra EU sammenlignet med fekal mikrobiota av barn fra landlige områder i den afrikanske byen Burkina Faso (3). I Burkina Faso er dietten rik på fiber og inneholder lite fett, sukker og salt sammenlignet med en europeisk diett. Ved å bruke sekvenseringsteknikker og biokjemiske analyser ble det funnet signifikante forskjeller mellom tarmmikrobiota i de to gruppene. Barna fra Burkina Faso viste berikelse av Bacteroider og redusert mengde Firmicutes, i tillegg til store mengder bakterier fra Prevotella og Xylanibacter. De sistnevnte bakteriene er kjent for å inneholde bakterielle gener for cellulose- og xylanhydrolyse, og var helt fraværende i tarmmikrobiotaen hos barna fra EU. Dette gjenspeiler forskjeller i barnas diett. Studien fant også mer kortkjedede fettsyrer hos barna fra Burkina Faso sammenlignet med barna fra EU (3). En hypotese er at endringer i tarmmikrobiota, som har oppstått i utviklingen av en moderne diett, bidrar til økt forekomst av funksjonelle gastrointestinallidelser. Sammenhengen må undersøkes nærmere.
Pasienter med IBS ser ut til å ha en endret bakterieflora i tarm sammenlignet med friske kontroller (4). Forekomst av en rekke bakterier er undersøkt hos pasienter og kontroller, men resultatene er varierende. Et av de mer konsistente funnene er gjort av Kerckhoffs et al. som viste at pasienter med IBS har redusert mengde Bifidobacteria i både tynn- og tykktarm (5).
I tillegg til endret tarmmikrobiota opplever pasienter med IBS forstyrrelser i karbohydrat- og proteinmetabolismen (6). Det er også observert at pasienter med IBS har økt mengde eddik- og propionsyre i tarmene, noe som kan gi oppblåsthet og abdominale smerter (7). En direkte sammenheng antas å eksistere mellom overvekst av enkelte bakterier i tynntarmen (small intestinal bacterial overgrowth) og IBS (8). Dette er kontroversielle teorier, og selv om flere studier har observert en sammenheng mellom forandringer i tarmmikrobiota og IBS-symptomer, er de fleste studiene små og det er ofte mangelfull kontroll med mulige konfundere, særlig kostfaktorer.
Studiene tyder likevel på at både tarmmikrobiota og metabolske funksjoner er endret hos pasienter med IBS, og at dette er med på å forklare sykdomsbildet. Slike studier er opphavet til og grunnlaget for utvikling av behandlingsalternativet fekal mikrobiotatransplantasjon (FMT).
I utgangspunktet ble FMT brukt i behandlingen av pseudomembranøs enterokolitt forårsaket av infeksjon med bakterien Clostridium difficile (CDI). Tilstanden antas forårsaket av antibiotikabruk. Økende antibiotikabruk i samfunnet gir derfor økt prevalens av pseudomembranøs enterokolitt. I dag er førstelinjebehandlingen for slik infeksjon avslutning av pågående antibiotikabehandling, og behandling med metronidazole, vancomycin eller fidaxomicin, avhengig av sykdommens alvorlighetsgrad (9). Selv om mange responderer godt på denne behandlingen, opplever en stor andel (15 til 35%) tilbakefall av symptomer. Dette var utgangspunktet for utviklingen av FMT som behandlingsmetode. Resultatene er svært gode, og i en oversiktsartikkel finner Brandt et al. tilfriskning hos 92% av pasientene med recidiverende infeksjoner med clostridium difficile ved behandling med FMT. Dette har ført til at FMT nå vurderes som førstelinjebehandling ved slike infeksjoner. (9).
FMT innebærer infusjon av avføring fra en frisk donor til en pasients tarm (figur 1). Administreringsrute varierer. FMT regnes altså i hovedsak som behandling for recidiverende infeksjoner med Clostridium difficile, men er forsøkt i behandlingen av en rekke andre gastrointestinale lidelser, slik som inflammatorisk tarm, IBS og forstoppelse. I disse tilfellene er derimot resultater, administreringsrute og direkte effekter i mindre grad dokumentert.
Et begrenset utvalg studier tyder på at FMT også kan være god behandling for IBS (9). Foreløpig er grunnlaget for å konkludere mangelfullt, og flere studier kreves. Opptil 30% av pasienter med akutt gastroenteritt rapporterer postinfeksiøs IBS i en studie, noe som tyder på at patogenesen til IBS henger sammen med endret tarmmikrobiota (10). En annen studie fra 2011 undersøkte 14 franske kvinner med C-IBS (IBS preget av forstoppelse) og sammenlignet dem med friske kontroller. Resultatene viste store forskjeller i tarmmikrobiota, med økt populasjon av sulfat-reduserende bakterier hos kvinnene med IBS. I tillegg var antall laktat-produserende bakterier og antall H2-konsumerende populasjoner sterkt redusert. Studien konkluderer med at disse forandringene kan bidra til IBS-patogenese (11). Tarmmikrobiota varierer imidlertid mellom de ulike variantene av IBS. Det differensieres mellom IBS preget av diaré (IBS-D), IBS preget av forstoppelse (IBS-C) og en blandet type IBS (IBS-M) (12). Probiotika viser seg å kunne bidra til å gjenopprette balanse i mikrobiota hos pasienter med IBS og gi bedring i symptomer. Avføring fra frisk donor anses å ha optimal sammensetning av menneskelig tarmmikrobiota, og vil dermed fungere som en ideell form for probiotika. Dette er utgangspunktet for fekal mikrobiotatransplantasjon ved IBS.
Det er publisert tre prospektive intervensjonsstudier som har undersøkt effekten av FMT ved funksjonelle tarmlidelser, to ved IBS og en hos pasienter med kronisk forstoppelse. Studiene ble utført mellom 1989 og 2014, og hovedresultatene er fremstilt i tabell 2. Studiene omhandler totalt 113 pasienter.
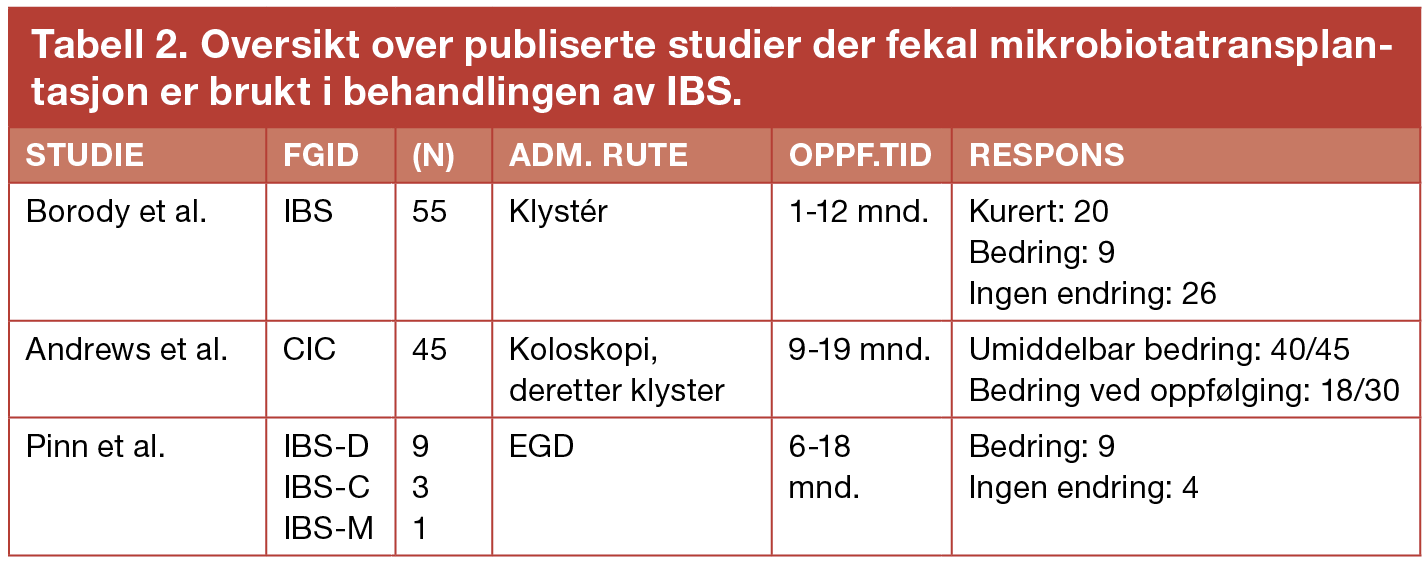
IBS, irritabel tarmsyndrom; FMT, fekal mikrobiotatransplantasjon; FGID, funksjonelle gastrointestinallidelser; n; antall pasienter; CIC, kronisk idiopatisk forstoppelse, EGD, Esophagogastroduodenoscopy.
I tillegg til disse tre studiene ble det i 2014 publisert en systematisk oversikt og meta-analyse som undersøkte effekten av probiotika, prebiotika og syntetisk biotika hos pasienter med IBS og kronisk idiopatisk obstipasjon (CIC). Søket identifiserte 3216 artikkeltreff og inkluderte 43 randomiserte kontrollerte studier. Relativ risiko for vedvarende IBS symptomer etter probiotikabehandling var 0.79 (95% konfidensintervall 0.70-0.89). Data for prebiotika og syntetisk biotika som behandling av IBS var mangelfulle (13).
Den første studien som har undersøkt effekten av FMT ved funksjonelle tarmlidelser ble utført på pasienter med FGID i 1989, av Borody et al (14). Behandlingen ble brukt på 55 pasienter som led av forstoppelse, diaré, abdominale smerter, ulcerøs kolitt eller Crohns sykdom. Pasienter ble behandlet med FMT etter at annen behandling ikke hadde vært vellykket (14). Etter forandring av tarmmikrobiota med FMT rapporterte 20 av de 55 pasientene fullstendig tilbakegang av symptomer. Ni av pasientene opplevde reduksjon i sine plager, mens tilstanden hos 26 av pasientene var uforandret. Studien har blitt sterkt kritisert, særlig på grunn av manglende kontrollgruppe. Det vises heller ikke til mikrobiotaprøver av pasientene før eller etter transplantasjon, noe som ville styrke en mulig sammenheng, dersom symptombedring korrelerte med endring i mikrobiota. Det er få deltakere i studien, og pasientene utgjør ikke en homogen gruppe. Lidelsene som behandles varierer i stor grad, uten at dette er kommentert eller diskutert. Til tross for dette er artikkelen sitert gjentatte ganger, og trekkes i dag frem som et av få eksempler på hvordan FMT kan brukes i behandling av blant annet IBS.
I 1995 utførte Andrews et al. en studie som undersøkte bakterieterapi som behandling for pasienter med kronisk forstoppelse (15). Forstoppelse blir her definert som avføring mindre enn tre ganger per uke over 12 måneder eller mer, og regnes som en type FGID. Det var 45 deltakere i studien, og i forkant av bakterietransplantasjonen gjennomførte pasientene en antibiotikakur over tre dager. I tillegg gikk pasientene på en høyfiberdiett, og alle gjennomgikk tarmskylling før transplantasjon. På den fjerde dagen ble bakteriekultur (20 ulike kulturer, inkludert Bakteroider, Escherichia Coli og Lactobacillus) innført via koloskop til coecum. Neste dag gjennomgikk pasientene en andre injeksjon ved hjelp av klystér. Oppfølging ble utført 9-19 måneder etter prosedyre (15). Umiddelbart etter transplantasjon rapporterte 40/45 (89%) pasienter tilfredsstillende lettelse av sine plager. Ved oppfølging rapporterte 18/30 (60%) pasienter å ha et normalt avføringsmønster, uten bruk av avføringsmidler (15). Resultatene tyder på at manipulering av mikroflora kan bidra til en langtidsforbedring ved kronisk forstoppelse. Men studien mangler kontrollgruppe, og sammenligner ikke behandlingsalternativet med placebo. Pasientene gjennomgår i tillegg til transplantasjon en antibiotikakur og en tarmskylling, samt at de settes på en høyfiberdiett, i forkant av mikrobiotatransplantasjonen. Dette er faktorer som kan tenkes å påvirke pasientenes kroniske forstoppelse, og som det ikke kontrolleres for i studien. Likevel viser studien hvordan mikroflora i tarm kan se ut til å påvirke forstoppelse, og at manipulering av mikrobiota kan være et behandlingsalternativ for pasienter med kroniske fordøyelsesplager. Studien har bidratt til økt oppmerksomhet rundt kroniske fordøyelsesplager og mikrobiotatransplantasjon. Studien har også skapt økt fokus på at det er forskjeller mellom ulike typer fordøyelsesplager, og at dette kan gjenspeiles i tarmmikrobiota. Dette er ikke pasienter som passer inn i kategorien for IBS. Studien er likevel tatt med fordi den innebærer FMT på pasienter med en funksjonell gastrointestinallidelse, og den belyser viktige sider ved behandling. Mange pasienter med IBS opplever kronisk forstoppelse som en del av sitt sykdomsbilde, og betraktningene i denne studien er derfor av relevans.
I 2014 undersøkte Pinn et al. FMT som behandling for 13 pasienter med alvorlig IBS (ni med IBS-D, tre med IBS-C og én med IBS-M (16). Pasientene ble fulgt opp i gjennomsnittlig 11 måneder (6-18 måneder). 70% av pasientene (9/13) rapporterte symptomatisk bedring etter FMT. Spesifikt rapporterte pasientene forbedring i abdominale smerter (72%), dyspepsi (67%), avføringsmønster (56%), oppblåsthet (50%) og flatus (45%). Nærmere halvparten av pasientene rapporterte en generelt bedret allmenntilstand etter FMT (12). Denne studien undersøker i større grad bredden mellom pasientene med IBS. Både IBS pasienter preget med plager av diaré, forstoppelse og en kombinasjon av disse ble inkludert i pasientgruppen. Likevel skilles det ikke mellom de ulike undergruppene av IBS i resultatene. Dette ville det imidlertid vært interessant å se resultater på dersom det hadde vært flere deltakere med i studien. Denne studien er også designet uten kontrollgruppe for sammenligning med annen behandling eller placebo. Det brukes et spørreskjema til pasientene som ikke tidligere er validert. Dette er også en svakhet. Støtte til teorien om FMT som behandling ved IBS styrkes likevel som et resultat av at pasientene som er tatt med i studien i utgangspunktet ikke responderte på tradisjonell behandling som diettforandringer, antidepressiva, probiotika eller antibiotika. Derfor er en symptombedring hos rundt 70% av pasientene betydelig.
Foreløpige studier som undersøker FMT som behandling ved IBS er lovende. Kun et fåtall pasienter rapporterer remisjon av plager fra sin IBS uten behandling. En gjennomsnittlig bedring hos rundt 50% av pasienter med en alvorlig IBS-diagnose er derfor gode resultater, og mange ønsker å forsøke slik behandling. Likevel kreves randomiserte, kontrollerte studier for å bestemme om FMT virkelig er en effektiv behandlingsmetode ved IBS (12). I tillegg bør risiko for overføring av sykdommer mellom donor og pasient vurderes nøye opp mot alvorlighetsgraden av plagene.
Dagens foretrukne behandling ved IBS er såkalt FODMAP-redusert diett. FODMAP (Fermentable Oligosaccarides, Disaccarides, Monosaccarides And Polyols) er små, tungtfordøyelige karbohydrater som kan trigge symptomer hos mennesker med IBS. Når FODMAP-stoffer ikke brytes ned i tynntarmen, vil de passere videre ufordøyd til tykktarmen hvor tykktarmsbakteriene tar over nedbrytningen. Gjennom en fermenteringsprosess dannes gasser. I tillegg er FODMAP-stoffer osmotisk aktive, det vil si at de kan trekke med seg væske i tynntarmen. Studier viser at rundt 70% av pasienter som følger en FODMAP diett opplever bedring fra sine IBS symptomer (17). Dette er lite inngripende og billig behandling med god effekt, og bør derfor fortsatt anbefales som førstelinjebehandling til nydiagnostiserte pasienter. Likevel kan FMT være et godt alternativ til pasienter med alvorlige tilfeller av IBS eller pasienter som ikke ønsker eller klarer å følge en streng diett. Flere av studiene som har undersøkt FMT til pasienter med FGID har inkludert pasienter som ikke responderer på diettbehandling, og forskjellen i behandlingsrate mellom de to behandlingsalternativene kan derfor være noe misledende.
Fremtidige studier krever et randomisert, kontrollert design, og bør undersøke forandringer i tarmmikrobiota før og etter FMT i tillegg til å sammenligne de bakterielle populasjonene med friske donorer og kontroller (12). Bruk av donorer kan imidlertid snart være et fenomen som tilhører fortiden. En rekke studier undersøker bruken av syntetisk avføring til bruk ved FMT. Det undersøkes i tillegg effekter og sideeffekter ved bruk av kommersielt produserte kapsler med fekalt bakterieisolat som behandling av pasienter i stedet for FMT. Foreløpig er kostnadene ved produksjon av slike kapsler høye, men som et resultat av redusert bruk av personell og utstyr til administrering vil en slik metode om bare få år kunne være lønnsomt. Dette er også en lite inngripende behandlings-metode som vil kunne appellere til en større del av pasientgruppen.
I tillegg vurderes det å opprette og ta i bruk avføringsbanker til behandling med FMT for ulike lidelser. Et fåtall
donorer som gjentatte ganger leverer avføring til en slik bank vil kunne gjennomgå større seleksjon og screening, og pasienter vil utsettes for mindre risiko for overføring av sykdommer ved transplantasjon. Likevel kreves mer forskning på IBS og FMT for å kartlegge behov og behandlingsresultater. Foreløpig vet vi for lite om forskjeller ved de ulike undergruppene av IBS, bakteriekulturer og sideeffekter ved behandling til å kunne anbefale dette på en generell basis (12).
Artikkelen er en forkortet og redigert utgave av oppgaven ”Irritabel tarmsyndrom og fekal mikrobiota” skrevet i studieprogrammet Bachelor i Human ernæring, Institutt for Biomedisin, Universitetet i Bergen. Oppgaven ble levert mai 2015.