Av Marianne Aardal Grytaas, overlege og PhD-stipendiat, Medisinsk avdeling, Haukeland Universitetssykehus
Primær hyperaldosteronisme skyldes autonom overproduksjon av aldosteron fra en eller begge binyrer. Det er den vanligste formen for sekundær hypertensjon, med antatt forekomst 5-12 % av alle med hypertensjon. Økt aldosteronpåvirkning fører til høyere kardiovaskulær, renal og metabolsk risiko enn hos pasienter med essensiell hypertensjon, men risikoen reduseres ved korrekt medisinsk eller kirurgisk behandling.
Primær hyperaldosteronisme (PHA) definerer en gruppe tilstander med autonom overproduksjon av aldosteron fra en eller begge binyrer. Aldosteronsekresjonen er da uavhengig av de vanlige reguleringsmekanismene, og gir ufysiologiske virkninger i målorganene.
Aldosteronsekresjonen fra binyrebarken stimuleres normalt via renin-angiotensin-aldosteron-systemet (RAAS) eller direkte av høye kaliumnivåer (figur 1). Aldosteron utøver sine effekter ved å binde til mineralkortikoidreseptoren (MR) i forskjellige vev. I nyrene fører det til økt reabsorbsjon av natrium og økt kaliumsekresjon, med påfølgende vannretensjon, økt ekstracellulært væskevolum og økt blodtrykk, samt reduksjon av serum-kalium. MR finnes også i andre organer som hjerte og blodkar, hvor økt aldosteronpåvirkning kan føre til myokardfibrose, venstre ventrikkelhypertrofi og arteriell stivhet (1-3).
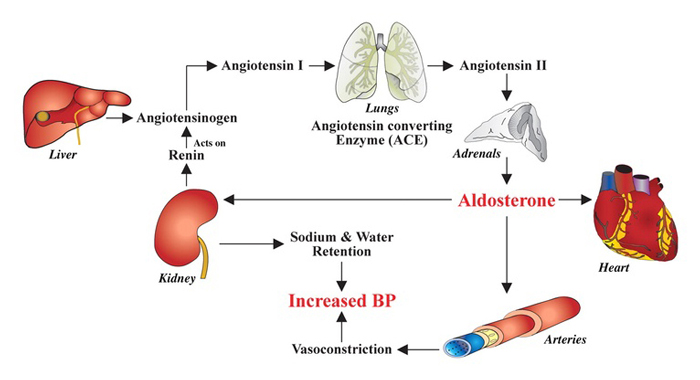
Figur 1: Renin-angiotensin-aldosteron-systemet. Figur fra Patel et.al, Radiographics 2007;27:1145-1157, gjengitt med tillatelse.
PHA ble første gang beskrevet av Jerome W. Conn (1907-1994) i 1954, da han påviste en binyretumor hos en 34 år gammel kvinne med hypertensjon (HT) og alvorlig hypokalemi. Da hun fikk fjernet tumoren ble blodtrykk og kaliumverdi normalisert. Conn kalte denne tilstanden primær hyperaldosteronisme.
Frem til tidlig 1990-tall ble det antatt at PHA var en sjelden diagnose som forårsaket under 1 % av alle tilfeller av HT. Etter innføring av aldosteron/renin-ratio (ARR) som screeningmetode for PHA, har et økende antall studier vist at PHA er den hyppigste årsaken til sekundær hypertensjon, med en antatt forekomst 5-12 % av alle med HT (4, 5). For pasienter med medikamentresistent HT, er det funnet PHA hos opp mot 20 % (6). Pasienter med PHA har, sammenliknet med essensiell HT, høyere risiko for både kardiovaskulære hendelser, nyreskade og økt risiko for redusert glukosetoleranse og diabetes mellitus type 2 (7-10).
Den ene hovedgruppene av PHA utgjøres av aldosteronproduserende adenomer (APA) – også kalt Conns syndrom, som står for 30-40 % av tilfellene og som gir sykdom i den ene binyren. Den andre hovedgruppen er bilateral binyrehyperplasi (BAH) som utgjør 60-70 % av tilfellene. I tillegg kjenner vi tre forskjellige arvelige former for familiær hyperaldosteronisme (FH), og som deles inn i type I, II og III. Til sammen utgjør disse 1-10 % av alle PHA. For FH I og FH III er det i løpet av det siste tiåret funnet kimbane-mutasjoner, hvorav mutasjoner i KCNJ5-genet ved FH III også kan gjenfinnes som somatiske mutasjoner i sporadiske APA. Ved FH II er den genetiske årsaken fortsatt ukjent, og FH II diagnostiseres ved at to personer i samme familie har diagnosen PHA.
Hypertensjon og hypokalemi er de klassiske funnene som leder mistanken til PHA. Muskelsvakhet kan forekomme ved hypokalemi. Mens det tidligere ble antatt at hypokalemi var obligat ved PHA, vet vi nå at en stor andel av PHA-pasienter er normokalemiske, spesielt ved BAH. En stor multisenterstudie viste hypokalemi kun hos 9-37 % (4).
Endocrine Society utga i 2008 retningslinjer for utredning, diagnostikk og behandling av PHA (figur 2) (11). Følgende pasientgrupper har høy risiko for PHA og bør utredes: a) HT med blodtrykk >160/100 eller medikamentresistent hypertensjon, b) HT og samtidig hypokalemi, c) binyreincidentalom og HT, d) tidlig debut av HT eller cerebrovaskulære hendelser før 40 års alder i familien, og e) hypertensive førstegradsslektninger til PHA.
Aldosteron/renin-ratio (ARR) er den anbefalte screeningtesten. ARR er mest sensitiv dersom blodprøver tas om formiddagen, minst to timer etter at pasienten har stått opp, og etter å ha sittet minst fem minutter. Verdier for positiv test varierer mellom hormonlaboratoriene i Norge, ettersom de bruker forskjellige analysemetoder for måling av renin (reninaktivitet eller direkte reninkonsentrasjon, tabell 1).

Alle forutsetter normokalemi * Forutsetter samtidig aldosteron > 416 pmol/l. **Ved samtidig aldosteron > 300 pmol/l. ***Ved samtidig aldosteron 150-300 pmol/l ****Aktuell renin-analyse; direkte renin-konsentrasjon (mIE/l) med tilhørende grenseverdier for ARR, ble innført ved Haukeland Universitetssykehus fra februar 2016.
En rekke blodtrykksmedikamenter påvirker aldosteron- og reninmålinger, og kan dermed påvirke resultat-ene ved både screening, diagnostisk testing og binyrevenekateterisering (tabell 2). Dersom det ansees medisinsk forsvarlig, seponeres disse medikamentene før utredning, og erstattes i utredningsperioden med alfablokker som doksazosin (Carduran®) og non-dihydropyridin kalsiumblokker som verapamil depottablett (Isoptin retard®).
I tillegg til medikamentpåvirkning kan hypokalemi gi falsk lave aldosteronverdier, og bør korrigeres før utredning. Nyresvikt reduserer reninkonsentrasjon og –aktivitet, mens graviditet, renovaskulær hypertensjon og malign hypertensjon øker disse.
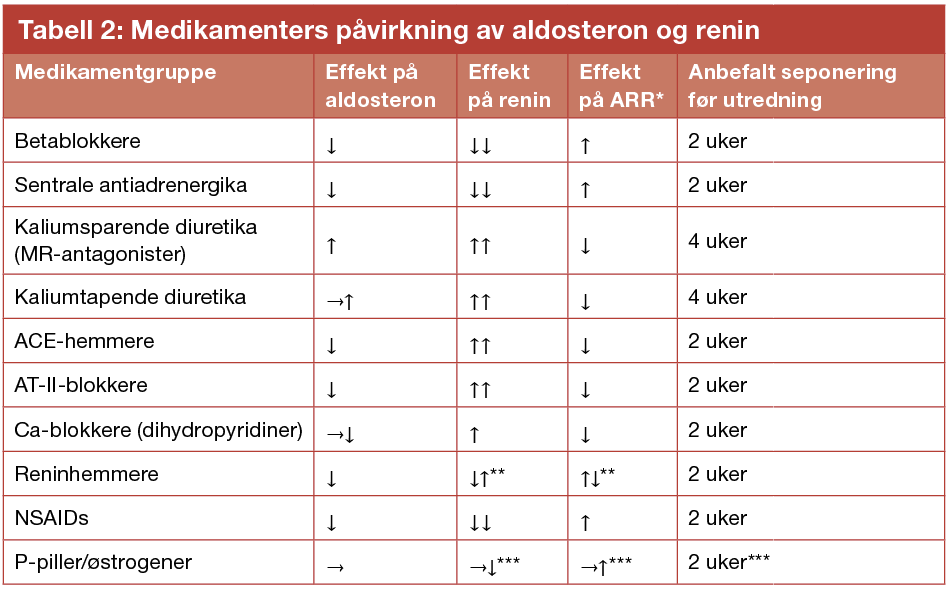
* ARR = aldosteron/renin ratio ** Reninhemmere (aliskiren (Rasilez®)) senker plasma renin-aktivitet (PRA), men øker direkte aktiv renin-konsentrasjon (DRC). ARR øker ved bruk av PRA, senkes ved bruk av DRC ***P-piller og øvrige østrogenpreparater påvirker ikke renin målt som PRA, men hemmer DRC, og kan da ved måling av DRC gi falsk positiv ARR. Seponeres kun dersom alternativ prevensjon kan benyttes.
Ved positiv ARR anbefales verifisering ved diagnostisk testing (intravenøs saltvannsbelastning, fludrokortison suppresjonstest, oral saltbelastning eller kaptopril belastningstest). Både i Norge og resten av Europa er saltvannsbelastning mest brukt. Pasienten får da infusjon av to liter isoton NaCl over fire timer. Under normale forhold skal saltvannstilførsel supprimere aldosteronsekresjonen via hemming av RAAS. Aldosteronverdi over 140 pmol/l etter saltvannsbelastning er diagnostisk for PHA.
Når PHA er bekreftet ved saltvannsbelastning, anbefales CT av binyrene (uten kontrast) som ledd i videre utredning, for å se etter adenomer eller hyperplasi, og for å utelukke karsinom (bilde 1). Men CT angir korrekt sidelokalisering hos kun ca 60 % av tilfellene (12). For å skille APA fra BAH er binyrevenekateterisering gullstandard hos alle hvor operativ behandling er aktuelt. Binyrevenekateterisering utføres i Norge ved Oslo Universitetssykehus og Haukeland Universitetssykehus. Ved denne prosedyren føres et kateter via lysken opp i både høyre og venstre binyrevene, hvor det tas prøver til analyse av aldosteron og kortisol, samtidig med prøver fra perifer vene. Riktig kateterposisjon i binyrevene bekreftes når konsentrasjon av kortisol i binyrevenen er langt høyere enn i perifer vene. For å bedømme om det er aldosteronoverproduksjon i én eller begge binyrer sammenlignes aldosteron/kortisol-ratio fra de to sidene. Binyrevenekateterisering kan utføres med eller uten Synachten. Tolkningen og anbefalte grenseverdier, både for riktig kateterposisjon og for om det er lateralisering av aldosteronoverproduksjon, vil avhenge av om Synachten er brukt eller ikke (13).
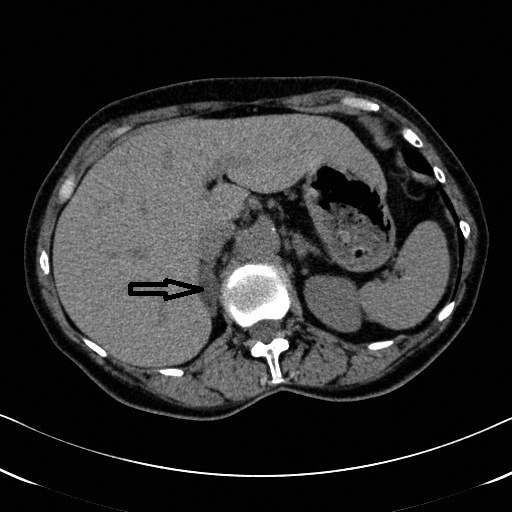
PHA-pasient med adenom 15 x 17 mm i høyre binyre (markert med pil), samt lett forstørret venstre binyre med tverrdiameter 11 mm. Binyrevenekateterisering viste lateralisering til høyre, og pasienten ble høyresidig adrenalektomert. Bilde fra professor Jarle Rørvik, Radiologisk avdeling, Haukeland Universitetssykehus. Bildet er gjengitt med tillatelse fra pasienten.
Adrenalektomi er anbefalt ved sykdom i den ene binyren (APA). Ved BAH, eller ved APA der kirurgi ikke er mulig eller ønskelig, anbefales livslang medikamentell behandling med MR-antagonistene spironolakton eller eplerenon. Spironolakton er førstevalg, med anbefalt startdose 12,5-25 mg x 1 daglig, som deretter titreres opp til laveste effektive dose. Spironolakton er en ikke-selektiv MR-antagonist som også kan blokkere androgenreseptoren og virke som progesteronagonist, og kan gi bivirkninger i form av redusert libido, gynekomasti og potensplager hos menn, og menstruasjonsforstyrrelser hos kvinner. Eplerenon er alternativ ved uakseptable bivirkninger av spironolakton, men er mindre potent. Anbefalt startdose for eplerenon er 25 mg x 2 daglig.
Både kirurgi og medisinsk behandling med MR-antagonister gir effektiv BT-reduksjon ved PHA. Etter adrenalektomi vil 20-40 % bli helt helbredet for sin HT (12, 14, 15). Prospektive studier har vist at både kirurgisk og medisinsk behandling med MR-antagonister i tillegg reduserer risiko for nye kardiovaskulære hendelser, begrenser utvikling av nyresykdom og av metabolske komplikasjoner (9, 16, 17).
PHA er den vanligste formen for sekundær hypertensjon, og langt hyppigere enn tidligere antatt. Disse pasientene har høyere risiko for kardiovaskulære, renale og metabolske komplikasjoner enn pasienter med essensiell hypertensjon. Adrenalektomi ved APA og MR-antagonister ved BAH er effektive til å redusere blodtrykk og komplikasjoner. Sykdommen er sannsynligvis underdiagnostisert, og hovedutfordringen er å tenke på muligheten for PHA hos pasienter med hypertensjon, slik at pasientene sikres effektiv behandling.