
Steinar Skrede og Bjørn Blomberg.
Bjørn Blomberg, overlege, 1.amanuenis II.
Steinar Skrede, seksjonsoverlege, 1.amanuensis II, Infeksjonsseksjonen, Medisinsk avdeling, Haukeland universitetssjukehus. Klinisk institutt 2, Universitetet i Bergen.
Alvorlig infeksjon med organdysfunksjon er svært vanlig og årsak til eller medvirkende årsak til svært mange dødsfall i sykehus. Det mest effektive behandlingstiltaket er antibiotika-behandling utført med minst mulig forsinkelse. Forekomsten av mikrober med problematisk resistens er høyere i sykehus enn utenfor, så vi støtter at aminoglykosider fremdeles inngår i det empiriske regimet for ukjent infeksjonsfokus ved sepsis oppstått utenfor sykehus.
Selv om de nye internasjonale sepsisdefinisjonene fra 2016 avgrenser sepsis til pasienter med infeksjon og organsvikt, er sepsis svært vanlig i sykehus. Man må identifisere pasienter med infeksjon der det er sannsynlig at det kan bli alvorlig forløp, eller der det allerede er inntrådt organsvikt. Det mest effektive tiltaket i behandling av alvorlige infeksjoner, er infeksjonskontroll gjennom behandling med baktericide antimikrobielle midler, og eventuelt kirurgisk sanering av infeksjonsfokuset. Antimikrobiell behandling må startes uten forsinkelse, den må dekke aktuelle mikrobe og da må infeksjonsårsaken identifiseres. Den hyppigste årsaken til sepsis er pneumoni. Den hyppigste mikroben ved bakteriemi og ved sepsis er E. coli, fulgt av Staphylococcus aureus og Klebsiella species. Forekomsten av problematisk resistens er størst blant gram-negative stavbakterier, der fluorokinolonresistens, induserbar kefalosporinresistens og ESBL-produksjon er økende problemer. Fremdeles er resistensen mot aminoglykosider, de hurtigst virkende bactericide midlene, lav. Forekomsten av infeksjoner forårsaket av mikrober med problematisk resistens er lavere ved samfunnservervet enn ved nosokomial sepsis.
Vi støtter at aminoglykosider fremdeles inngår i det empiriske regimet ved sepsis. Det er behov for vurdering av individuelle tilpasninger ved valg av antimikrobiell behandling.
I de oppdaterte definisjonene forstår man i dag sepsis som en livstruende organdysfunksjon utløst av en ubalansert vertsrespons på infeksjon. Risikoen for død ved sepsis er > 10 % og ved septisk sjokk > 40 % (1). Definisjonene er nylig endret blant annet med tanke på å gi en mer enhetlig fremstilling av epidemiologiske forhold ved sepsis. De siste årene er dødeligheten av alvorlig infeksjon i sykehus gått ned. Dette har bakgrunn i en rekke tiltak, blant annet iverksettingen av forhåndsdefinerte forløp som favner diagnostikk, behandling og oppfølging. Samtidig viser studier at det er sannsynlig at det mest effektive tiltaket er rask, målrettet behandling av alvorlig infeksjon. I det følgende går vi gjennom betraktinger om forekomst, etiologi, resistensforhold som ligger til grunn for de nasjonale behandlingsanbefalingene våre for valg av empirisk behandling i den kliniske hverdagen i avdelinger som håndterer pasienter med sepsis.
Pasienter som tidligere ble definert å ha sepsis uten organsvikt basert på tilstedeværelse av 2 av 4 SIRS-kriterier (systemisk inflammatorisk respons syndrom) blir ekskludert fra sepsis-begrepet etter de nye definisjonene fra 2016. Den gamle kategorien «alvorlig sepsis», altså sepsis med organsvikt, er identisk med det vi nå kaller ”sepsis”, mens kategorien «septisk sjokk» videreføres.
Med denne kategoriseringen synes forekomsten å ligge på rundt 1,0/1000 innbygger per år. Halvparten av tilfellene vil oppstå utenfor sykehus, resten vil være nosokomiale. Forekomsten av sepsis er større blant spedbarn enn blant barn og ungdom, før den igjen øker kraftig med økende pasientalder, slik det er vist i den eneste norske epidemiologiske studie av sepsis [1]. I en studie av mer enn 10 millioner sepsispasienter innlagt i amerikanske sykehus, utgjorde personer som var 65 år eller eldre 65 % av sepsistilfellene, noe som tilsvarer en relativ risiko på 13 sammenlignet med de som er yngre enn 65 [2]. Pasienter med sepsis har ofte underliggende sykdom (tabell 1). Hjertekarsykdom, hypertensjon, diabetes mellitus, maligne tilstander, psykiatrisk sykdom og rusmiddelmisbruk er viktige risikofaktorer for alvorlig infeksjon [2].
Data på hvilke organsvikter som dominerer varierer betydelig mellom ulike studier og hvilke omsorgsnivå pasientene behandles på [3]. Respirasjonssvikt er jevnt over den hyppigste organsvikten (rapportert fra 18 til 90 % i ulike studier). Sirkulasjonssvikt er også vanlig (7-100 %), og særlig hyppig i intensivavdelinger. Nyresvikt er også svært vanlig (15-77 %) og kanskje den hyppigste organsvikten blant sepsispasienter som behandles utenfor intensivavsnitt. Samtidig er alvorlig infeksjon den vanligste årsaken til nyresvikt, ARDS og DIC blant intensivpasienter. I en studie av sepsis i intensivavdelinger i USA og Europa ble det inkludert vel 25.000 pasienter [4]. Blant de europeiske pasientene i denne studien hadde nær 90 % utfall med sirkulasjonssvikt. Færre hadde hadde respirasjonssvikt eller nyresvikt (omtrent 40% hver), og 2/3 ble respiratorbehandlet.. Mer enn halvparten hadde svikt i to eller tre organsystemer.
Infeksjonsfokus
Selv om sepsis i henhold til nye definisjoner skal oppfattes som et syndrom med dysregulert respons på infeksjon, så er det i diagnostisk og behandlingsøyemed viktig å identifisere primærfokuset som utløser vertsreaksjonene. For pasienter med sepsis er nedre luftveier det vanligste primærfokuset (40-60 %), fulgt av intraabdominale infeksjoner (10-30 %), urinveisfokus eller bløtvevsinfeksjoner (5-10 % for hver). Primær bakteriemi, eller ”sepsis med ukjent fokus” (< 5 %), og akutt bakteriell meningitt og andre infeksjoner i sentralnervesystemet er sjeldne (< 1 %) årsaker.
De fleste pasienter som dør i sykehus dør trolig av infeksjoner. I Australia og New Zealand har man påvist stabilt nedadgående absolutt dødelighet av sepsis fra 35 til 18 % i tidsrommet 2000-2012 [5]. Til tross for rapportert fremgang er det samtidig publisert data fra USA som indikerer at sepsis er direkte eller medvirkende årsak til så mye som 37-56 % av alle dødsfall i sykehus [6]. Dødeligheten ved sepsis varierer betydelig fra moderat sykdom til septisk sjokk og multiorgansvikt. Dødelighet ved infeksjon uten organsvikt eller i fravær av SIRS-kriterier er i størrelsesorden 7-10 % [1, 5]. Ved sepsis med organsvikt var dødeligheten i den australske studien 14 %, mens den ved septisk sjokk var 22 % [5]. Dødeligheten øker betydelig med antall organer som svikter [1, 3].
Det er økt dødelighet ved høy alder og underliggende sykdom [1, 2, 5], slik det er vist i en amerikansk studie der den var 18 % hos de under 65 års alder, og 28% blant de eldre, jevnt økende med alderen [2].
Tilstander som har vist seg å øke risikoen for dødelig utgang ved sepsis inkluderer røyking, alkoholoverforbruk, kreft, diabetes, nylig gjennomgått akutt hjertesykdom, samt nylig gjennomgått operasjon eller antibiotikabehandling [7]. Infeksjonsfokus kan også ha betydning for risiko for død. Det er trolig noe lavere dødelighet ved urinveisfokus enn ved andre infeksjoner, mens ved abdominalsepsis er det dokumentert høyere behov for intensivbehandling enn ved andre infeksjoner.
Sepsis skyldes oftest bakterier, men også sopp og parasitter forekommer. Basert på en rekke epidemiologiske og behandlingsstudier kan vi regne med at etiologisk agens påvises i blodkultur hos en tredjedel av pasientene, den neste tredjedelen får påvist agens gjennom annen infeksjonsdiagnostikk, mens den forblir ukjent hos resten. I denne sammenhengen er det viktig å være klar over at man kan ha positive blodkulturer hos pasienter som har infeksjon med mindre uttalte symptomer. Generelt sett varierer forekomsten avhengig av pasientens alder. Hos nyfødte er gram-negative stavbakterier, med E.coli som den hyppigste, samt gruppe B streptokokker og Listeria monocytogenes viktige årsaker til sepsis. Hos eldre barn er pneumokokker og gule stafylokokker viktige. Blant de eldste (>65år) er gram-negative stavbakterier, gule stafylokokker, pneumokokker og streptokokker viktige årsaker til invasiv bakteriell infeksjon. Ved nosokomiale infeksjoner er stafylokokker og Enterobacteriaceae med vanskelige restistensforhold hyppigst, men også fattigforgjærende gram-negative stavbakterier, enterokokker og gjærsopp er aktuelle mikrobeårsaker.
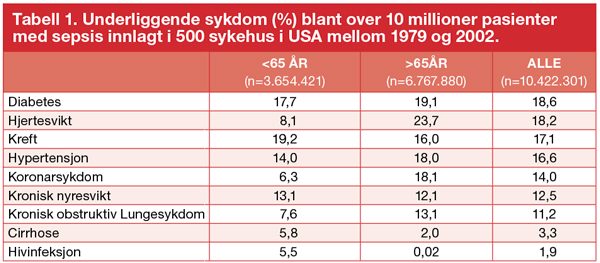
Adaptert etter Martin [4]. Forskjellen mellom aldersgruppene er statistisk signifikant med P<0.01 for alle risikofaktorene.
MSIS, Folkehelseinstituttet
Folkehelseinstituttet (FHI) registrerer og publiserer oppdatert informasjon om insidensrater for en rekke invasive infeksjoner basert på Meldingssystem for smittsomme sykdommer (MSIS) og Nasjonal laboratorieovervåking av et antall spesifikke bakterier [8]. Fordelen med MSIS-baserte data er at de viser forekomst av kliniske sykdomsbilder for viktige enkeltmikrober som pneumokokker, meningokokker og gruppe A streptokokker. En begrensning er at det meldes med utgangspunkt i mikrobefunn. Meldingene er ikke syndromspesifikke, så data for etiologi ved all «akutt bakteriell meningitt» eller «nekrotiserende fasciitt» foreligger ikke. Kvaliteten på MSIS-data avhenger også i betydelig grad av at det støttes opp om meldesystemet. Eksempler på nyttige data er at det har vært en halvering av antallet systemiske pneumokokkinfeksjoner det siste tiåret. Reduksjonen er særlig tydelig blant småbarn etter introduksjon av pneumokokkvaksine i barnevaksineprogrammet, men det er også reduksjon blant eldre over 65 år, selv om forekomsten fremdeles er høy i denne gruppen (38/100.000 per år). Videre svinger insidensen av invasiv gruppe A streptokokksykdom rundt 3/100.000 innbygger per år, mens fallet i forekomst av invasiv meningokokksykdom fortsetter og er i 2014 ned på 3,5/million innbygger per år (9).
NORM-VET (UNN/Veterinærinstituttet/Folkehelseinstituttet)
Den årlige NORM-rapporten utarbeides ved Universitetssykehuset i Nord-Norge i et samarbeid med en rekke nasjonale institusjoner. Denne rapporten gir en oversikt over forhold vedrørende antibiotikaresistens for blodkulturisolater fra pasienter i norske sykehus [9]. NORM er et godt system for resistensovervåking, men beskriver ikke alle sider av de epidemiologiske forholdene ved sepsis. Blant forbehold ved tolkning av forekomst ved bruk av NORM-data er at det ikke skilles mellom blodkulturer fra pasienter med og uten sepsis. Det skilles heller ikke mellom samfunnservervete og sykehusoppståtte infeksjoner. Innsamlingsmetodikken tar ikke utgangspunkt i å beregne forekomster av spesifikke agens eller tilstander. Ikke desto mindre oppleves mange data som relevante når det gjelder forekomst. For organismer som inngår i blodkulturer i NORM, er E. coli hyppigst med omlag 32 % av isolater, når man ekskluderer normalflora. Dernest følger Staphylococcus aureus (14 %), streptokokker gruppe A/B/C/G (11 %), Klebsiella spp. (9 %), enterokokker (7 %), pneumokokker (<5 %) og candida (<2 %).
Lokale data
En annen viktig kilde til oversikt over forekomsten av invasive infeksjoner er lokale data. Ved vårt sykehus tilbyr Mikrobiologisk avdeling oversiktlig fremstilling av hvilke mikrober som er funnet i blodkulturer (Figur 1) og data for forekomst av resistens (se egen artikkelen om Mikrobiologi i dette nummeret).
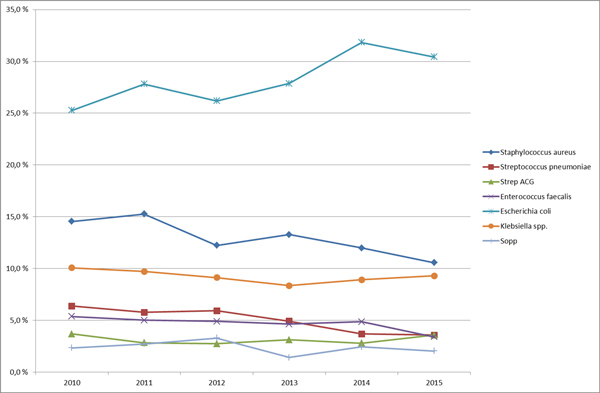
Figur 1: Oversikt over hyppigste mikrober i blodkulturer ved Haukeland Universitetssykehus for perioden 2010-2014. Gjengitt med tillatelse av Avd for Mikrobiologi og Immunologi. http://www.helse-bergen.no/no/OmOss/ Avdelinger/mikrobiologisk/Sider/Resistens.aspx
I tillegg kan lokal forskning bidra med epidemiologiske data. I vårt sykehus har det eksempelvis blitt påvist at forekomsten lokalt av invasiv sykdom forårsaket av gruppe A streptokokker (GAS) varierer fra år til år, uten at det er noen stor endring over tid, samtidig som forekomsten av gruppe G og C streptokokker har økt statistisk signifikant de siste årene og nå passert den for GAS [10]. Likeledes har vi i en lokal, prospektiv studie beskrevet mikrobiologiske årsaker til sepsis og septisk sjokk oppstått utenfor sykehus hos voksne gjennom hele 2008 [11]. De hyppigste mikrobene vi fant var E. coli, pneumokokker og Staphylococcus aureus.
Det viktigste funnet i NORM-rapportene de siste årene er påvisningen av økende forekomst nasjonalt av omfattende antibiotikaresistens i gram-negative stavbakterier [9]. Om lag halvparten av alle bakteriemier er forårsaket av gram-negative stavbakterier. E. coli utgjør om lag halvparten av disse, mens Klebsiella står for omlag 15 %. ESBL (Extended spectrum betalactamase) er resistensmekanismer som bryter ned betalaktamantibiotika som penicilliner og kefalosporiner. ESBL-resistens er ofte koblet til multiresistens mot flere andre aktuelle midler, og resistens mot multiple antibiotika kan spres raskt, først og fremst ved plasmidmediert overføring. I følge NORM-data for 2015 har 6.5 % av blodkulturisolater av E. coli resistens av ESBL-type, mens 2.9 % av Klebsiella pneumoniae har ESBL. Dessverre har økningen i ESBL-resistens vært størst ved de alvorligste sykdommer der mikroben er isolert fra blodkultur (se figur 2) [9], men det skilles ikke mellom infeksjoner oppstått utenfor eller inne i sykehus i oversikten. Resistens mot gentamicin, en hjørnestein i sepsisbehandling, er nå 6.4% i E. coli og 2.8% i klebsiella, noe som er marginalt lavere forekomsten av ESBL resistens. Fluorkinolonresistens har økt betydelig det siste tiåret i takt med bruken av midlene, og 11,9 % av E. coli isolater i blodkultur er motstandsdyktige mot ciprofloksasin [9].
Bruk av bredspektret antibiotika som fluorkinoloner og kefalosporiner gir et antibiotikapress som favoriserer fremvekst av bakterier med ESBL-resistens. Siste årene er det påvist gram-negative mikrober med ESBL-type resistens som nøytraliserer karbapenemer, våre mest bredspektrete midler mot Gram-negative mikrober. I 2014 var det mer enn 30 tilfeller av karbapenmaser presentert i NORM-rapporten, stort sett ved import fra utlandet [9]. Dette er en særlig problematisk utvikling, ettersom karbapenemer tilhører siste skanse i behandlingen av gram-negative infeksjoner. Ved infeksjoner forårsaket av karbapenemeaseproduserende Klebsiella pneumoniae (KPC-KP), kan siste utvei være bruk av polymyxiner som colistin, tigecyclin, fosfomycin, aminoglykosid, eller kombinasjoner av karbapenemene doripenem og ertapenem [12].
Mens S. aureus er blant de viktigste årsakene til bakteriemi i Norge, er det svært lav forekomst av invasiv sykdom med meticillinresistente Staphylococcus aureus (MRSA). I Norge er 99,3 % av blodkulturisolater følsomme for kloksacillin [9]. Invasiv sykdom med pneumokokker er i tilbakegang, men nå har cirka 5 % av isolatene nedsatt følsomhet eller resistens for penicillin, noe som kan være av betydning for effekten av antibiotikabehandling hos et mindretall [8].
Det pågår lavgradige utbrudd i institusjoner av vancomycinresistente Enterococcus faecium (VRE) i Norge, men forekomsten av vancomycinresistens er under 0,3 % ved invasiv enterokokksykdom. Beta-hemolytiske streptokokker er naturlig penicillinfølsomme. Forekomsten av resistens mot klindamycin og makrolider er lav. Noen viridansstreptokokker er mindre følsomme for penicillin. Klinisk er dette noe som må med i betraktning i valg av behandling og evaluering av effekt ved særlig akutt infeksiøs endokarditt. Selv om invasiv meningokokksykdom er blitt sjelden, skal man være oppmerksom på at i dag påvises nedsatt følsomhet for penicillin i flesteparten av isolatene (70 %). Candida albicans, den vanligste soppen som gir blodbaneinfeksjon, er følsom for flukonazol i 99,3 % av tilfellene.
For pasienter som nylig er kommet fra utlandet, særlig dersom de har vært innlagt på sykehus utenfor Norden, er det viktig å tenke gjennom mulighetene for infeksjon med resistente mikrober og vurdere å gi antibiotika med bredere dekning.
Nasjonale data er viktige, men det er sterkt ønskelig at alle sykehus har oversikter over sine lokale resistensforhold. På samme måte som vi mottar data over hvilke mikrober som påvises, tilbyr Mikrobiologisk avdeling ved HUS oversikt over forekomst av resistensforhold. Et relevant eksempel er at i E. coli er forekomsten av resistens mot gentamicin lokalt 6,8 % i 2015. Lokale resistensforhold er viktige av flere årsaker. De er av betydning for tilpasninger til terapianbefalinger. Slike oversikter vil også fange opp endringer ved det enkelte sykehus mye raskere enn f.eks. NORM-rapporten. Til sist kan det være et verktøy til å skille infeksjoner oppstått utenfor sykehus fra nosokomiale infeksjoner, en problemstilling vår mikrobiologiske avdeling ser nærmere på nå.
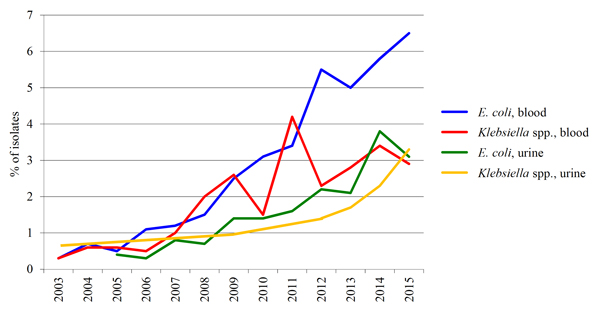
Figur 2. Forekomst av resistens av typen ESBL (extended spectrum beta-lactamase) i norske blodkulturisolater 2003-2015. Tillatelse er gitt fra Overlege Gunnar Skov Simonsen, leder for Norsk overvåkingssystem for antibiotikaresistens hos mikrober (NORM). [www.antibiotikaresistens.no].
Rask start av antibiotika-behandling ved sepsis
Flere studier viser at rask behandling med antibiotika ved sepsis kan redde liv, slik det for eksempel er vist i en retrospektiv studie fra databasen i Surviving Sepsis Campaign. Blant 28.000 pasienter med sepsis med organsvikt(er) og septisk sjokk ble det påvist en signifikant økning i dødelighet ved forsinket oppstart av antibiotikabehandling fra første time [13]. Subgruppen sepsis med hypotensjon og sjokk (n=2700) hadde økt dødelighet med anslagsvis 7 % for hver times forsinkelse i antibiotikabehandling [14]. Dette er også bakgrunnen for at det er viktig med oppstart av antibiotika raskt etter at blodkulturer er tatt .
Bakteriedrepende effekt
Ved oppstart av antibiotikabehandling må man vurdere antibiotikas forventete effekt mot aktuelle mikrober, resistensforhold, bivirkningsprofil, vevsdistribusjon/biotilgjengelighet, og samtidig ha økologiske ringvirkninger in mente. Først og fremst må man velge antibiotika med hurtig bakterie-
drepende effekt, som aminoglykosider. Fluorkinoloner er også bactricide, og et alternativt valg. Penicillinene og andre betalaktamantibiotika gir tidsavhengig bakteriedrap og er noe mindre hurtig-virkende. Langsomtvirkende ”bakteristatiske” antibiotika som linezolid, makrolider (erytromycin) og tetracycliner har liten plass i behandling av sepsis. Unntaket her er bruk av tetracycliner ved rickettsioser som kan presentere som sepsis hos pasienter som har vært i endemiske områder.
Riktig dosering
Like viktig som å velge riktige antibiotika, er å gi korrekte doser med rette intervaller. Beta-laktamantibiotika skal doseres hyppig nok, fordi effekten avhenger av tid over minste inhibitoriske konsentrasjon (MIC) i blodet. Penicilliner for eksempel, skal doseres 4 ganger i døgnet, gjerne 6 ganger. Noen steder bruker man kontinuerlig infusjon med samme argumentasjon. En studie av S. aureus bakteriemi fra København viste at for lave doser av dikloksacillin (<4 gram daglig) resulterte i dobbelt så høy dødelighet (28 vs 14%) selv om stafylokokkene var følsomme for midlet [15]. Aminoglykosider er eksempel på antibiotika med høy postantibiotisk effekt, der man vil få størst nytte av behandlingen med høye toppkonsentrasjoner og mindre bivirkninger ved sjeldnere doseringer. Aminoglykosider som gentamicin doseres derfor 1 gang daglig og justeres etter serum-konsentrasjonsmålinger.
Sammenheng mellom infeksjonsfokus, klinisk bilde og mikrober
For å sikre seg at valgte antibiotika har et virkningsspektrum som dekker mest sannsynlige mikrober, må man vite både hvilke mikrober som er mest sannsynlige og samtidig kjenne til sannsynlig resistensforhold for aktuelle mikrober.
Sepsispasientens sjanse for å overleve øker om man klarer å påvise infeksjonsfokus så tidlig som mulig i forløpet [11]:
Ved fokus i nedre luftveier er pneumokokker viktigste agens å dekke. Ved bløtvevsfokus er penicillinfølsomme beta-hemolytiske streptokokker hyppigste årsak, mens gule stafylokokker mistenkes ved pussdannelse, anaerober ved gassgrangren og gram-negative stavbakterier ved nærhet til perineum. Ved urinveisfokus bør man ta høyde for E. coli og tidvis enterokokker, mens man ved intraabdominale infeksjoner i tillegg bør sikre dekning for anaerober og vurdere soppbehandling. Videre må antibiotika styres etter om infeksjonen er oppstått utenfor eller i sykehus (tabell 3).
Noen pasienter har infeksjoner med mer resistente mikrober. Pasienter som kommer fra sykehus utenfor Norden kan ha behov for mer bredspektret behandling. Fordi det er økt reiseaktivitet til områder der risikoen for kolonisering med ESBL-produserende mikrober er reell, kan det komme behov for å definere særlige empiriske regimer for pasienter med sepsis etter hjemkomst fra slike områder.
Sepsis innebærer et stort spekter av alvorlighetsgrader, og dette bør ha innflytelse på antibiotikavalg. Ved alvorlig sepsis med sjokk og svikt i flere organer er det svært viktig å treffe riktig med første antibiotikavalg, og dette forsvarer valg av mer bredspektrete regimer, slik det er vanlig i intensivavdelinger. De sykeste pasientene er også relativt sjeldnere og vil i antall ikke utgjøre en stor økologisk trussel med tanke på seleksjon av resistente mikrober. Samtidig vil mange pasienter, selv i tråd med nye definisjoner, ha mindre systemisk påvirkning. For denne store gruppen er det ved samfunnservervet sepsis hensiktsmessig å velge antibiotika avhengig av organfokus, slik det rådes til i Den nasjonale retningslinjen vår [19].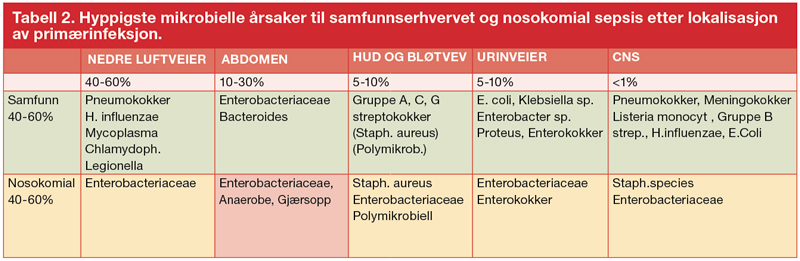
Empirisk behandlingsregime
I Norge er det tradisjon å behandle sepsis empirisk med penicilliner kombinert med et aminoglykosid, som gentamicin. Begrunnelsen er at dette er hurtigvirkende, baktericide antibiotika som med stor sannsynlighet dekker de mest aktuelle mikrobene. Utenfor Norden er det større problemer med multiresistente bakterier og tradisjon for hyppigere bruk av bredspektrete beta-laktamantibiotika, som kefalosporiner eller karbapenemer. Ved mindre alvorlige infeksjoner vil overdreven bruk av bredspektrete midler ha uheldig økologisk påvirkning. Vi støtter tradisjonell norsk valg av empirisk sepsisbehandling med et penicillin i kombinasjon av aminoglykosid, som i liten grad påvirker tarmflora.
Forekomsten av aminoglykosidresistens er betydelig mindre enn ciprofloksacinresistens, og også marginalt lavere enn ESBL-resistens. I tillegg er det økende forekomst av kefalosporinaser som induseres under behandlingen og fører til terapisvikt. I praksis er det derfor ved gram-negativ sepsis sannsynligvis større fare for terapisvikt ved behandling med kefalosporiner eller ciprofloxacin enn med aminoglykosider. Karbapenemer (meropenem m.fl) er effektive mot ESBL-produserende gram-negative stavbakterier, men overdreven karbapenembruk har enda større økologiske implikasjoner.
En internasjonal meta-analyse [16] konkluderte med at bredspektrede beta-laktamer bør foretrekkes foran kombinasjon med aminoglykosid på grunn av sistnevntes nyretoksisitet. Studiene som er inkludert i meta-analysen har store svakheter. Kun et fåtall av artiklene har metodikk til å vurdere sammenheng mellom styrt behandling og behandlingsutfall. Artikkelen problematiserer ikke potensielle økologiske bivirkninger av bredspektret behandling. Selv om analysen kom noe tilbake i tid, er det av betydning at forfatterne påpeker at konklusjonen ikke nødvendigvis er gyldig for områder som Skandinavia, der det er gunstigere resistensforhold. Det har vært uenighet i landet om hvorvidt det tradisjonelle empiriske regimet med et penicillin pluss aminoglykosid burde vike. Bekymringen for nyresvikt og annen organsvikt ved bruk av aminoglykosider har i denne sammenhengen vært fremhevet som større enn resistensproblemene og faren for ikke å dekke aktuelle mikrober.
Aminoglykosider er nefrotoksiske. Vi er enige i at bredspektret beta-laktamer kan være et fornuftig valg ved etablert nyresvikt eller annen kontraindikasjon mot aminoglykosider. Når det gjelder pasienter uten preeksisterende kontraindikasjon mot aminoglykosider, mener vi at tradisjonelt norsk penicillin-og aminoglykosidregime fremdeles er å foretrekke.
Hovedårsaken til akutt nyresvikt hos sepsispasienter er vanligvis ukontrollert infeksjon og ikke medikamentell bivirkning. Aminoglykosidene er svært potente blodbanemidler som hurtig dreper bakteriene og kan bidra til å få pasienten raskt ”over kneiken”, slik at man kan unngå nyresvikt på grunn av ukontrollert sepsis med hypotensjon. Flere autoriteter, inkludert den svenske legeforeningen, anbefaler aminoglykosider spesifikt ved septisk sjokk [17]. Erfaring fra Haukeland sykehus tyder på at vår seleksjon av sepsispasienter som får aminoglykosidbasert behandling er trygg for pasienten og ikke medfører nyresvikt [11, 18]. Risiko for bivirkninger øker med lengden på behandlingen. Man må justere doser etter serumspeil, og vurdere fortløpende om aminoglykosidet kan seponeres etter som pasienten blir bedre. Når mikrobe er identifisert og resistensbestemt, kan man vurdere om det er mulig å snevre inn behandlingen.
De anbefalte antibiotikaregimer for sepsis i henhold til Den nasjonale retningslinjen (tabell 4) er basert på ovenstående vurderinger og har penicillin-gentamicin-kombinasjon som empirisk førstevalg [19]. For tiden gjennomgår en bredt sammensatt gruppe disse behandlingsanbefalingene ved sepsis, slik at ny versjon kan ventes i dette året.
Den globale økningen av antibiotikaresistente sykdomsframkallende bakterier true med å gjøre våre viktigste antibiotika uvirksomme. Behandling av sepsis med antibiotika som mikroben ikke er følsom for, medfører stor risiko for dødelig utgang [20]. Foreløpig er Norge og de andre nordiske landene mindre rammet av antibiotikaresistens enn resten av verden, sannsynligvis delvis på grunn av vår tradisjon med restriktiv antibiotikapolitikk med fokus på bruk av smalspektrete antibioitka med minimal økologisk påvirkning. Likevel har totalforbruket i Norge økt frem til 2012, og nasjonal handlingsplan har målsetning om at det nasjonale totalforbruket skal ned 30 % frem til 2020. Det er et paradoks i sepsisbehandlingen at det å gi kombinasjoner av bredspektrete antibiotika, som dekker nær sagt alle tenkelige mikrober, på sikt vil bidra til å fremelske resistente mikrober, som i neste omgang kan gjøre det vanskelig eller umulig å behandle infeksjoner i fremtiden. I tillegg til å behandle enkeltindividet må vi forvalte bruken av antibiotika med et langsiktig samfunnsperspektiv.
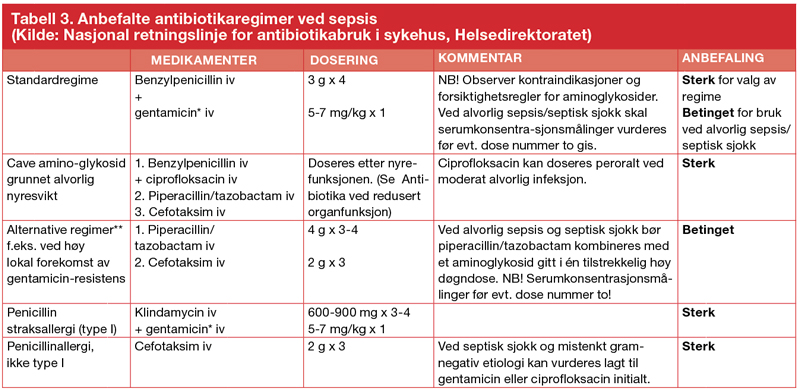
* Se Antibiotika konsentrasjonsmålinger for medikamentmonitorering. Tobramycin foretrekkes ved mistanke om Pseudomonas spp. ** Ved høy lokal forekomst av ESBL-produserende Enterobacteriaceae bør et karbapenem (monoterapi) vurderes i det empiriske primærregimet.
Grundig klinisk undersøkelse kan avsløre et infeksjonsfokus eller en infeksjonskilde som kan fjernes. Rask fjerning av infeksjonskilden kan gjøre at man får kontroll over infeksjonen og kan bety forskjell på liv og død. Kildekontroll kan være så enkelt som å fjerne et infisert inneliggende fremmedlegeme som et kateter eller en sentralvenøs linje som er blitt infisert. Kilden kan også være en alvorlig bløtvevsinfeksjon, en abscess eller en infeksjon som trenger øyeblikkelig kirurgisk behandling. I mange studier påvises ugunstig forløp ved forsinket kildekontroll ved alvorlige tilstander, slik som ved nekrotiserende fasciitt [21].
Sepsis er en vanlig medisinsk hastetilstand som alle klinikere må kunne håndtere. Sepsis og septisk sjokk har høy dødelighet. Forsinkelser i behandlingen øker risikoen for dødelig utgang. Grundig klinisk undersøkelse med påvisning av infeksjonsfokus øker sjansen for korrekt behandling og at pasienten overlever. Selv om problemet med antibiotikaresistens har moderat omfang i Skandinavia, er det en urovekkende utvikling siste årene særlig med multiresistente gram-negative stavbakterier. Begrensninger i bruk av bredspektrete antibiotika kan bremse resistensutviklingen. Empirisk bruk av smalspektret penicillin i kombinasjon med aminoglykosid er økologisk gunstigere og per i dag en effektiv behandling i de fleste samfunnservervete tilfellene.
Referanser