Knut E. A. Lundin. Overlege, professor dr. med. Seksjon for Gastromedisin, Avdeling for Transplantasjonsmedisin, Oslo Universitetssykehus Rikshospitalet. Institutt for Klinisk medisin, Det Medisinske Fakultet, Universitetet i Oslo.
Guro Løvik Goll. Overlege, dr.med. Revmatologisk avdeling, Diakonhjemmet sykehus
Såkalt biologisk behandling baserer seg oftest på monoklonale antistoffer som målrettet kan blokkere uhensiktsmessig immunaktivering. Denne type behandling har fått en viktig plass innen gastroenterologi og revmatologi men også flere andre kliniske spesialiteter. Vi diskuterer her nåværende og kommende typer behandling.
Felles for mange sykdommer innen feltene gastroenterologi og revmatologi er at betennelsesprosesser står sentralt. Dette gjelder spesielt viktige sykdommer som ulcerøs kolitt og Crohn’s sykdom samt Revmatoid artritt. Disse tilstandene er vanlige, ofte alvorlige, og har de siste årene opplevd nærmest en revolusjon innen spesifikk behandling. Vi kan i dag, med aktiv medisinering, i mange tilfeller oppnå både symptomfrihet og full tilheling av det syke organet. Denne utviklingen har vært mulig med medikamenter som spesifikt retter seg mot enkelte aspekter av betennelsesprosessen. Noen av medikamentene virker både mot gastroenterologiske og revmatologiske sykdommer, andre kun innen et av områdene.
Köhler og Milstein beskrev i 1975 hvordan man kunne fusjonere en myelomcellelinje med antistoffproduserende celler fra en immunisert mus [1]. Dette la grunnlaget for muligheten til å produsere såkalte monoklonale antistoffer og ble belønnet med Nobelprisen i medisin i 1984. En rivende teknisk utvikling har siden gitt muligheten for å produsere monoklonale antistoffer til terapeutisk bruk innen humanmedisin for store markeder. Felles for de fleste er at de opprinnelige aminosyre-sekvensene fra musene som ble brukt, er erstattet av humane sekvenser [2]. Det finnes også monoklonale antistoffer som er basert på humane sekvenser funnet i B-celle biblioteker. Det er videre produsert reseptor-fusjonsproteiner. Medikamentene er som forventet dyre, og to av de mest brukte medikamentene, anti-Tumor Nekrose Faktor antistoffene infliximab (solgt som Remicade®) og adalimumab (solgt som Humira®), har i en årrekke omsatt for ca 10 milliarder USD.
De siste to årene har vi sett en betydelig prisnedgang etter at de såkalte ”biotilsvarende” medikamentene har kommet på markedet. Dette er ikke ”kopipreparater” slik vi kjenner for generiske små molekyler, men de er så like at de sannsynligvis er terapeutisk ekvivalente. Dette er blitt studert i en nylig avsluttet, men ikke publisert, studie fra Norge (NOR-SWITCH) [3].
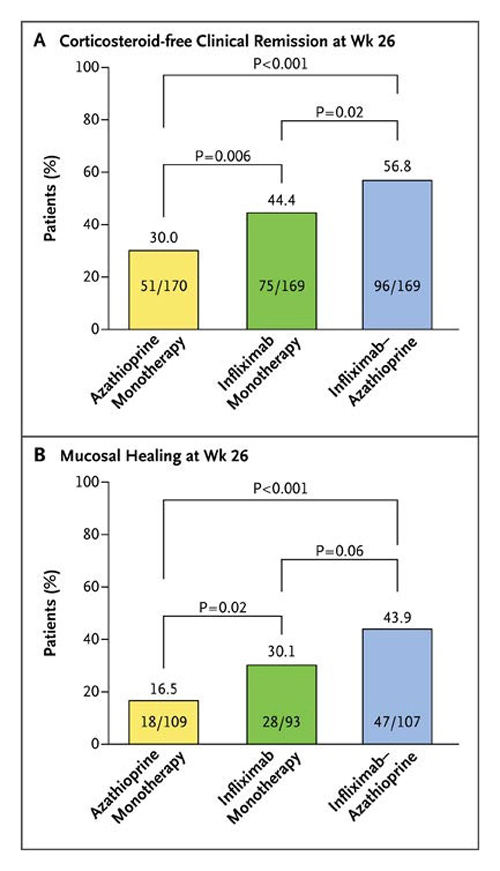
Figur 1. Respons på henholdsvis azathioprin, infliximab og kombinasjonen av disse hos pasienter med Crohns sykdom, og som ikke tidligere hatt fått disse medikamentene. (Gjengitt fra Columbel et al, NEJM, (ref. 6) med tillatelse.)
Gastroenterologi
Ulcerøs kolitt og Crohn’s sykdom betegnes ofte felles inflammatorisk tarmsykdom (engelsk: inflammatory bowel disease (IBD)). Årsaken til sykdommene er ukjent, men sentralt i prosessen finner man en uhensiktsmessig immunreaksjon mot tarmens egne bakterier. Sykdommene er ikke akkurat arvelige, men har en betydelig genetisk komponent. Det er funnet nesten 200 gener som er involvert, de fleste av dem styrer immunsystemet [4]. Det betyr imidlertid også at hvert enkelt gen har liten innvirkning. Hos den enkelte pasient finner man alt fra helt lette og forbigående tilfeller på den ene side, til svært aggressive sykdomsbilder på den annen side [5].
Behandlingen retter seg mot betennelsen. 5-ASA preparater som Asacol®, Pentasa® og en rekke andre danner basis for behandlingen (gjerne lokalt med stikkpiller eller klyster) av ulcerøs kolitt, men er mindre aktuelle ved Crohn’s sykdom. Prednisolon er ofte effektivt men bør unngås som langtidsbehandling på grunn av bivirkninger, ikke minst osteoporose. Lokalt virkende steroider som budesonid (Entocort® eller Cortiment®) omgår langt på vei dette.
Hos IBD-pasienter som er ”steroid-avhengige” eller har dårlig respons, eller som i utgangspunktet har alvorlig sykdom, er det naturlig å gå rett på såkalt sykdomsmodifiserende medi-kamenter som immunmodulatorer som azathioprin (Imurel®) eller methotrexat, eller til biologisk behandling med anti-TNF antistoffer [6]. Dette ble belyst i den såkalte SONIC studien (Figur 1). Det er som oftest riktig å kombinere disse medikamentene på grunn av immunogenisitets-problemer, dette omtales nedenfor.
Vi har tre anti-TNF antistoffer som er godkjent for IBD. Infliximab og adalimumab er godkjent for begge sykdommene, mens golimumab (Simponi®) kun er godkjent for ulcerøs kolitt. Infliximab gis intravenøst hver 8. uke, de andre to hyppigere subcutant. Det finnes knapt sammenlignende data på effekt, men i klinisk praksis gis som oftest infliximab i solide doser ved kraftig, akutt sykdom. Effekten av medisinene er god til svært god – avhengig av sykdomsaktivitet og sykdomsmekanisme. Men vi kjenner lite til hvilke personspesifikke faktorer som gjør at den enkelte pasient responderer eller ikke responderer på anti-TNF behandling. Effekt bedømmes klinisk, endoskopisk, biokjemisk og med avføringstester på betennelsesmarkøren calprotektin. Ved god effekt vil de fleste klinikere gi kontinuerlig behandling, i hvert fall ved Crohn’s sykdom, hvis man stopper med medisinene er det betydelig sjanse for tilbakefall. Vi ser lite bivirkninger av medikamentene så lenge pasientene screenes adekvat for tuberkulosesmitte før behandling. Anti-TNF er kontraindisert ved malign sykdom og grad IV hjertesvikt.
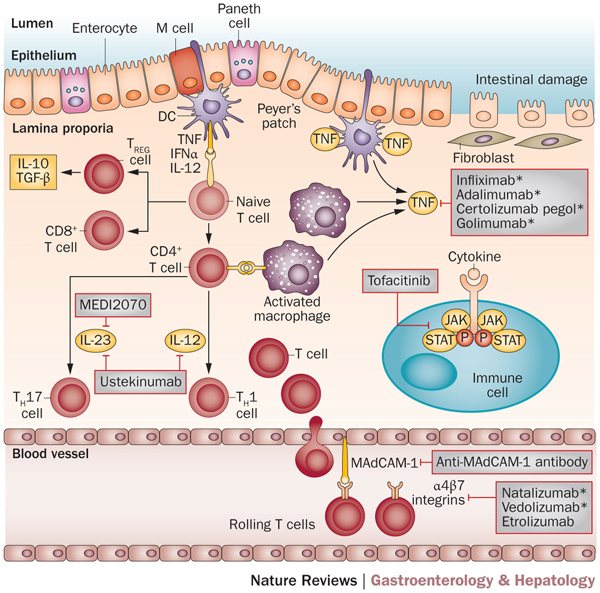
Figur 2. Illustrasjon av immunpatogenese ved IBD og aktuelle angrepspunkter for målrettet, biolgoisk behandling. (Figur fra referanse 8, trykkes med tillatelse.)
Hos pasienter som ikke har respons på anti-TNF eller der slike ikke kan brukes, utvikles det en rekke nye alternativer (figur 2)[7, 8]. Et nytt medikament er vedolizumab (Entyvio®), et monoklonalt antistoff mot en overflatemarkør på T-lymfocytter. Denne markøren har betegnelsen α4β7, denne binder seg til Madcam-1 og gjør at sirkulerende T-lymfocytter kan finne frem fra blodbanen til tarmen. Dermed hemmes rekruttering av nye T-lymfocytter til det inflammerte området, og betennelsen reduseres. Både dokumentasjon for stoffet og den kliniske erfaring tilsier at effekten av vedolizumab er langsommere enn av anti-TNF hemmerne. Et lignende stoff (natalizumab, Tysabri®) brukes for øvrig innen behandling av multippel sklerose, men da med spesifisitet for integrinet α4, det hemmer trafikk av T-lymfocytter både til sentralnervesystemet og gastrointestinaltraktus.
Det er flere andre som sannsynlig kommer på markedet [7]. Et monoklonalt antistoff mot Interleukin-12/23 (ustekinumab, selges som Stelara®) er godkjent for bruk mot psoriasis, men har også effekt ved IBD. Noen dato for eventuell godkjenning er ikke kjent. Et annet medikament, et antistoff mot Interleukin-17 (secu-kinumab, selges som Cosentyx®) har frapperende effekt mot psoriasis, men virker ikke mot Crohn’s. Dette betyr at hvert enkelt medikament må testes ut for hver sykdom. Det er for øvrig flere andre biologiske preparater som på papiret og i laboratorier så ut til å være aktuelle, men som sviktet i kliniske forsøk.
Det er opplagte ulemper med biologiske medikamenter. De må tas som injeksjon eller infusjon. Utvikling av intoleranse er et betydelig problem med de aller fleste. Utvikling av nye, effektive medikamenter bygget av små molekyler er derfor velkomment. Et eksempel er mongersen, et anti-sense genfragment som effektivt blokkerer Smad7 [9]. Dette er et protein som blokkerer TGFβ, et cytokin med sterkt antiinflammatorisk effekt. I tarmen hos IBD-pasienter er det mye TGFβ, men det er ikke aktivt før Smad7, som også er oppregulert, blir tatt ned. Andre eksempler er hemmere av Janus kinaser (JAK), som for eksempel tofacinitib som er aktivt ved revmatoid artritt, men som også er aktivt ved IBD [10].
Som ved IBD har det revmatologiske fagfeltet blitt totalt forandret de siste 20 årene, med langt bedre behandlings-resultater for mange pasienter med inflammatoriske revmatiske sykdommer. Dette gjelder spesielt leddsykdommene og skyldes bl.a. at nye medikamenter er tatt i bruk. De vanligst forekommende inflammatoriske revmatiske sykdommene er revmatoid artritt (RA), spondyloartritt og psoriasisartritt. Ankyloserende spondylitt ble tidligere ofte kalt Morbus Bekterev og inngår som en viktig undergruppe av spondyloartrittene. Også enteroassosiert artrittsykdom, slik vi ser hos noen IBD-pasienter, regnes blant spondyloartrittene.
Revmatoid artritt
Av disse revmatiske sykdommene er årsaksforholdene ved RA best studert, men noen klar forståelse av sykdommens opprinnelse og utvikling har vi fortsatt ikke. Det skilles mellom seropositiv og seronegativ RA. Ved seropositiv RA påvises det enten revmafaktor eller anti-citrullin antistoffer (anti-CCP) hos pasienten. Revmafaktor er relativt uspesifikk for RA, dette er anti-IgG antistoffer. Anti-citrullin antistoffer er mer RA-spesifikke og rettet mot citrullinerte proteiner. Citrullinering er et eksempel på såkalt post-translasjonell modifisering av egne proteiner. Når kroppsegne proteiner endres på en slik måte, kan det hos noen gjøre at immun-systemet oppfatter det endrede proteinet som fremmed og farlig. Det vil igjen utløse en immunrespons mot proteinet. Vi vet at en bestemt gruppe gener – HLA-gener kalt Shared Epitope – disponerer for å utvikle seropositiv RA. Vi vet også at sigarett-røyking er en vesentlig risikofaktor for å danne anti-citrullin antistoffer og for å utvikle seropositiv RA, særlig hvis røykeren er Shared Epitope positiv [11]. Slik ser vi nå en sammenheng mellom miljøfaktorer, gener og immunologiske prosesser som var ukjente før. Det har også vært stor interesse for de prosessene som kan føre til citrullinering av kroppens egne proteiner, f eks visse tannkjøttsykdommer. Det er tenkelig at en lokal immunrespons rettet mot slike citrullinerte proteiner er starten på en immunaktivering som etter hvert utvikler seg til RA [12].
Alle de legemidlene vi benytter for å behandle leddbetennelsene ved RA har som mål å dempe immun-aktivering – enten det er syntetiske legemidler som methotrexat (fortsatt førstevalget for behandling ) eller biologiske legemidler. Et hovedmål ved behandlingen er å forhindre varig leddskade hos pasienten. Medikamenter som evner å hindre slik leddskade kalles DMARDs (Disease-modifying anti-rheumatic drugs) og deles i de konvensjonelle, syntetiske DMARDs og de biologiske DMARDs.
Mange RA-pasienter oppnår gode behandlingsresultater med methorexat-behandling alene. Noen har allikevel en sykdom som ikke lar seg behandle godt nok ved konvensjonelle DMARDs. Ved RA har vi da en lang rekke biologiske midler tilgjengelig. Disse benyttes som regel i kombinasjon med enten methotrexat eller andre syntetiske DMARDs som salazopyrin. Dette er dels for å oppnå bedre effekt, dels for å forhindre immunogenisitet og tap av effekt.
TNF-hemmerne nevnt under gastroenterologiske indikasjoner brukes også ved RA. I tillegg benyttes den løselige TNF-reseptoren Etanercept (selges som Enbrel® og som biotilsvarende Benepali®) og det PEGylerte Fab-fragmentet certolizumab Pegol (Cimzia®).
Foruten disse TNF-hemmerne har også IL-6 hemmeren Tocilizumab (RoActemra®) indikasjon RA. Likeledes benyttes T-celle hemmeren abatacept (Orencia®). Rituximab (mabThera®) er kjent for noen fra onkologien, og er et antistoff rettet mot CD20 på B-celler. Ved MabThera-infusjon vil B-cellene depleteres fra pasientens sirku-lasjon og pasientens RA bedres.
Spondyloartritt og psoriasisartritt
Selv om de immunologiske mekanismene ved spondyloartritt og psoriasisartritt er mindre godt karakterisert, vil mange pasienter med disse sykdommene respondere på biologisk behandling. Også her er TNF-hemmerne relativt ofte benyttet. Vi har helt nylig fått tilgang til IL-17 hemmeren cosentyx som har indikasjon ankyloserende spondylitt og psoriasisartritt.
Ved spondyloartritter skiller vi mellom aksial affeksjon, hvor ryggsøylen er inflammert, og perifer affeksjon, hvor ledd utenom ryggsøylen er angrepet. Ved aksial affeksjon er ikke-medikamentelle tiltak som fysioterapi og egentrening meget viktig. NSAIDs har også en sentral plass i behandlingen for pasientene i denne gruppen, forutsatt at de tåler slike medikamenter. Ved aksial affeksjon har methotrexat ingen effekt.
Hjerte- og karsykdom
De siste årene har det vært sterkt økende oppmerksomhet rundt utvikling av hjerte- og karsykdom hos revmatikere. Denne pasientgruppen synes å ha en betydelig øket risiko for kardiovaskulær sykdom [13]. Igjen er RA-gruppen best studert. Risikoen for slike sykdommer synes å være knyttet til sykdomsaktivitet. Også i denne sammenheng har betydningen av røykekutt for revmatikere fått et sterkt fokus.
Tidlig diagnose og behandling
Mer enn noen gang før er det revma-tologiske fagmiljøet fokusert på å stille diagnose tidlig og å starte opp med sykdomsmodifiserende behandling tidlig, for å hindre leddskade og komorbiditeter. De pasientene som i særlig grad er aktuelle for aggressiv behandling inkludert biologiske legemidler, er de som tidlig utvikler leddskade, har høye nivåer av anti-CCP i blodet og får sykdommen i ung alder. Ikke bare er medikamentvalg viktig: målstyrt behandling hvor medisinering endres og forsterkes til man når et predefinert behandlingsmål har bidratt sterkt til bedre behandlings-resultater for revmatikere.
Som nevnt er biologiske legemidler proteiner som alltid vil kunne oppleves som fremmede av den pasienten som blir behandlet med dem. Dette kan gi immunogenisitets-problemer. Immunogenisitet reflekterer egentlig en naturlig, sunn immunreaksjon mot fremmede proteiner som trenger inn i kroppen. Pasientens immunsystem vil – hos noen – gjenkjenne det proteinet som gis sc eller iv som en fremmed, farlig inntrenger og lage en antistoff-respons mot det. Slike antistoffer kalles anti-drug antibodies (ADAb). Vi vet svært lite om hvorfor noen mennesker raskt får en slik immunrespons mot biologiske legemidler, mens andre aldri gjør det. Trolig er det gunstig med adekvate doser av biologisk medisin samt jevnlig dosering fremfor dosering bare av og til. Komedikasjon med andre immun-dempende medisiner ser også ut til å hemme utviklingen av ADAb [14].
En pasient som utvikler ADAb, vil få dårligere effekt av medikamentet. De sirkulerende antistoffene som er rettet mot det biologiske legemiddelet (i mange tilfelle selv et antistoff-molekyl) vil binde lege-middelet. Dels vil dette medføre at legemiddelet inngår i et kompleks som raskt brytes ned; dels vil det medføre at det biologiske legemiddelet aldri får interagert med sitt målmolekyl og dermed aldri heller får noen terapeutisk effekt. Nivået av fritt, sirkulerende biologisk medi-kament vil falle. Det er generelt bred enighet om at pasienter som utvikler ADAb, som gruppe betraktet, har vesentlig dårligere effekt av det aktuelle legemiddelet enn pasienter som ikke utvikler ADAb. Antistoffer mot et biologisk legemiddel er spesifikke, dvs at de ikke kryss-reagerer med andre biologiske legemidler.
Analyse på serumspeil av biologiske legemidler, og ADAb, gjøres av flere laboratorier i Norge, desidert størst er miljøet på OUS Radiumhospitalet. De får tilsendt prøver fra klinikere i hele Norge.
Behandling med nye, potente legemidler har langt på vei revolusjonert behandlingen av pasienter med inflammatoriske sykdommer som IBD og RA. De muliggjør målrettet intervensjon, og at klinikerne kan stoppe sykdomsprogresjonen før uopprettelig vevsskade har skjedd. Mange av våre pasienter vil neppe trenge slike medisiner, men mange har også fått et nytt liv og unngått operasjon med fjerning av tarm eller ortopediske inngrep. Kostnadene er raskt på vei ned for de etablerte medikamentene der såkalte biotilsvarende medisiner gjør sitt inntog. Dette tillater at vi tar i bruk nye medikamenter hos de pasientene som ikke har oppnådd god nok effekt av eksisterende midler, eller som har mistet slik effekt. Bivirkningsraten er egentlig overraskende lav. Man forventer at det blir mer vanlig med bruk av flere preparater samtidig hos den enkelte pasient.
Referanser