Staphylococcus aureus blodbane-infeksjon (SAB) er en alvorlig tilstand med høy dødelighet. Infeksjonen oppstår ikke tilfeldig, men er resultatet av et komplekst samspill mellom bakterie, vert og miljø. Hva er risikofaktorene for SAB i Norge? I hvilken grad er utfallet predikert av spesielle egenskaper hos bakteriene? Her presenteres resultatene fra en 3-årig prospektiv studie på SAB utført på Akershus Universitetssykehus (Ahus) (1, 2).
S. aureus eller gule stafylokokker er en typisk del av vår normalflora (Figur 1). Bakteriene koloniserer særlig nese og hals, men trives også i armhuler, underliv og tarmkanal. Rundt en tredjedel av oss er kroniske bærere. En rekke faktorer assosieres med kronisk kolonisering som alder, kjønn, etnisitet, yrke, underliggende sykdommer, genetiske faktorer, immunstatus, kontakt med helsevesenet og bruk av antibiotika (3).
Kolonisering er en risikofaktor for S. aureus infeksjoner. Hos nesebærere er det vist at > 80 % av S. aureus infeksjoner er endogene (4). Bakteriene kan forårsake et vidt spekter av infeksjoner i alle organer, hyppigst hud- og bløtdelsinfeksjoner. Smitte forekommer ved direkte person til person kontakt eller indirekte via kontaminerte hender og overflater. I sykehus er stafylokokkene hyppigste årsak til nosokomial infeksjoner (5). Håndhygiene er det viktigste smitteverntiltaket.
S. aureus har et bredt arsenal av virulensfaktorer som gjør at bakteriene kan invadere og skade vertsceller samt interagere med og hemme immunforsvaret på mange ulike måter (6). I tillegg har de utviklet resistens mot flere antibiotikaklasser, særlig har meticillin-resistente S. aureus (MRSA) vanskeligjort behandling og ført til økte kostnader.
Gener som koder for virulens og antibiotikaresistens overføres gjerne horisontalt mellom ulike stafylokokkstammer, primært av bakteriofager som er virus som angriper bakterier. Slik mobilitet av gener er viktig for bakterienes utvikling og tilpasning til ulike miljø. S. aureus har en klonal populasjonsstruktur dominert av 10 store og en rekke mindre klonale kompleks (CC), som hver inneholder en unik kombinasjon av gener. Innenfor hver CC-genotype sees likevel betydelig genetisk variasjon som følge av mobile gener som hopper inn og ut, og som i tillegg til tilfeldige mutasjoner, kan påvirke virulenspotensialet i en gitt bakteriestamme. Stafylokokkenes genetiske profil kan karakteriseres ved ulike genotypingsmetoder. I våre studier har vi blant annet brukt DNA microarray, en metode basert på nanoteknologi for simultanpåvisning av et stort antall gener og bestemmelse av CC.
S. aureus er nest hyppigste årsak til blodbaneinfeksjoner etter E. coli. Internasjonalt ligger insidensen av SAB på 15–50 tilfeller pr. 100 000 innbyggere pr. år (7), mens vi i Norge ligger på rundt 30 tilfeller. Insidensen ved Ahus over en treårsperiode viste en svakt stigende (ikke signifikant) tendens. En nylig publisert multinasjonal studie kunne ikke påvise en generell økning av SAB, men store regionale forskjeller ble observert grunnet ulike forekomster av MRSA og nosokomiale SAB (7). Økt bruk av avansert medisinsk behandling, inkludert invasive inngrep og immunsuppressiv behandling, også utenfor sykehusene, forventes å øke forekomsten av SAB.
Oppvekst av S. aureus i blodkultur indikerer klinisk relevans da kun 1,5 % av funnene kan oppfattes som kontaminering. I blodbanen fremkaller S. aureus en dysregulert vertsrespons som fører til sepsis og septisk sjokk. Studien vår inkluderer 303 sepsispasienter over 18 år. Kliniske variabler er gjengitt i Tabell 1 stratifisert på sykehuservervet (HA), helsetjenesteassosiert (HCA) eller samfunnservervet (CA) infeksjon. Kategoriene er basert på når etter innleggelse den positive blodkulturen ble tatt (HCA/CA < 48 timer, HA > 48 timer) og om pasienten har hatt kontakt med helsetjenesten/bodd på sykehjem (HCA) eller ikke (CA) siste 3 måneder (8). Median alder hos pasientene er høy (71 år), signifikant flere menn enn kvinner rammes. To tredjedeler av pasientene har en eller flere underliggende tilstander, vanligst er diabetes, kreft, KOLS, hjertesvikt, nyresvikt og levercirrhose. Det er illevarslende at 70 % av SAB tilfellene er assosiert med mottak av helsetjenester (HA + HCA). Infeksjoner med S. aureus er uønskede komplikasjoner som truer pasientsikkerheten.
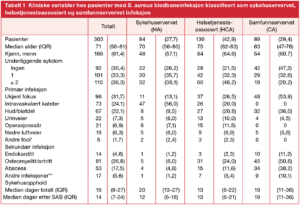
SAB – S. aureus blodbaneinfeksjon; IQR – interkvartilbredde
* Andre foci: Ascites, blodtransfusjonsreaksjon, kronisk osteomyelitt, konjunktivitt og epiduralt kateter
** Andre infeksjoner (n): aorta stentgraft (3), cerebralt infarkt, emboli (2), empyem (2), mykotisk aneurisme (2), pacemaker (2), pneumoni (2), protese, pseudo-aneurisme og scrotum abscess
De fleste blodbaneinfeksjoner skyldes spredning av S. aureus fra en primær lokal infeksjon, oftest i form av et infisert intravaskulært kateter eller en hud-/bløtdelsinfeksjon. Rask identifikasjon og effektiv fjerning eller drenasje av primær infeksjon bedrer prognosen og reduserer faren for komplikasjoner. Hos en tredjedel av SAB pasientene påvises ingen primær infeksjon. Dette kan ha sammenheng med varierende diagnostisk praksis og ulik prioritering av tiltak hos pasienter med generell dårlig prognose (terminal fase).
Komplikasjoner i form av sekundærinfeksjoner forekommer i 40 % av SAB tilfellene. S. aureus spres via blodbanen og kan forårsake osteomyelitt, artritt og dype abscesser. Endokarditt ble påvist i 5 % av SAB tilfellene, en lavere andel enn det som er rapportert fra andre land (9, 10). Det argumenteres for at en utstrakt bruk av ekkokardiografi i diagnostikken kan fange opp flere tilfeller (11). I vår studie ble 62 % av pasientene undersøkt enten med transtorakal alene (38 %) eller med tillegg av transøsofageal (24 %) ekkokardiografi.
Det var signifikante forskjeller mellom SAB kategoriene. Pasienter med SAB assosiert med helsetjenester (HA og HCA) var eldre, hadde flere underliggende sykdommer og primær infeksjon relatert til invasive medisinske prosedyrer, mens pasienter med CA-SAB oftere hadde ukjent primær infeksjon eller hudinfeksjon, hyppigere sekundære infeksjoner og lengre sykehusopphold etter at SAB diagnosen er stilt. Likevel ser vi ingen forskjeller i S. aureus genotyper mellom kategoriene. Genotypingen viste at S. aureus isolatene tilhører over 30 ulike CC-genotyper, hvorav 4 – CC5, CC15, CC30 og CC45 – dominerer og utgjør 60 % av isolatene. Ingen signifikante trender eller endringer over tid kunne påvises, noe som støtter påstanden om at enhver S. aureus stamme kan gi en invasiv infeksjon, gitt de rette omstendigheter.
De fleste S. aureus (72 %) produserer beta-laktamase som gir resistens mot penicillin. Svært få pasienter (1.6 %) hadde SAB forårsaket av MRSA, noe som kan tyde på at tiltakene i vår «search and destroy policy» innlemmet i MRSA veilederen er effektive (12). Forekomsten av resistens mot makrolider, tetrasykliner og fucidin ligger på 3-5 % og mot gentamicin, kloramfenikol og mupirocin opptil 2 %.
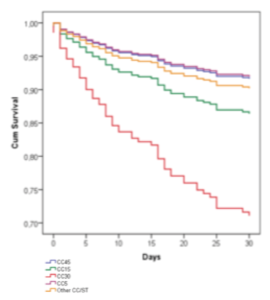
Figur 2: Kaplan-Meier plott for kumulativ overlevelse innen 30 dager for pasienter med S. aureus blodbaneinfeksjon stratifisert på S. aureus genotype (justert for alder, kjønn, underliggende sykdom og primær infeksjon).
SAB er forbundet med høy dødelighet. Vi fant at 21 % av pasientene døde innen 30 dager. En nylig oversiktsartikkel oppsummerer at dødeligheten har stabilisert seg rundt 20 %, men med store variasjoner relatert til ulike risikofaktorer (13). Alder, underliggende sykdom, ukjent primær fokus, nedre luftveisinfeksjon og endokarditt er risikofaktorer forbundet med høyere dødelighet. Disse bekreftes alle i vår studie (Tabell 2). Et nytt interessant funn er at SAB forårsaket av S. aureus genotype CC30 i vår pasientpopulasjon var assosiert med signifikant høyere dødelighet (Figur 2). Sammenhengen ble også indikert i vår retrospektive studie av SAB (14). Genotype CC30 er tidligere blitt assosiert med invasive infeksjoner generelt og hematogene komplikasjoner, endokarditt og vedvarende bakteriemi spesielt (15-17). Hvilke genetiske mekanismer hos S. aureus som ligger til grunn for denne assosiasjonen er det for tidlig å si noe om. DNA microarray analyse av S. aureus virulens og resistensgener kunne ikke peke på spesifikke gener som kunne forklare den høyere dødeligheten (1). Vi har derfor initiert helgenomsekvensering av stafylokokkene i håp om å finne noen svar.
SAB har høy dødelighet. En stor andel SAB er assosiert med medisinsk behandling (HA + HCA infeksjoner) og primære infeksjoner som potensielt kan forebygges; for eksempel kan intervensjoner som fokuserer på gode opplæringsprogram og etterlevelse av retningslinjer innen smittevern, vise til opptil 55 % reduksjon av kateterrelaterte blodbaneinfeksjoner (18, 19). Infeksjonsmedisinsk konsultasjon ved hvert SAB tilfelle er assosiert med bedre behandlingsforløp og høyere overlevelse og anbefales implementert som rutine i alle sykehus (20). Kontinuerlig overvåking av SAB forekomst kan inngå som en nyttig kvalitetsindikator (21).
Spesifikke bakterielle egenskaper synes å være assosiert med utfallet av SAB. Veien fram til bedre behandling og kontroll med SAB ligger i en dypere forståelse av mekanismene som fører til blodbaneinfeksjoner – det inkluderer studier av både bakterier og vertsfaktorer, samt deres komplekse samspill, som leder til alvorlige infeksjoner.
Referanser
1. Blomfeldt A, Aamot HV, Eskesen AN, Monecke S, White RA, Leegaard TM, Bjørnholt JV. 2016. DNA microarray analysis of Staphylococcus aureus causing bloodstream infection: bacterial genes associated with mortality? Eur J Clin Microbiol Infect Dis 35:1285-95.
2. Blomfeldt A, Eskesen AN, Aamot HV, Leegaard TM, Bjørnholt JV. 2016. Population-based epidemiology of Staphylococcus aureus bloodstream infection: clonal complex 30 genotype is associated with mortality. Eur J Clin Microbiol Infect Dis 35:803-13.
3. Sollid J, Furberg A, Hanssen A, Johannessen M. 2014. Staphylococcus aureus: determinants of human carriage. Infect Genet Evol 21:531-41.
4. Wertheim HF, Vos MC, Ott A, van Belkum A, Voss A, Kluytmans JA, van Keulen PH, et al. 2004. Risk and outcome of nosocomial Staphylococcus aureus bacteraemia in nasal carriers versus non-carriers. Lancet 364:703-5.
5. European Centre for Disease Prevention and Control. 2015. Annual epidemiological report 2014 – Antimicrobial resistance and healthcare-associated infections. ECDC, Stockholm.
6. Foster TJ, Geoghegan JA, Ganesh VK, Hook M. 2014. Adhesion, invasion and evasion: the many functions of the surface proteins of Staphylococcus aureus. Nat Rev Micro 12:49-62.
7. Laupland KB, Lyytikäinen O, Søgaard M, Kennedy K, Knudsen J, Ostergaard C, Galbraith J, et al. 2013. The changing epidemiology of Staphylococcus aureus bloodstream infection: a multinational population‐based surveillance study. Clin Microbiol Infect 19:465-71.
8. Friedman ND, Kaye KS, Stout JE, McGarry SA, Trivette SL, Briggs JP, Lamm W, et al. 2002. Health care-associated bloodstream infections in adults: a reason to change the accepted definition of community-acquired infections. Ann Intern Med 137:791-7.
9. Kaasch AJ, Barlow G, Edgeworth JD, Fowler Jr VG,
Hellmich M, Hopkins S, Kern WV, et al. 2014. Staphylococcus aureus bloodstream infection: A pooled analysis of five prospective, observational studies. J Infect 68:242-51.
10.Rasmussen RV, Høst U, Arpi M, Hassager C, Johansen HK, Korup E, Schønheyder HC, et al. 2011. Prevalence of infective endocarditis in patients with Staphylococcus aureus bacteraemia: the value of screening with echocardiography. Eur J Echocardiogr 12:414-20.
11.Holland TL, Arnold C, Fowler VG, Jr. 2014. Clinical management of Staphylococcus aureus bacteremia: A review. JAMA 312:1330-41.
12.Elstrøm P, Kacelnik O, Bruun T, Iversen B, Hauge SH, Aavitsland P. 2012. Meticillin-resistant Staphylococcus aureus in Norway, a low-incidence country, 2006-2010. J Hosp Infect 80:36-40.
13.van Hal SJ, Jensen SO, Vaska VL, Espedido BA, Paterson DL, Gosbell IB. 2012. Predictors of mortality in Staphylococcus aureus bacteremia. Clin Microbiol Rev 25:362-86.
14.Aamot HV, Blomfeldt A, Eskesen AN. 2012. Genotyping of 353 Staphylococcus aureus bloodstream isolates collected between 2004 and 2009 at a Norwegian University Hospital and potential associations with clinical parameters. J Clin Microbiol 50.
15.Fowler VG, Nelson CL, McIntyre LM, Kreiswirth BN, Monk A, Archer GL, Federspiel J, et al. 2007. Potential associations between hematogenous complications and bacterial genotype in Staphylococcus aureus Infection. J Infect Dis 196:738-47.
16. Nienaber JJC, Sharma Kuinkel BK, Clarke-Pearson M, Lamlertthon S, Park L, Rude TH, Barriere S, et al. 2011. Methicillin-susceptible Staphylococcus aureus endocarditis isolates are associated with clonal complex 30 genotype and a distinct repertoire of enterotoxins and adhesins. J Infect Dis 204:704-13.
17.Xiong YQ, Fowler VG, Yeaman MR, Perdreau-Remington F, Kreiswirth BN, Bayer AS. 2009. Phenotypic and genotypic characteristics of persistent methicillin-resistant Staphylococcus aureus bacteremia in vitro and in an experimental endocarditis model. J Infect Dis 199:201-8.
18.Pronovost P, Needham D, Berenholtz S, Sinopoli D, Chu H, Cosgrove S, Sexton B, et al. 2006. An intervention to decrease catheter-related bloodstream infections in the ICU. N Engl J Med 355:2725-32.
19.Geubbels EL, Bakker HG, Houtman P, van Noort-Klaassen MA, Pelk MS, Sassen TM, Wille JC. 2004. Promoting quality through surveillance of surgical site infections: five prevention success stories. Am J Infect Control 32:424-30.
20.Paulsen J, Solligård E, Damås JK, DeWan A, Åsvold BO, Bracken MB. 2016. The impact of infectious disease specialist consultation for Staphylococcus aureus bloodstream infections: A systematic review. Open Forum Infectious Diseases 3:ofw048.
21.Collignon PJ, Wilkinson IJ, Gilbert GL, Grayson ML, Whitby RM. 2006. Health care-associated Staphylococcus aureus bloodstream infections: a clinical quality indicator for all hospitals. Med J Aust 184:404.