Forskning og klinisk bruk av biomarkører som identifiserer hjertesykdom har vært i rivende utvikling siden den første rapporten om forhøyede verdier av aspartataminotransferase (ASAT) ved akutt hjerteinfarkt i 1954 (1). I dag måles hjertespesifikke biomarkører verden over i millioner av pasienter daglig og den kliniske nytten ved visse tilstander er udiskutabel. Det er imidlertid mangelfull kunnskap om klinisk tolkning av hjertespesifikke biomarkører tross betydelig økt kunnskap om mekanismer som leder til forhøyede konsentrasjoner i sirkulasjonen.
Det er primært to grupper hjertespesifikke biomarkører som dominerer i klinisk bruk; natriuretiske peptider (B-type natriuretiske peptider [BNP] og N-terminal pro-BNP) og hjertespesifikke troponiner (kardialt troponin T og troponin I). I tillegg er det et titalls nye biomarkører som inngår i ulike deler av patofysiologien ved hjertesykdom inkludert inflammasjon, trombose, endotelfunksjon, remodelering/fibrose og nevrohormonell aktivering (Figur 1). Kun et fåtall av disse er i klinisk bruk i dag, og vil ikke omtales i denne artikkelen.
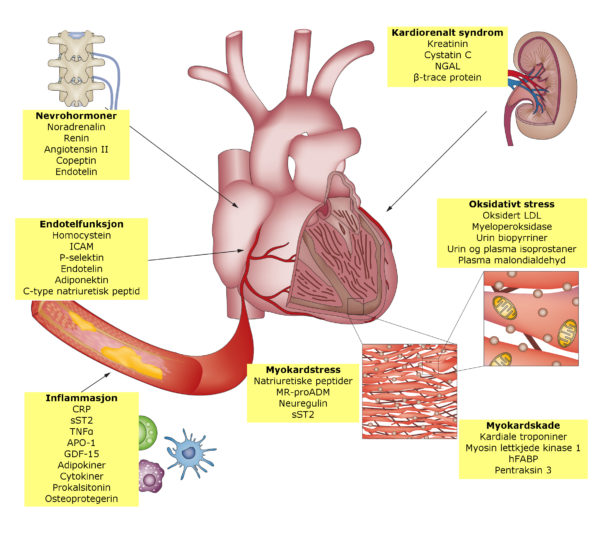
Figur 1. Kardiovaskulære biomarkører gruppert i henhold til patofysiologiske prosesser. Oversatt og omarbeidet med tillatelse fra Ahmad et al. Novel biomarkers in chronic heart failure. Nat Rev Cardiol. 2012 Mar 27;9(6):347-59.
Trykkes med tillatelse.
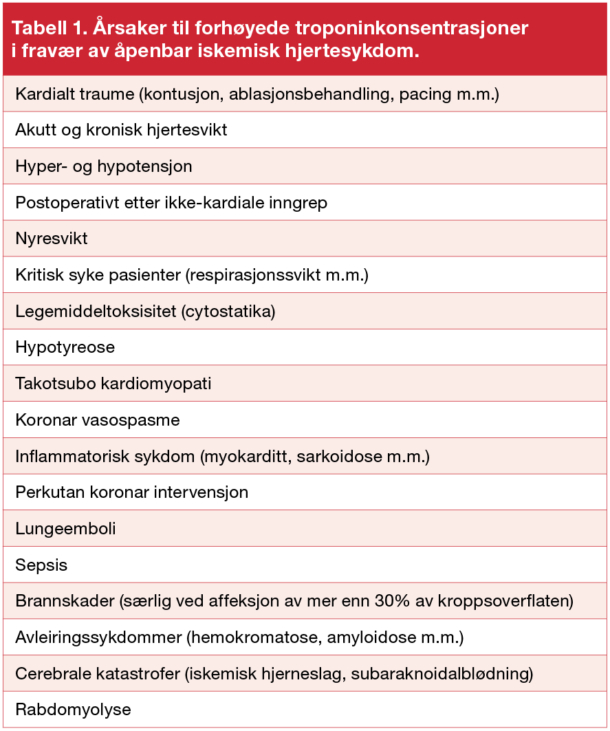
Kardialt troponin T og troponin I er del av det kontraktile apparat i hjertecellen og frigjøres til sirkulasjonen ved skade på hjertecellene. Hjertespesifikk troponin er den mest brukte biomarkøren, og påvisning av fritt sirkulerende troponin ved myokardnekrose hos pasienter med akutt koronarsyndrom er solid dokumentert. Målinger av kardialt troponin er helt sentral i diagnostisk utredning av pasienter med brystsmerter og mistenkt akutt hjerteinfarkt. Dette gjenspeiles også i gjeldende retningslinjer, hvor man ved konsensus har bestemt at øvre referansegrense for kardialt troponin skal være på 99-persentilen til en frisk normalpopulasjon (2). Siden de første kliniske analysemetodene for kardialt troponin kom på slutten av 80-tallet, har gradvis økende sensitivitet gjort at man kan måle stadig lavere konsentrasjoner av kardialt troponin i blodet (3). Hos pasienter med akutt hjerteinfarkt har innføring av høysensitive analyser gjort at man med høyere presisjon kan detektere konsentrasjoner av kardialt troponin under 99-persentilen og også utelukke patologisk forhøyede verdier tidligere etter symptomdebut (4-6). I en stor valideringsstudie som nylig ble presentert som abstract på European Society of Cardiology (ESC) viste man at med nyeste analysemetode med stor sikkerhet (negativ prediktiv verdi 99.8 %) kan utelukke non-ST-elevasjonsinfarkt hos pasienter med akutte brystsmerter ved å måle endring i konsentrasjon fra 0 til 1 time etter ankomst i sykehus (kardialt troponin T <12 ng/L ved innkomst samt endring <3ng/L etter 1 time) (7). De siste retningslinjene fra ESC anbefaler imidlertid å bruke 0 til 3-timersalgoritme, men åpner også for bruk av 0 til 1-timersalgoritme på sykehus som har høysensitive analysemetoder av kardialt troponin (8). I klinisk medisin er imidlertid redusert diagnostisk spesifisitet en uunngåelig konsekvens av økt sensitivitet til en analysemetode. Dette skaper betydelige utfordringer for klinik-ere som må ta stilling til om den forhøyede troponinkonsentrasjonen skyldes akutt hjerteinfarkt eller en annen akutt eller kronisk tilstand (Tabell). Ettersom en rekke andre tilstander også kan føre til forhøyede troponinverdier, kreves det kunnskap om ulike mekanismer som kan føre til forhøyede konsentrasjoner, samt veloverveid indikasjon for å utføre analysen. For å unngå falskt positive prøvesvar er det derfor viktig kun å måle kardialt troponin ved klinisk mistanke om akutt hjerteinfarkt, samt benytte repeterte målinger for å identifisere «rise-and-fall»-mønster som er karakteristisk for akutt myokardskade. Dette i motsetning til de fleste andre tilstander som kan medføre forhøyede troponinkonsentrasjoner.
Innføringen av høysensitive troponinmålinger har i tillegg åpnet et nytt felt innenfor klinisk bruk. Med de nyeste analysemetodene kan man påvise kardialt troponin i blodet hos flesteparten i en frisk befolkning, og også kvantifisere konsentrasjonene innenfor normalområdet. Kardialt troponin målt med høysensitive metoder har vist seg å kunne gi prognostisk informasjon om risiko for utvikling av hjertesvikt og hjerterelatert død hos den generelle befolkningen (9-12), samt hos pasienter med stabil koronarsykdom (13,14) og hjertesvikt (15). Konsentrasjoner av kardialt troponin predikerer i mindre grad risiko for akutt hjerteinfarkt (13). På bakgrunn av assosiasjon med venstre ventrikkelmasse (9) og bindevevsdannelse (16) er gjeldende hypotese at kronisk forhøyede konsentrasjoner av kardialt troponin i hovedsak skyldes remodelering av myokard. Videre er det fremsatt en rekke hypoteser for årsaker til frigjøring av kardialt troponin, bl.a. nekrose og apoptose av kardiomyocytter og økt membranpermeabilitet som følge av strekk eller iskemi (17). Det er likevel liten tvil om at kronisk forhøyet konsentrasjoner av kardialt troponin er uttrykk for skade av myokard, uavhengig av bakenforliggende årsak.
For klinikeren som skal vurdere forskjellige verdier av kardialt troponin hos pasienter, er det viktig å ha kjennskap til hva som påvirker disse utover den sykdommen vi ønsker å identifisere, d.v.s. potensielle konfunderende faktorer. De viktigste faktorene i denne sammenheng er alder og kjønn (10,18,19). Konsentrasjoner av kardialt troponin stiger med økende alder og er høyere hos menn enn kvinner. I de nyeste amerikanske retningslinjene for kardialt troponin T er det således laget forskjellig beslutningsgrenser (99-persentil) for kvinner (14 ng/L) og menn (22 ng/L), mens de europeiske retningslinjene fremdeles bruker 14 ng/L for begge kjønn (8,20). Redusert nyrefunksjon er også sterkt assosiert med forhøyede konsentrasjoner av kardialt troponin, men årsakene til dette er ennå ikke helt forstått (21). Det antas at felles risikofaktorer med kardiovaskulær sykdom kan være viktige årsaker til forhøyede troponinkonsentrasjoner hos pasienter med nyresvikt (22). Redusert glomerulær filtrasjonsrate påvirker sannsynligvis utskillelse av kardialt troponin i mindre grad, da det er lite samsvar mellom konsentrasjoner av kreatinin og kardialt troponin (21). Hos pasienter med endestadium nyresvikt er det derimot vist at utskillelsen av troponinfragmenter er redusert (23) I vurderingen av akutt koronarsyndrom hos pasienter med nyresvikt anbefales det likevel å bruke standard referansegrenser i vurdering av kardialt troponin (24,25). Selv om spesifisiteten til kardialt troponin vil være lavere hos pasienter med nyresvikt, vil muligheten til å utelukke akutt hjerteinfarkt fremdeles være høy. Det er derfor svært viktig å gjenta målingene hos denne pasientgruppen.
Av andre potensielle konfunderende faktorer kan det nevnes at konsentrasjoner av kardialt troponin paradoksalt nok er lavere hos røykere (26).
Hjertet som et endokrint organ ble først lansert av Braunwald i 1964 (27) og var i begynnelsen basert på observasjoner av lokal katekolaminfrigjøring fra hjertet. Den endokrine funksjonen til hjertet ble likevel først etablert i 1981, av de Bold og kollegaer som demonstrerte at injeksjon av ekstrakt fra atriet førte til økt diurese, natriurese og hypotensjon hos rotter (28). Siden har det vært omfattende forskning på natriuretiske peptider; først atrialt natriuretisk peptid (ANP) /-faktor (ANF) og siden brain natriuretisk peptid (BNP). BNP ble først oppdaget i grisehjerner i 1988, men ble tidlig kalt B-type natriuretisk peptid da supplerende eksperimentelle forsøk viste at hjertets venstre ventrikkel var hovedkilden til sirkulerende BNP (29). BNP syntetiseres og frigjøres som et prohormon (proBNP) fra myokard og blir deretter spaltet av sirkulerende endoproteaser til biologisk aktivt peptid (BNP) og et inaktivt peptid N-terminal proBNP (NT-proBNP). I dag er målinger av både BNP og NT-proBNP i utbredt klinisk bruk.
I Norge er måling av NT-proBNP mest utbredt, og fordelene sammenliknet med BNP er at NT-proBNP har lengre halveringstid og er mer stabilt ved romtemperatur (30). Bestemmelse av NT-proBNP er også svært nyttig ved oppfølging av pasienter som behandles med de nyeste medikamentene innen hjertesviktbehandling, nemlig neprilysin-hemmere, ettersom BNP brytes ned av neprilysin og vil kunne medføre falskt forhøyet verdier hos denne pasientgruppen (31).
Norske forskere har gjort pionerarbeid i utviklingen av natriuretiske peptider som markør for hjertesykdom og Rikshospitalet var først i verden til å tilby NT-proANP som rutineanalyse allerede i 1993 (32,33).
De natriuretiske peptidene syntetiseres og frigjøres hovedsakelig fra celler i atriene hos friske (34). Derimot ved sykdom i ventriklene (dilatasjon, hypertrofi eller økt veggtensjon) og økt hemodynamisk stress økes produksjonen også i ventriklene, som i økende grad blir den dominerende bidragsyter til sirkulerende konsentrasjoner (35). Den biologiske effekten av de natriuretiske peptid-ene er kompleks og medfører økt diurese, natriurese, vasodilatasjon og hemming av renin-angiotensin-
aldosteronsystemet samt påvirkning av det sympatiske nervesystemet. Hos pasienter med hjertesvikt dannes det økte mengder av natriuretiske peptider, som har en positiv kompensatorisk virkning. Dette understøttes også av robuste resultater fra kliniske studier på neprilysin-hemmeren LCZ696 (Entresto). Neprilysin bryter ned sirkulerende BNP og hemming av neprilysin forlenger derfor de gunstige effektene av BNP. Dette
har vist å bedre overlevelse hos pasienter med hjertesvikt og redusert ejeksjonsfraksjon (36).
En rekke studier har vist at forhøyede konsentrasjoner av natriuretiske peptider presist kan predikere mortalitet hos pasienter med både kronisk- og akutt hjertesvikt, uavhengig av venstre ventrikkels ejeksjonsfraksjon (37-41). Videre er det vist at natriuretiske peptider gir prognostisk informasjon utover konvensjonelle risikofaktorer som akutt koronarsyndrom (42), klaffesykdom (43), hypertensjon (44) og etter hjertestans (45). Natriuretiske peptider brukes likevel mest i klinikken som et diagnostisk hjelpemiddel. I Breathing Not Properly-studien fra 2002 (hvor Norge var representert med 2 av 7 studiesentre) ble det vist at BNP kan brukes til å diagnostisere eller ekskludere hjertesvikt som årsak til dyspné hos pasienter (46). Bestemmelse av BNP verdier er særlig nyttig hos pasienter med atypisk klinikk og hvor supplerende undersøkelser (røntgen toraks og ekkokardiografi) heller ikke gir en sikker diagnose (Figur 2). Hos pasienter med akutt dyspné og NT-proBNP-konsentrasjoner under 300 ng/L kan man utelukke akutt hjertesvikt med 99 % negativ prediktiv verdi, mens høye konsentrasjoner (>450 ng/L for pasienter <50 år og >900 ng/L for pasienter ≥50 år) er svært spesifikt for hjertesvikt (47). NT-proBNP-målinger kan også benyttes til å utelukke hjertesvikt hos pasienter med ikke-akutte symptomer hvor konsentrasjoner under 125 ng/L anbefales som beslutningsgrense. Retningslinjene fra ESC anbefaler derfor at pasienter med konsentrasjoner under denne grensen ikke bør henvises til ekkokardiografi for videre utredning (48). Det bør presiseres at i Norge har vi frem til for nylig operert med pmol/L som enhet for NT-proBNP og BNP, men Norsk Cardiologisk Selskap har nå anbefalt å endre til ng/L som enhet (49). Dette har blitt gjort for å unngå misforståelser og for å harmonisere med gjeldende retningslinjer fra ESC.
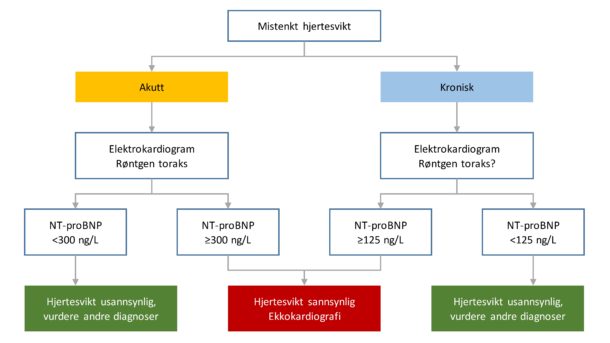
Figur 2. Diagnostisk algoritme for akutt og kronisk hjertesvikt. Utarbeidet fra Ponikowski P et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2016 Jul 14;37(27):2129-200.
I likhet med ovenfor beskrevne konfunderende faktorer til hjertespesifikke troponiner er det også en rekke andre kardiovaskulære og ikke-kardiovaskulære årsaker til forhøyede konsentrasjoner av natriuretiske peptider, som dermed kan svekke den diagnostiske nytten av å måle BNP ved hjertesvikt. De viktigste konfunderende faktorene er alder, nyrefunksjon og atrieflimmer som kan gi økte konsentrasjoner av natriuretiske peptider, samt økt kroppsmasseindeks som er assosiert med lavere konsentrasjoner (50).
Bruk av hjertespesifikke biomarkører har forbedret utredning og oppfølging av pasienter med hjertesykdom. I klinisk sammenheng er de natriuretiske peptidene og kardiale tropo-niner hjørnesteiner i diagnostikk av henholdsvis kronisk og akutt hjertesvikt og akutt hjerteinfarkt.
Klinikere som skal tolke prøvesvar må være oppmerksomme på konfunderende faktorer som påvirker konsentrasjonene av biomarkørene, da dette vil være avgjørende for korrekt bruk i diagnostikken. Måling av kardiovaskulære biomarkører kan også gi oss betydelig informasjon om prognose og risiko for å utvikle kardiovaskulær sykdom, også hos presumptivt hjertefriske pasienter. Bruk av biomarkører i vurdering av risiko har fått ufortjent lite plass i gjeldende retningslinjer for forebygging av kardiovaskulær sykdom. Vår mening er at kardiale troponiner og natriuretiske peptider bør, sammen med andre risikofaktorer integreres i risikostratifisering for både primær- og sekundærprofylakse. Man kan dermed fange opp subklinisk hjertesykdom og iverksette tiltak for å redusere risiko på et tidligstadium.