Fedme og sykelig overvekt har flere negative respirasjonsfysiologiske konsekvenser med nedsatt lungefunksjon til følge. Vektreduksjon har positiv effekt på disse. Artikkelen tar for seg dette tema og bygger i stor grad på Mobil-studien.
Overvekt er et stadig større helse-problem i hele den vestlige verden. I følge WHO klassifiseres grad av overvekt i henhold «body mass index» (BMI – definert som kg/m2; altså vekt/høyde2). Overvekt defineres som BMI ≥ 25 kg/m2, og fedme som BMI ≥ 30 kg/m2. Med begrepet sykelig overvekt menes BMI ≥ 40 kg/m2 eller BMI ≥ 35 kg/m2 med minst en fedmerelatert komorbiditet (1).
Personer med fedme og sykelig overvekt har høyere respirasjonsfrekvens og lavere tidalvolum enn normalvektige (2). Både inspirasjon og ekspirasjon påvirkes av dette. De har redusert muskelstyrke (3), økt respirasjonsarbeid, selv når de ikke anstrenger seg, og de har begrensende ventilatoriske reserver, slik at de lettere utvikler respirasjonssvikt i forbindelse med f.eks. en lungebetennelse (4).
Økende grad av fedme kan også redusere belgfunksjonen ved å begrense ekspansjonen av muskulaturen i brysthulen og diafragma (5). I tillegg vil økt blodvolum og tendens til kollaps av basale alveoler redusere ettergiveligheten i lungeparenchymet Dette kan føre til shunting og hypoksi (6), og medfører behov for et større negativt intrapleuraltrykk for å starte en inspirasjon (6, 7).

VT= tidalvolum, IC = inspiratorisk kapasitet, ERV = ekspiratorisk reservekapasitet VC (vitalkapasitet) = IC+ ERV, FRC (funksjonell reservekapasitet) = ERV + RV TLC (total lungekapasitet) = IC+ ERV + RV.
Figur 1. Statiske lungevolum (Illustrasjon fra The free dictionary by Farlex)
Vanligvis har sykelig overvekt beskjeden effekt på dynamiske lungevolum (FVC, FEV1) og FEV1/FVC er som regel normal (> 0.70), mens de statiske lungevolumene (figur 1) påvirkes i større grad.
Total lungekapasitet (TLC) kan være lett nedsatt, mens vitalkapasitet (VC) og residualvolum (RV) påvirkes lite. Inspiratorisk kapasitet (IC) kan være økt på grunn av at inspirasjonsmuskulaturen prøver å kompensere for restriksjon på grunn av fettavleiringer i brysthulen og diafragma (8). Disse volumene er vist i figur 1.
Funksjonell residualkapasitet (FCR) er ofte redusert ettersom ekspiratorisk reservevolum (ERV) kan være betydelig nedsatt (8-10). I en tverrsnittsstudie i den norske Mobilstudien var gjennomsnittlig ERV verdi redusert til 49% av forventet verdi (N= 149, 77% kvinner, gjennomsnittlig BMI 45,0 kg/m2, gjennomsnittlig alder 43 år) (11).
Diffusjonskapasiteten (DLCO) er vanligvis innen normalområdet ved fedme, mens korrigert diffusjonskapasitet (KCO eller DLCO/VA) er økt på grunn av redusert alveolærvolum (VA) (12).
Blodgassverdier kan også affiseres. I nevnte tverrsnittsstudie fant man signifikante korrelasjoner mellom pO2 og pCO2 og henholdsvis BMI og antropometriske mål (halsvidde [NC], livvidde [WC] og midje/hofte ratio [WHR]) (figur 2). Men unntak av for WHR, persisterte disse funnene også etter justering for kjønn, alder og tobakksforbruk.
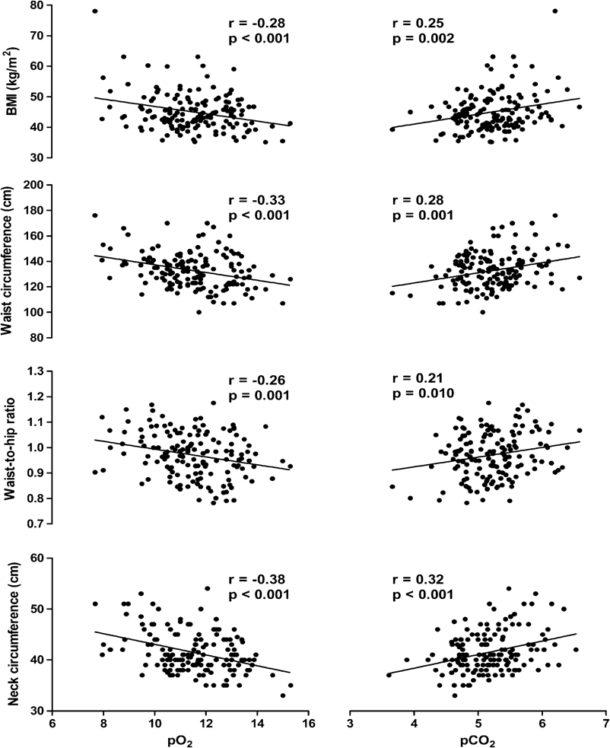
Figur 2. Korrelasjoner mellom blodgasser og antropometriske mål. Fra Gabrielsen et al. Obes Surg 2011; 21(4):485-91. Trykkes med tillatelse.
Det er ulike strategier for vektreduksjon, både kirurgiske metoder og intensive regimer for livsstilsendring har blitt undersøkt. I senere år har laparaskopisk gastric bypass vært viktigste kirurgiske prosedyre. Tabell 1 viser resultatene av de ulike studiene basert på litteratursøk i PubMed (terms “pulmonary function” eller “lung function” og “weight loss” eller “weight reduction»). To av disse studiene er norske (13, 14).
Ulike studier fokuserer på ulike variable, men alle har data på dynamiske lungevolum. Statiske lungevolum og blodgassverdier er i mindre grad undersøkt. Oppfølgingstiden varierer, men ett år er mest vanlig. Det rapporteres om signifikante forbedringer i blodgassverdier (14-17) og lungefunksjon etter gastric bypass (13, 17-22), jejuno-ileal bypass (23), gastric banding (14-16, 24, 25) og ikke-kirurgiske metoder (26-28) (tabell 1).
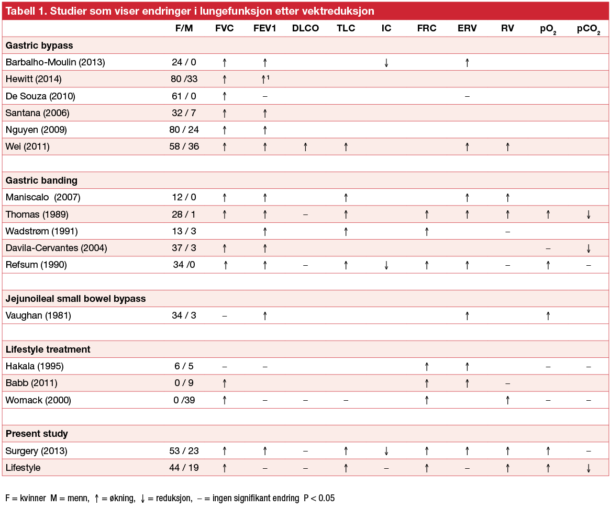
Tabell 1. Studier som viser endringer i lungefunksjon etter vektreduksjon
For å belyse dette temaet ytterligere, vil jeg kommentere en komparativ studie vi utførte ved Senter for sykelig overvekt i Helse Sør-Øst i samarbeid med lungeseksjonen ved Sykehuset i Vestfold (17). Denne er en av flere substudier i MOBIL-studien (Morbid Obesity treatment, Bariatric surgery vs. Intense Lifestyle intervention [ClinicalTrials.gov number NCT0027314]) (41), hvor 139 personer med sykelig overvekt ble behandlet med enten Roux-en-Y gastric bypasskirurgi (n = 76) eller intensiv livsstilsintervensjon (n = 63, alder19 – 66 år, mean [standard avvik] BMI 45,1 [5.6] kg/m2; hvorav 107 kvinner). Gjennomsnittlig vektreduksjon var henholdsvis 30 % i kirurgigruppen og 8 % i livstilsintervensjonsgruppen.
Lungefunksjonstester og arterielle blodgassmålinger ble gjort ved studiestart og etter ett år. Figur 3 viser endringer i gjennomsnittsverdier for absolutte lungevolum før og etter intervensjon.
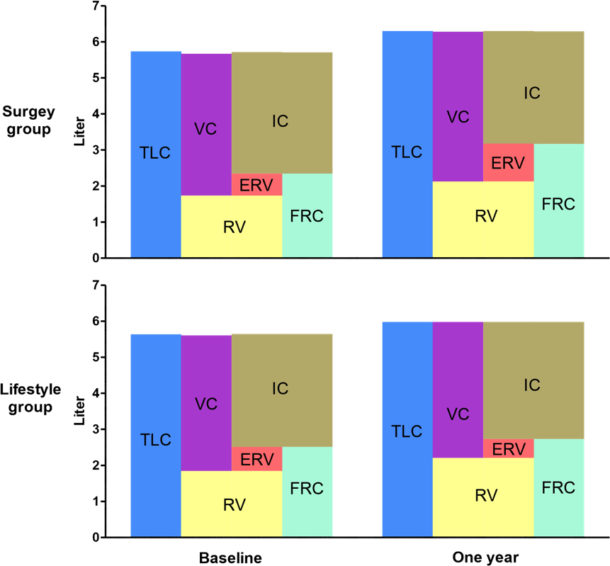
Figur 3. Endringer i statiske lungevolum før og etter vektreduksjon.
Fra Gabrielsen et al. Clinical Obesity 2013; 3(5): 117-23.” Trykkes med tillatelse.
Vektnedgang viste en generell bedring i lungefunksjonen. Vi så også at verdiene for FVC, FEV1, TLC, VC, FRC, ERV og pO2 økte signifikant mer etter vektnedgang med kirurgi enn med livsstilsintervensjon, mens verdiene for IC og DLCO/VA falt signifikant mer i kirurgigruppen. Den største endringen fant vi for ERV, som i kirurgigruppen økte fra 45 til 90% av forventet verdi. For FEV1/FVC, DLCO, RV og pCO2 var det ingen signifikant forskjell mellom gruppene. Gjennomsnittlig pCO2 i denne studien var innen normalområdet ved studiestart. Ved justering for endring i BMI, var det ikke lenger noen signifikante assosiasjon-er mellom lungefunksjonsvariabler og behandlingsgruppe.
Rundt 30% av personene med sykelig overvekt hadde fått astma diagnose av sin fastlege og var blitt foreskrevet medisiner for dette. Denne diagnosen hadde ingen innvirkning på resultatene.
Konklusjonen på studien er at vekt-reduksjon førte til bedring i lungefunksjon og oksygenering i begge grupper, men at gastric bypass kirurgi førte til større forbedringer i oksygenering og lungefunksjon enn intensiv livsstilsintervensjon, Den største forbedringen var i ERV i kirurgigruppen. Bedringen kunne tilskrives selve vekttapet, ikke type intervensjon som ble utført.
Personer med sykelig overvekt vil kunne utvikle fedmerelatert respirasjonssvikt – obesity hypoventilation syndrome [OHS] eller «Pickwick syndrome» – definert som BMI ≥ 30 kg/m2 og dagtids pCO2 > 6.0 kPa (29, 30). Disse vil kunne ha nytte av non-invasiv ventilasjonsstøttebehandling (BiPAP-behandling) om natten (31, 32). Denne gruppen er gjerne tilvendt dårlige blodgassverdier, og problemene avdekkes ofte i forbindelse med akutte innleggelser. Mange har obstruktiv søvnapnè (OSA) i tillegg (33). I Mobil-studien viste vi også at vektreduksjon har gunstig effekt på OSA, og at mange kan bli kvitt denne lidelsen (34).
Begrepet «overlap syndrome» har fått økende oppmerksomhet i senere tid. Det ble opprinnelig definert som kombinasjonen kronisk obstruktiv lungesykdom (KOLS) og OSA (35). Data fra store kohortestudier viser at slike pasienter har dårligere blodgasser, mer komorbiditet og dårligere prognose enn pasienter som «bare» har KOLS eller OSA (36-38). «Overlap syndrom» er en lidelse som ofte går «under radaren». Vi som leger må finne disse pasientene, for dette er et symptomkompleks pasientene selv ikke kjenner til. I de svenske retningslinjer for hjemmerespiratorbehandling (Svedevox 2016) er dette satt mer i system. Her omtales den “hyperkapniske triangel”; personer som har kombinasjonen overvekt, OSA og KOLS som tilsammen gir økt komorbiditet, forverrede blodgasser og etterhvert respirasjonssvikt type 2 (25). Mange av disse kan ha mer nytte av BiPAP enn «bare CPAP» om natten.
Konklusjon
Studiene som er oppsummert i denne artikkelen viser at sykelig overvekt har negativ effekt på lungefunksjonen og kan være forbundet med betydelig komorbiditet. Vektreduksjon reverserer dette uavhengig av hva slags vektreduserende metode man velger.