Det er besluttet å innføre screening mot tarmkreft i Norge. Forslaget om et nasjonalt screeningsprogram er basert på kunnskapsgrunnlag fra forskning, helseøkonomiske analyser, etiske vurderinger og oppsummering av erfaringer fra pilotprogrammet i Helse Sør-Øst som har pågått siden 2012. I det nasjonale screeningsprogrammet vil deltakerne tilbys en test på usynlig blod i avføringen. Programmet skal rulles gradvis ut fra 2019 og en del av programmet skal gjennomføres som en randomisert studie med sammenligning av avføringstest mot koloskopi.
Tykk- og endetarmskreft (tarmkreft) er et betydelig og økende helseproblem. De fleste tilfellene er sporadiske, dvs. at det ikke foreligger kjent familiær opphopning 1. Flere livsstilsfaktorer er assosiert med økt risiko for tarmkreft. Blant disse er røyking, alkohol og diett med lavt fiberinntak og mye rødt og prosessert kjøtt 2 3. Som regel oppstår tarmkreft fra forstadier (polypper) som utvikler seg til maligne svulster over flere år. Symptomer oppstår ofte sent i forløpet, når mulighetene for kurativ behandling er betydelig mindre.
I Norge diagnostiseres det nå om lag 4300 nye tilfeller av tarmkreft hvert år. Til tross for at overlevelsen har bedret seg over de siste tiår, er femårsoverlevelsen ikke høyere enn 65 %. I løpet av de siste 50 årene har forekomsten av tarmkreft nesten tredoblet seg i Norge. Både for kvinner og menn er økningen større enn i våre naboland, figur 1. Årsaken til dette er ikke kjent. Norge har verdens høyeste forekomst av tarmkreft blant kvinner.
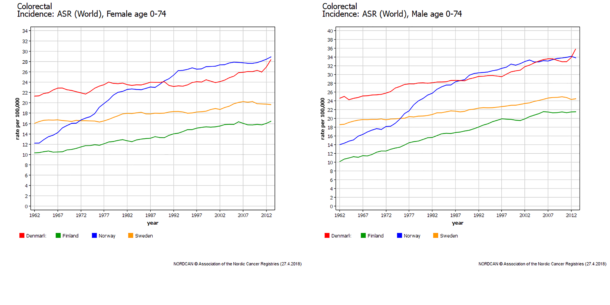
Figur 1. Forekomst av tarmkreft blant kvinner og menn i de nordiske land de siste
50 årene. (NORDCAN © Association at the Nordic Cancer Registries (27.4.2018).
Trykkes med tillatelse.
Innføring av populasjonsbasert screeningprogram mot tarmkreft er anbefalt fra EU siden starten av 2000-tallet4. I Norge har man så langt ikke hatt tilbud om screening. Imidlertid har Norge vært et foregangsland når det gjelder forskning på dette området med flere store randomiserte studier 5-8.
Screening mot tarmkreft gjør det mulig å oppdage kreft og forstadier til tarmkreft før symptomer oppstår. Tidligere diagnose vil kunne bedre prognosen og fjerning av forstadier vil kunne forhindre kreftutvikling. Men screening kan også påføre befolkningen unødvendige bekymringer og endoskopisk undersøkelse kan i sjeldne tilfeller medføre alvorlige komplikasjoner 9. En metaanalyse fra 2016 anga en perforasjonsfrekvens på 4 per 10.000 koloskopier og forekomsten av alvorlige blødinger på 8 per 10.000 prosedyrer ved primær koloskopiscreening 10.
Etiske utfordringer knyttet til screening generelt er sykeliggjøring av befolkningen, overdiagnostikk og overbehandling. Dette gjør seg også gjeldene i screening mot tarmkreft 11. Påvisning og fjerning av polypper vil kunne bidra til sykeliggjøring og overbehandling. Overdiagnostikk er trolig et mindre problem ved tarmscreening enn man har sett ved for eksempel brystkreftscreening.
Ved evaluering av et screeningprogram vil det også være utfordringer knyttet til seleksjon. Gruppen som velger å delta i screening antas å være forskjellig fra de som ikke deltar i slike programmer. Det er derfor viktig å planlegge evaluering av et screeningprogram samtidig som det innføres.
Det er pr i dag to aktuelle prinsipper for screening mot tarmkreft:
1. Endoskopi (sigmoidoskopi og koloskopi)
2. Test på usynlig blod i avføringen (FOBT, fekal okkult blod test)
I framtiden vil trolig andre screeningmetoder bli aktuelle. Langtidsresultater fra store randomiserte studier på sigmoidoskopi og guaiac basert FOBT (gFOBT) har vist redusert dødelighet av tarmkreft for gruppen som tilbys screening sammenlignet med de som ikke får et slikt tilbud12. For sigmoidoskopi er det også vist reduksjon i forekomst av tarmkreft 6 13-15. Imidlertid er effekten usikker for kvinner. 16-18
Siden 2012 har det pågått et screening-pilotprosjekt ved sykehus-ene i Moss og Bærum. Pilotprosjektet er designet som en randomisert effektstudie, der man sammenlikner sigmoidoskopi og immunokjemisk test på okkult blod i avføringen (iFOBT), figur 2. Endepunktet er tarmkreftmortalitet etter 10 års oppfølging. iFOBT er en kvantitativ test hvor terskelverdi for positiv test i pilotstudien er satt til 15 µg Hb/ g feces. Positiv sigmoidoskopi er definert som funn av polypp ≥ 1 cm, adenom med høygradig dysplasi eller villøsitet, ≥ 3 adenomer eller CRC. Individer med positiv screeningstest undersøkes med koloskopi.
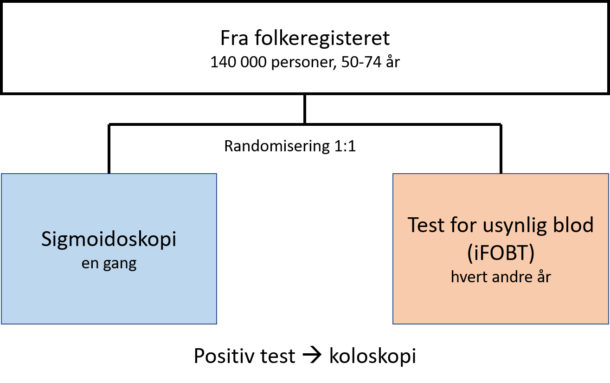
Figur 2. Pilotprosjektet – studiedesign.
Gjennom pilotprosjektet har vi fått nyttige erfaringer om organisering og gjennomføring av tarmscreening basert på endoskopi og test for usynlig blod i avføringen. En av forutsetningen for et vellykket screeningprogram er at flest mulig deltar. På bakgrunn av tilgjengelig litteratur var det forventet om lag 60 % deltagelse til screening med iFOBT og om lag 50 % oppmøte til sigmoidoskopi. Tall fra pilotprosjektet viser er dette målet er oppnåelig.
En av de største utfordringene i pilotprosjektet har vært gjennomføring av sigmoidoskopiene innenfor planlagt tidsramme. Inntil 25 undersøkelser pr dag på hvert av sentrene krever store ressurser både i form av personale og utstyr. Erfaringer med logistikk og kontinuerlig behov for opplæring av nye medarbeidere er viktig å ta med seg. En annen utfordring med sigmoidoskopi er at ikke alle har like god effekt av klyster-tømming. Dårlig tarmtømming er utilfredsstillende både for den som skal utføre undersøkelsen og deltakeren selv.
En viktig forutsetning for innføring av screening mot tarmkreft er at dette ikke går ut over behandling av andre pasienter. Kritikerne peker på manglende kapasitet i en allerede belastet helsetjeneste og at screeningtilbudet i sin ytterste konsekvens kan øke køene og hindre at syke får nødvendig helsehjelp. De siste 10-15 årene har det vært en enorm økning i antall kliniske koloskopier. I følge Norsk Pasientregister ble det i 2017 utført over 100 000 koloskopier ved helseforetak i Norge mot om lag 40.000 i 2007.
Innføring av pakkeforløp og systematisk screening vil medføre behov for gjennomgang av lokale rutiner for å håndtere det økte volumet og systematisk gjennomgang av pasienter som venter på undersøkelser. Erfaringene fra de to screeningssentrene som har deltatt i pilotprosjektet har vist at det totale behov for endoskopier øker med innføring av screening. Det blir ikke bare screeningskopier, men også betydelig flere koloskopi-kontroller. Dette innebærer at det er helt nødvendig med systematisk rekrutteringsarbeid av nye leger og sykepleiere til gastroenterologi-faget. Også for patologene vil arbeidsbelastningen øke, og flere nye spesialister trengs.
Utskifting av personale har vært en utfordring i prosjektet og behov for opplæring større enn først antatt. Øremerkede midler og strukturert opplæring i endoskopi vil være nødvendig for en vellykket utrulling av et nasjonalt screeningprogram.
Endoskopikvaliteten og kapasiteten er to avgjørende faktorer for å kunne implementere nasjonal screening. I en norsk koloskopistudie7 ble det vist at polypp deteksjonsraten varierer mellom endoskopører fra 10 til over 30 %, det er også er vist at 1 % økning i polypp deteksjon reduserer risiko for postkoloskopi kreft med om lag 3 % 19.
Data fra Gastronet (nasjonalt kvalitetsregister for endoskopi) viser at kvaliteten på norske koloskopier varierer. Det er derfor behov for å kvalitetssikre endoskopørene som deltar i et nasjonalt screeningprogram. Det ble i forbindelse med oppstart av pilotprosjektet bevilget midler til etablering av et regionalt senter for endoskopiopplæring.
Helse Sør-Øst, OUS, Kreftregisteret og screeningsentrene har i samarbeid etablert dette.
Endoskopiskolen baserer seg på et konsept fra Storbritannia hvor man i en årrekke har jobbet med å utvikle koloskopiteknikk samt pedagogiske prinsipper for undervisning av praktiske ferdigheter. En målsetning for endoskopiskolen er å sikre god endoskopiopplæring, godt teamarbeid og høy kvalitet på endoskopitilbudet i det nasjonale screeningprogrammet. Endoskopiskolen tilbyr nå kurs for ledere av endoskopienheter med hovedfokus på organisering og kvalitetssikring. I tillegg tilbys kurs for erfarne endoskopører for å forbedre koloskopiteknikk og koloskopiinstruktørkurs for å bli en bedre veileder.
Endoskopisskolens kongstanke er å utdanne endoskopiinstruktører slik at opplæringen lokalt blir mer effektiv, kvalitetssikret og ensartet, samt at den den totale opplæringskapasiteten øker.
Tidligere studier har antydet at deltagelse i screening medfører negativ endring i livsstil. En mulig forklaring er at de som får beskjed om at screeningtesten er normal – får et slags” helsesertifikat” som skaper falsk trygghet og senker motivasjon for å ta ansvar for egen helse og livsstil. I forbindelse med pilotprosjektet fikk Kreftregisteret i oppgave å se på om deltagelse i screening påvirker livsstil i negativ retning. Det ble gjort et omfattende arbeid for å undersøke dette i pilotprosjektet. Man kunne ikke påvise ugunstige endringer i livsstilsfaktorer ett år etter screeningdeltagelse 20.
En annen mulig negativ konsekvens av screening er at det kan tenkes å medføre økt angst i befolkningen. I pilotprosjektet har man derfor sett på dette i en spørreskjemabasert studie. Resultatet viste en økning i angstnivå for en liten gruppe, men at de fleste som deltok ikke hadde noen negativ psykologisk effekt av screeningdeltagelse. De fleste ville deltatt i screening mot tarmkreft igjen 21 22.
I 2017 kom den politiske beslutningen om innføring av et nasjonalt screen-ingprogram mot tarmkreft i Norge. Test på usynlig blod i avføringen (iFOBT) vil bli standard screening-metode. Valg av screeningtest baserer seg på forskningsresultater, helse-økonomiske analyser og erfaringer fra pilotprogrammet. Avføringstesten skal tilbys befolkningen hvert andre år fra 55 års alder, i inntil fem runder. Det er lagt føringer for at deler av programmet skal gjennomføres som en direkte sammenlignende studie med koloskopi. Innføring av tarmscreening i Norge vil derfor innføres på en forskningsbaret plattform noe som gir fleksibilitet og muligheter for endring underveis. Den «perfekte» screeningmetoden finnes ikke. I fremtiden kan ny og forbedret metodikk vil kunne erstatte dagens screening. Nye screeningtester vil da kunne sammenlignes direkte med standard screening innenfor det eksisterende programmet.
En gradvis utrulling av programmet over flere år har flere positive sider. Det vil være mulig å fortløpende gjøre endringer og justeringer underveis mot et fult utrullet program. I tillegg gir det tid til å få på plass de nødvendige ressurser. Det er de regionale helseforetakene som har fått ansvar for å tilrettelegge for utrulling av screening nasjonalt med hensyn til kapasitet og lokaliteter. Det kreves både oppdatert endoskopiutstyr, utbygging av undersøkelsesrom på screeningsentre og nye stillinger for både leger og sykepleiere som kan ivareta behovet for økt antall endoskopiske undersøkelser. Det er viktig at screening blir en integrert del av den totale virksomheten ved foretakene og ikke egne program med personell som bare utfører screeningundersøkelser. Dette vil kreve stor innsats fra alle og god forankring i ledelsen både på regionalt- og foretaksnivå.
Fekal okkult blod tester (FOBT).
gFOBT: Guaiac-basert test: Reagerer på hem. Skiller ikke mellom humant og animalsk blod og kostrestriksjoner er derfor nødvendig før testing. Kreves 3 prøver for tilstrekkelig sensitivitet og spesifitet. Evidens for at gFOBT reduserer tarmkreft dødelighet, men sannsynligvis ikke forekomsten.
iFOBT: Immunologisk test: Antistoff som binder seg til hemoglobin brukes for å detektere blod i avføringen. Kvantitativ test: Angir konsentrasjon av hemoglobin i feces. I et screeningprogram kan man velge en kostnadseffektiv terskelverdi. Spesifikk for humant hemoglobin, kostrestriksjon er derfor ikke nødvendig. Bedre spesifisitet og sensitivitet enn gFOBT med bare en prøve. Studier har vist bedre compliance enn gFOBT. Det foreligger ikke langtidsstudier for effekt på tarmkreft dødelighet/ forekomst. Sannsynligvis bedre til å avdekke store polypper enn gFOBT.