Medikamentell behandling av diabetes type 2 har vært gjennom en rivende utvikling de siste 5-10 år. Som et resultat av det amerikanske Food and Drug Administration (FDA) sitt krav fra 2008 om at alle nye diabetesmedikamenter skal kunne dokumentere kardiovaskulær sikkerhet, kommer stadig ny kunnskap som bidrar i dagens anbefalinger av medikamentell behandling. Artikkelen tar for seg siste nytt innenfor anbefalt behandling, hvordan man best mulig kan skreddersy diabetesbehandlingen for hver enkelt pasient med type 2 diabetes og bygger hovedsakelig på Nasjonal retningslinje for diabetes som ble lansert høsten 2016 (1).
Forebygging av hjerte- og karsykdom står sentralt i behandlingen av diabetes type 2. Risikoen for å dø av hjerte- og karsykdom hos diabetikere er økt i forhold til resten av befolkningen og kardiovaskulær død er fortsatt den vanligste årsaken til tidlig død hos pasienter med diabetes type 2 (2).
Tradisjonelt har medikamentell behandling av diabetes type 2 vært bruk av metformin som førstevalg og enten sulfonylureapreparat (SU) eller insulin som andrevalg. Dette var også anbefalingene i de norske retningslinjene fra 2009 (3).
Dokumentasjonen på bruk av metformin som førstevalg er hovedsakelig hentet fra studien UKPDS. Den viste at bruk av metformin gir redusert død og kardiovaskulær mortalitet hos overvektige med diabetes type 2 og mindre vektøkning og hypoglykemi enn insulin og SU. Gruppen som fikk metformin utgjorde imidlertid kun 342 pasienter, mens 951 kontroller fikk insulin eller SU (4). Den ble også utført i en tid hvor bruken av ACE-hemmere og statiner fortsatt ikke var utbredt. Det er senere gjort både metaanalyse (5) og Cochrane analyse (6), uten at data har vært gode nok til å konkludere med om metformin gir reduksjon av kardiovaskulær sykdom.
SU medikamenter har i flere eldre studier, blant annet nevnte UKPDS, vist god blodsukkersenkende effekt og god effekt på mikrovaskulære diabeteskomplikasjoner, men har heller ingen god dokumentasjon for kardiovaskulær sykdom eller død (6).
I 2007 ble det publisert en metaanalyse som viste økt risiko for å utvikle hjerteinfarkt og en ikke signifikant økning i død av kardiovaskulær sykdom ved bruk av Rosiglitazon (Avandia) (7). Metaanalysen medførte at FDA krevde at alle «nye» medikamenter til behandling av diabetes må vise at de ikke gir økt risiko for å dø av hjerte-kar sykdom. De stilte også en del krav til design av studiene.
Kravet fra FDA har medført betydelig økt kunnskap og mange vil påstå at medikamentell behandling av diabetes type 2 har gjennomgått et paradigmeskifte de seneste årene.
De viktigste medikamentgruppene finner du i tabell 1, sammen med de virkestoff og salgsnavn som foreløpig foreligger.
Virkemåte til de forskjellige diabetesmedikamentene baserer seg på kjente patofysiologiske prinsipper for diabetes type 2, se figur 1.
Metformin virker hovedsakelig ved å senke leverens mulighet for glukoneogenese og glykogenolyse, i tillegg vil man kunne få forsinket opptak av glukose i tarmen og økt perifer følsomhet for insulin.
SU-preparat stimulerer insulinsekresjonen via binding til ATP-avhengige kaliumkanaler i cellemembranen på betacellene i pancreas.
Inkretiner er hormoner som frigjøres fra tarmen når det tas opp karbohydrater og deles hovedsakelig opp i GLP-1 og GIP. Disse bidrar i hovedsak til å frigjøre insulin og hemme glukagon. GLP-1 analoger har samme virkning som kroppens GLP-1, mens DPP-4 hemmere senker nedbrytingen av kroppens GLP-1 og GIP, og gir lenger varighet av inkretinene.
Glitazoner gir økt insulinfølsomhet perifert.
SGLT-2 hemmere virker hoved-sakelig ved å øke nyrenes utskillelse av glukose.
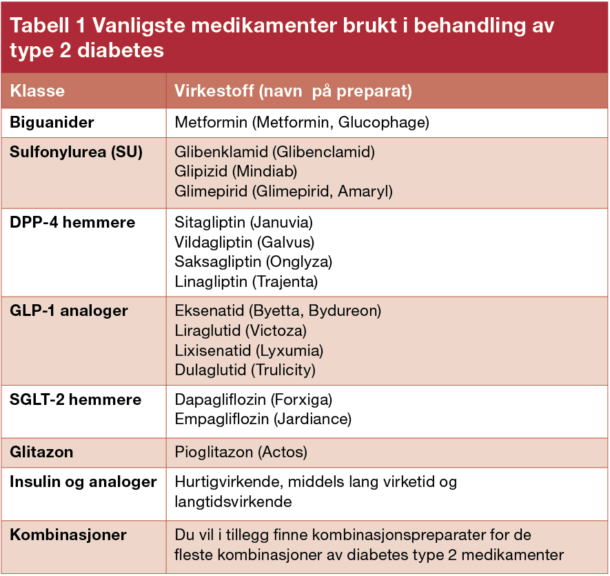
Tabell 1. Vanligste medikamenter brukt i behandling av type 2 diabetes
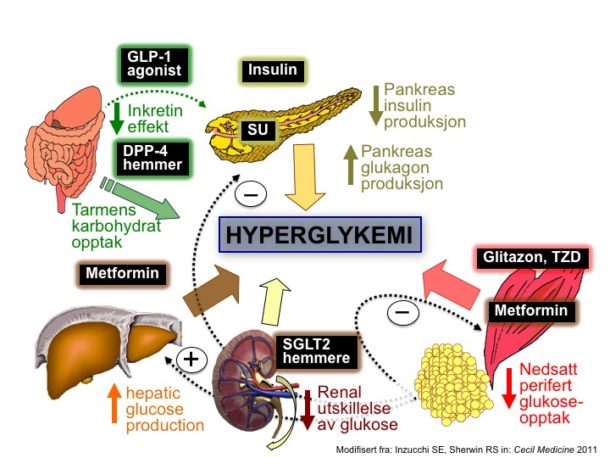
Figur 1: Virkningsmekanismer for de viktigste medikamentene til bruk ved diabetes type 2, basert på patofysiologiske mekanismer ved type 2 diabetes. (Modifisert figur basert på figur i Goldman Cecil medicin 2011 i kapittel om diabetes type 2 ved Inzucchi og Sherwin)
De siste årene er det publisert flere resultat fra større studier vedrørende kardiovaskulær sikkerhet for diabetes medikamenter.
Deltakerne har vært pasienter med diabetes type 2 med kjent kardiovaskulær sykdom eller økt risiko for dette, og de fleste studiene har i hovedsak hatt et primært endepunkt i form av en tre-punkts MACE (major cardiovascular events) som inkluderer kardiovaskulær død, ikke fatalt hjerteinfarkt og ikke fatalt hjerneslag. Der man har valgt en fire-punkts MACE har man inkludert ustabil angina som endepunkt. I tillegg finnes det i de fleste studiene en del sekundære endepunkter, som blant annet hjertesvikt. Preparatene har hovedsakelig blitt testet mot placebo (8).
Her følger en oversikt over de viktigste studiene:
SAVOR-TIMI-53 ble publisert i 2013 og omhandlet DPP-4 hemmeren Saxagliptin (Onglyza). Resultatene viste at preparatet ikke ga økning av tre-punkts MACE, men risikoen for innleggelse med hjertesvikt var noe økt (9).
TECOS omhandlet DPP-4 hemmeren Sitagliptin (Januvia), publisert i 2015. Denne viste sikkerhet i forhold til aktuelle endepunkter uten økt risiko for innleggelse med hjertesvikt (10). Dette har ført til at sitagliptin er foretrukket DPP4-hemmer i nasjonal retningslinje (1).
Noen studier har vist gunstig effekt på de aktuelle endepunktene. og størst oppmerksomhet har EMPA-REG-OUTCOME studien, som omhandler SGLT-2 hemmeren Empagliflozin, (Jardiance) fått (11). Publikasjonen fra 2015 viste at Empagliflozin reduserte de primære endepunktene, primært gjennom å redusere kardiovaskulær død.
At dette skyldes reduksjon i blodsukker er lite sannsynlig da man allerede etter få uker i studien ser denne tendensen.
Studien CANVAS/CANVAS-R, med SGLT-2 hemmeren canagliflozin, har vist liknende funn og resultatene tolkes i hovedsak som at effekten av SGLT-2 hemmerne på kardiovaskulære hendelser er en klasseeffekt (12). Canagliflozin er foreløpig ikke tilgjengelig i Norge og det er usikkert hvilken rolle det eventuelt vil få i retningslinjene etter at man i samme studie fant en økt risiko for amputasjon og frakturer.
Begge sistnevnte studier kunne også vise til redusert antall innleggelser med hjertesvikt i gruppen som fikk SGLT-2 hemmer.
• Også studier på GLP-1 analoger har vist lovende resultater, med reduksjon i kombinerte kardiovaskulære endepunkter for to av fire preparater. Av tilgjengelige preparat i Norge er det Liraglutid (Victoza) som har vist dette i LEADER-studien (13). Grunnet sprikende resultat for de forskjellige preparatene er det noe mer usikkert om resultatene også her tyder på en klasseeffekt for GLP-1 analoger.
Tabell 2 viser en oppsummering av kardiovaskulære sikkerhetsstudier som foreligger så langt. Både for liraglutide (LEADER) og empagliflozin (EMPA-REG-OUTCOME) tyder analyse av sekundære endepunkter på mindre utvikling av betydelig albuminuri ved bruk av disse medikamentene. Empagliflozin viste i tillegg mindre økning i kreatinin og mindre utvikling av terminal nyresvikt, men inkluderte ikke pasienter med eGFR under 30, som studien for liraglutid gjorde (14,15).
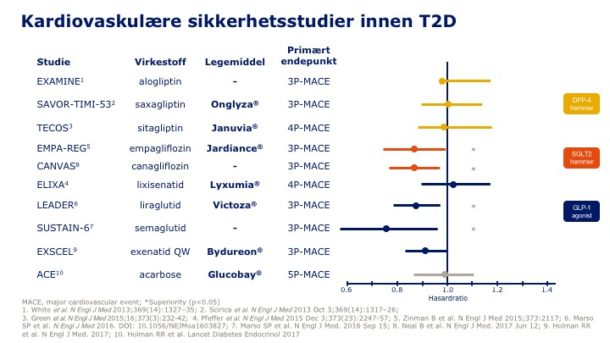
Tabell 2 Oversikt over resultat fra kardiovaskulære studier inntil nylig publisert. Der kun angitt virkestoff og ikke legemiddel er preparatet fortsatt ikke tilgjengelig i Norge. (Tabell laget av Trond Methi, basert på angitte kilder, tillatelse til bruk innhentet fra Trond Methi)
Kapittelet i nasjonal retningslinje for diabetes som omhandler medikamentell behandling baserer seg i hovedsak på tidligere kunnskap, erfaring man har med medikamentene og de siste års studier.
Metformin kommer både nasjonalt og internasjonalt fortsatt ut som førstevalg. Nytt i nasjonal retningslinje fra 2016, sammenliknet med 2009, er anbefaling rundt andrevalgs medikament.
Som man kan se av samme tabell 3 sidestiller man nå flere medikamentgrupper, og man deler også inn slik at man for hver medikamentgruppe vurderer fordeler og ulemper ut fra angitte kriterier.
Ved behov for et tredje medikament skal man hovedsakelig også velge fra angitte tabell. (Tabell 3)
Det er i hovedsak fire momenter man må ta stilling til ved vurdering av diabetesmedikamenter:
Tanken er at man skal «skreddersy» behandling best mulig for hver enkelt pasient.
I nasjonal retningslinje for diabetes anbefaler man nå «intensivert blodsukkersenkende behandling tilpasset den enkelte pasient». Det vil i praksis si mål for de fleste om HbA1c rundt 7% (53 mmol/mol), mens man hos dem med lang sykdomsvarighet, mye komorbiditet eller risiko for hypoglykemi, godt kan legge seg mellom 7-8 % (53-64 mmol/mol) (1).
Ved nyoppdaget diabetes type 2 der livsstilsintervensjon ikke gir tilstrekkelig effekt på blodsukker, er metformin førstevalg. Dersom maks dose metformin ikke gir ønsket HbA1c, bør man fortrinnsvis legge til et medikament som passer med ønsket blodsukkerfall. GLP-1 analoger og SU forventes å senke blodsukker noe mer enn DPP-4 hemmere og SGLT-2 hemmere. Alternativt kan man vurdere å legge til to medikament for bedre reduksjon av blodsukker.
Insulin står fortsatt som et alternativ ved valg av preparat etter metformin og vil hovedsakelig ha indikasjon dersom man ikke kommer i mål med ønsket HbA1c ved annen behandling eller dette er kontraindisert. Det anbefales da oppstart med basalinsulin til kveld. De fleste kan behandles med NPH-insulin (Insulatard, Humulin), men utvalgte pasienter kan ha nytte av langtidsvirkende analog, særlig ved nattlig hypoglykemi eller for kort virketid for NPH-insulin.
Et alternativ til medikamentene nevnt i tabell 3 er Pioglitazon, som virker godt ved høy insulinresistens.
Ved høy HbA1c på diagnosetidspunkt kan man også vurdere å starte opp med to medikamenter allerede ved debut, i en del tilfeller må også oppstart med insulin vurderes, da gjerne NPH-insulin morgen og kveld.
For de aller fleste med diabetes type 2 er vektreduksjon et mål. GLP-1 analog og/eller SGLT-2 hemmer er da gode andrevalg. For GLP-1 analoger forventes i snitt en vektreduksjon på 2-4 kg i løpet av 3-6 måneder, for SGLT-2 hemmere i snitt 2 kg i samme tidsrom. Basert på virkningsmekanisme framstår en kombinasjon av disse som gunstig, men sikkerhetsdata for dette er fortsatt noe mangelfull. Kombinasjonen er pr dags dato eneste for antidiabetika som ikke er godkjent for blåresept. For SU kan man forvente en vektøkning på 1-3 kg første året.
Dersom det er viktig å unngå hypoglykemi bør man vurdere alternativer til SU og insulin. Dette gjelder som oftest for pasienter med komorbid sykdom der det ansees viktig å unngå hypoglykemi, som for eksempel hjerte og karsykdom eller nyresvikt, eller rent praktisk der yrke innebærer spesiell risiko dersom alvorlig hypoglykemi. Man kan i slike tilfeller noen ganger bevisst legge seg noe høyere i HbA1c, med noe økt risiko for senkomplikasjoner, men for å minimere risikoen for hypoglykemi.
GLP-1 analoger og SGLT2-hemmere er vist gunstig med tanke på kardiovaskulære endepunkter og ett av disse bør inkluderes tidlig hos diabetikeren med kjent hjerte- og karsykdom. For tilgjengelige GLP-1 analoger gjelder dette foreløpig kun liraglutid. Vi venter fortsatt på studier for kardiovaskulære hendelser for pasienter uten kjent hjerte- og karsykdom fra før.
Dersom kjent hjertesvikt bør man unngå preparat som saxagliptin og pioglitazon (16) og heller velge empagliflozin, som ga mindre innleggelser for hjertesvikt (11).
Siste års studier tyder også på at man tidlig bør vurdere empagliflozin eller liraglutid for å forhindre progredierende albuminuri.
Den kanskje viktigste begrensende faktoren ved medikamenter brukt ved diabetes type 2 er nyrefunksjon. For oversikt viser jeg til tabell 4, men det er verdt å presisere at metformin i utgangspunktet ikke skal startes ved eGFR under 45 ml/min/1,73 m2, men kan brukes i lav dose ned til verdi på 30. Ved eGFR <30 blir risikoen for laktacidose betydelig.
SGLT-2 hemmere er ikke anbefalt initiert ved eGFR under 60, kan brukes ned til eGFR på 45 dersom i bruk fra før, men dette er ut fra et perspektiv om at medikamentet da ikke lenger har blodsukkersenkende effekt. Det er også verdt å nevne at Victoza nå er godkjent brukt ned til eGFR på 15 (14).
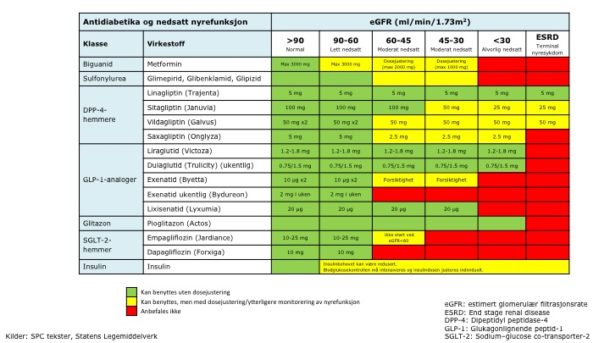
Tabell 4 Diabetes medikamenter og nedsatt nyrefunksjon. (Original tabell laget av Trond Methi, oppdatert etter tillatelse fra Trond Methi.) Kilder: SPC tekster, Statens Legemiddelverk
Det finnes ingen råd i nasjonal retningslinje som forteller når man eventuelt bør legge inn pasienter med mistanke om nyoppdaget diabetes type 2. Ved Stavanger Universitetssykehus har vi sammen kommet fram til veiledende råd om å legge inn pasienter med fastende blodsukker over 20 mmol/L eller tilfeldig blodsukker over 30 mmol/L, men at man uansett i hvert tilfelle må vurdere i samråd med innleggende lege.
Ved kjent medikamentelt behandlet diabetes type 2 og innleggelse for annen tilstand må man alltid ta stilling til videre bruk av diabetes medikamenter.
Ved bruk av metformin bør man tenke på alle tilstander som kan bidra til laktacidose, som forverring av nyrefunksjon, dehydrering, tilstander med hypoxi, leversvikt og sepsis. Man bør i tillegg vurdere å nulle metformin dersom planlagt undersøkelse innebærer bruk av kontrastvæske og for dette bør det finnes retningslinjer ved alle sykehus.
Sulfonylurea har lang virkningstid og bør vurderes nullet om risiko for hypoglykemi, mens de andre preparatene bør vurderes nullet hovedsakelig ved komorbide tilstander som kan forverres på grunn av kjente bivirkninger av preparatene.
SGLT-2 hemmere bør seponeres dersom diabetisk ketoacidose, mens saxagliptin og pioglitazon bør seponeres dersom hjertesvikt.
Ved nulling av antidiabetika må behandlingen ofte erstattes med insulin.
Med web-baserte nye nasjonale retningslinjer ligger det til rette for at retningslinjene oppdateres jevnlig ut fra ny kunnskap.
American Diabetes Association, ADA, har nylig kommet med nye anbefalinger hvor siste års studier i enda større grad er tatt hensyn til, spesielt når det gjelder anbefaling av andre-valgs medikament ved kjent hjerte- og karsykdom og nefropati.
Tabell 5 oppsummerer noen fordeler og ulemper ved de forskjellige medikamentgruppene ut fra nyere studier.»

Tabell 5: Fordeler og ulemper, hva bør man ta hensyn til når man velger medikament.
(Tabellen er modifisert på tabell fra litteratur referanse nr. 17.)
Man forventer at en oppdatering av norske anbefalinger også sterkere vil anbefale spesifikt andre-valgs medikament, blant annet ut fra komorbiditet, spesielt ved kjent kardiovaskulær sykdom og/eller diabetes nefropati.
Det finnes også etter hvert nye kombinasjonspreparater med god dokumentasjon, som for eksempel kombinasjonen av insulin degludec og liraglutid, Xultophy (18) og kombinasjonen linagliptin og empagliflozin, Glyxambi (19), som foreløpig ikke nevnes spesifikt i retningslinjene.
Mer bekreftelse på om reduksjon i kardiovaskulær død er en klasseeffekt for SGLT-2 hemmere får man gjerne når DECLARE-studien, som omhandler SGLT-2 hemmeren Dapagliflozin (Forxiga), publiseres, forhåpentlig i løpet av 2019. I motsetning til EMPA-REG-OUTCOME, der 99% av deltakerne hadde kjent kardiovaskulær sykdom, har her kun 40 % av deltakerne kjent kardiovaskulær sykdom, mens de resterende 60 % av deltakerne kun har økt kardiovaskulær risiko. Studien vil derfor kunne bidra til svar på om SGLT2-hemmerne også har forebyggende effekt på kardiovaskulære hendelser hos dem uten kjent kardiovaskulær sykdom fra før.
Foreløpig har to av fire GLP-1 analoger vist å kunne gi redusert kardiovaskulær sykdom og død. I REWIND studien får vi se effekten av en femte, Dulaglutid (Trulicity).
Som nevnt tidligere er kombinasjonen av GLP-1 analog og SGLT-2 hemmer foreløpig eneste kombinasjon som ikke er godkjent for blåresept ordningen. Dette kommer hovedsakelig av manglende sikkerhetsdata, men en studie er allerede publisert (20) og flere andre er på trappene, slik at også dette trolig vil nevnes mer spesifikt i retningslinjene etter hvert.
Videre blir det også spennende å se svar på studier som er startet på SGLT-2 hemmere i forhold til kardiovaskulære endepunkter hos pasienter med hjertesvikt, både med og uten bevart ejeksjonsfraksjon, og med og uten kjent diabetes. I tillegg kommer studier på disse medikamentene i forhold til bruk ved kronisk nyresvikt og utvikling av dette, både hos diabetikere og ikke-diabetikere.
En studie som sammenlikner linagliptin med glimepirid ventes også svar på snarlig og kanskje får vi endelig bedre svar på hvordan SU-preparat påvirker harde endepunkter.
Framtidige studier vil trolig innebære lenger varighet, populasjoner med lavere risiko for hjerte-kar sykdom og mer standardiserte protokoller som det er lettere å sammenlikne. Man får også trolig flere head to head studier der forskjellige medikamenter sammenliknes direkte (8).
Det vil utvilsomt bli spennende å følge utviklingen også de nærmeste årene, og forhåpentligvis vil det bidra til at hver enkelt pasient får en best mulig behandling for sin diabetes type 2.
Den generelle indremedisiner og spesialister i andre grenspesialiteter vil i sin hverdag stort sett daglig møte pasienter med diabetes, og da spesielt diabetes type 2. Til enhver tid vil rundt 15-20 % av inneliggende pasienter på et sykehus ha kjent eller ikke erkjent diabetes (21).
Å fange opp flest mulig, for eksempel ved å ta en HbA1c på alle pasienter med hjerteinfarkt eller bare å måle HbA1c hos pasienter med kjent diabetes, kan bidra til en bedre behandling for den enkelte pasient.
Takk til kollegaer Siri Carlsen og John Cooper for gode innspill
Interessekonflikter:
Holdt foredrag i regi av Boeringer Ingelheim, Lilly, Novo Nordisk, Sanofi
Artikkelteksten ble i utgangspunktet skrevet like før de nyeste ferske anbefalinger, men at vi har valgt å inkludere den nye anbefalingen i tabellform (tabell 3).
Referanser
1 Helsedirektoratet, Nasjonal faglig retningslinje for diabetes. https://helsedirektoratet.no/retningslinjer/diabetes
2 Rawshani A, Rawshani A, Frantzen S, et al. Mortality and cardiovascular disease in type 1 and type 2 diabetes. N Eng J Med. 2017;376:1407-18
3 Helsedirektoratet, Nasjonal faglig retningslinje for forebygging, diagnostikk og behandling av diabetes» fra 2009.
4 UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34) Lancet 1998 352(9131):854–65
5 Bennett WL, Maruthur NM, Singh S, et. al. Comparative Effectiveness and Safety of Medications for Type 2 Diabetes: An Update Including New Drugs and 2-Drug Combinations. Annals of Internal Medicine 2011; 154(9): 602-613
6 Hemmmingsen B, Lund SS, Gluud C, et al. Targeting intensive glycaemic control versus targeting conventional glycaemic control for type 2 diabetes (Review). The Cochrane Library 2013, Issue 11.
7 Nissen SE, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med 2007 Jul 5;357(1):100.
8 Cefalu, WT, Sanjay K, Gerstein HC, et al. Cardiovascular Outcomes Trials in Type 2 Diabetes: Where Do We Go From Here? Reflections From a Diabetes Care Editors Expert Forum. Diabetes Care 2018;41: 14-31
9 Scirica BM, Bhatt DL, Braunwald E, et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med 2013;369:1317-26
10 Green JB, Bethel MA, Armstrong PW, et al. Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2015;373:232-42
11 Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015;373:2117-28
12 Neal B, Perkovic V, Mahaffey KW, et al. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med. 2017;377:644-57
13 Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2016;375:311-22
14 Mann JFE, Ørsted DD, Brown-Frandsen K, et al. Liraglutide and Renal Outcomes in Type 2 Diabetes N Engl J Med 2017 Aug 31;377(9):839–48.
15 Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med 2016;375:323-34
16 Dormandy JA, Charbonnel B, Eckland DJ, et al. Secondary prevention of macrovaskular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events) : a randomised controlled trial. Lancet. 2005 Oct 8 ;366 (9493):1279-89
17 Position Statements 8. Pharmacologic Approaches to Glycemic Treatment: Standards of Medical Care in Diabetes—2018 American Diabetes Association, Diabetes Care 2018 Jan; 41(Supplement 1): S73-S85.
18 Lingvay I, Perez Manghi F, Garzia-Hernandez P, et al. Effect of Insulin Glargin Up-Titration vs Insulin Degludec/Liraglutide on Glycated Hemoglobin Levels in Patients With Uncontrolled Type 2 Diabetes: The DUAL V Randomized Clinical Trial. JAMA 2016.Mar 1;315(9):898-907
19 DeFronzo RA, Lewin A, Patel S, et al, Combination of empagliflozin and linagliptin as second-line therapy in subjects with type 2 diabetes inadequately controlled on metformin. Diabetes Care 2015 Mar 38 (3): 384-93
20 Frias JP, Guja C, Hardy E, et al. Exenatide once weekly plus dapagliflozin once daily versus exenatide or dapagliflozin alone in patiens with type 2 diabetes inadequately controlled with metformin monotherapy (DURATION-8): a 28 week, multicenter, double blind, phase 3, randomized controlled trial, The Lancet Diabetes and endocrinology. 2016;4 (12): 1004-16.
21 Julsrud TB, Tazmini K, Sundnes MJ og Sharma A: Nasjonal Veileder i Endokrinologi, “Behandling av blodsukker i sykehus” Dato publisert: 07.03.2018