Utredning ved mistanke om sykdom i lever og galleveier går fra anamnese, klinisk undersøkelse og biokjemiske blodprøver til bildediagnostikk og invasiv diagnostikk. Bildediagnostiske metoder er viktige ved hepatologiske problemstillinger, og aktuelle metoder er ultralyd, CT, ERCP, MR, MRCP og PTC. I denne artikkelen vil vi gå nærmere
inn på ultralydmetoder som diagnostiske verktøy innen hepatologien.
Ultralydundersøkelsen er ofte den første bildediagnostiske tilnærmingen ved mistanke om sykdom i lever- og galleganger. Ultralyd (UL) kan utføres pasientnært, i akuttmottak eller på sengepost, og kan ofte raskt avklare spørsmål om patologi. Legen som utfører undersøkelsen må ha teoretisk opplæring og praktiske erfaringer med metoden [1].
Det er anbefalt at pasienten er fastende i minimum 3-4 timer før utførelse av ultralydundersøkelse av øvre abdomen. Dette gir best avbildning av galleblæren (maksimal distensjon) og bedrer bildekvaliteten ved leverundersøkelsen fordi magesekken er tom og uten luft og mat som forstyrrer ultralydbildet. Dette er det optimale for en fullgod undersøkelse av lever og galletreet, men kan fravikes i akuttsituasjoner.
Pasienten undersøkes i ryggleie. Ved tarmgass og adipositas kan imidlertid sideleie gi bedre innsyn. En kan også be pasienten puste dypt inn for å fremstille hele leveren bedre. Ved skanningen benyttes vanligvis en kurvilineær ultralydprobe (C-probe) med frekvens fra 3-7 MHz. Jo høyere frekvens en ultralydprobe har, desto bedre fremstilles detaljer nær proben, på bekostning av bildekvaliteten i dybden. Derfor egner lineære høy-frekvente ultralydprober (L-probe) seg for eksempel bedre til å fremstille detaljer ved leverkapselen.
B-mode betyr brightness mode. Ved B-mode vurderer man hvor mye ekko som gjengis fra det vevet en undersøker, og det er B-mode bildet vi kjenner som det vanlige, 2-dimensjonale gråtonebildet ved UL avbildning. Fargedoppler (Color Flow; CF) kan benyttes for å skille mellom blodkar og galleganger. Fargedoppler brukes også til å vurdere om blodstrømmen har riktig retning, mens med pulset dopplerfunksjon (Pulse Wave; PW) kan man i tillegg vurdere blodets strømningshastighet.
Leveren er et stort organ, og ved en UL undersøkelse er det derfor viktig at man skanner hele organet systematisk og i minst to anatomiske plan. Dette krever god øye-hånd-koordinasjon. Sentrale landemerker benyttes til å orientere seg i leveren; konfluensen av levervenene, hilus med portalvene og galleblæren.
En normal lever kan variere i størrelse og form, men er oftest pyramideformet. Kapseloverflaten er jevn og glatt, leverkanten er spiss og ekkostrukturen er jevn. Leverparenkymet har en homogen struktur uten fokale forandringer, men med tydelige karstrukturer. Levervenene har en skarp vinkel og tynn vegg, noe som gir nærmest fravær av vegg-ekko, mens vena porta har et kraftig veggekko. Gallegangene forløper langs med portalvenen, og er normalt ikke synlige ved UL undersøkelse hos friske.
Sammenligner man ekkotettheten mellom nyreparenkym og leverparenkym vil denne være nesten lik hos en frisk pasient, mens det normale nyreparenkymet vil fremstå betydelig mørkere sammenliknet med leverparenkymet hos en pasient med leversteatose. (se Bilde 1) Steatose kan også kvantifiseres med ultralyd ved å måle nivået av gråtoner (echo levels) i ulike dybder i leverparenkymet [2]. Se Bilde 2.
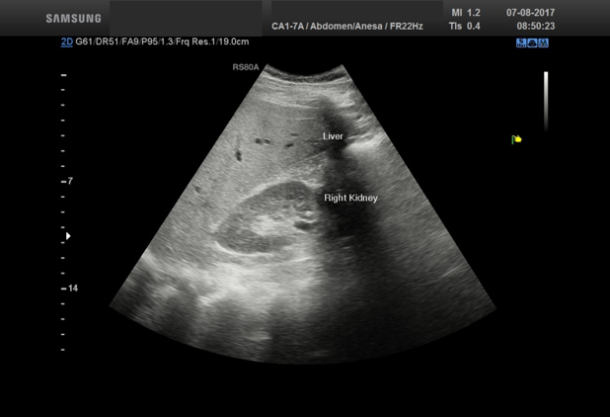
Bilde 1: Hos en pasient med leversteatose vil det friske nyreparenkymet ha en mørkere ekkotetthet sammenlignet med leverparenkymet.
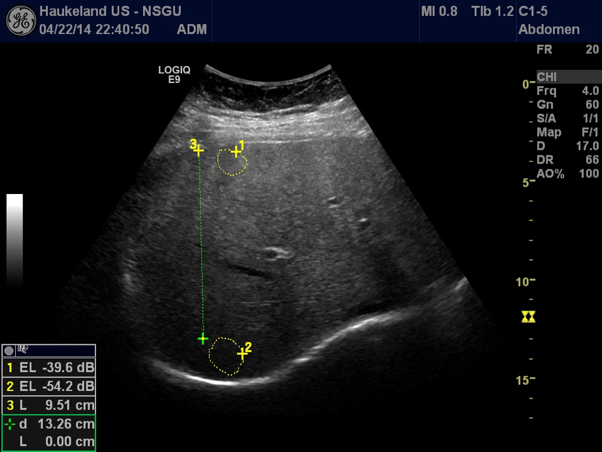
Bilde 2: Kvantifisering av steatose i leveren kan gjøres ved å måle nivået av gråtoner (Echo Levels, EL) EL er markert med gule sirkler i to ulike dybder (1 og 2). Differansen mellom dem, 14.6 dB er et uttrykk for attenuasjonen, og kan brukes som mål på leversteatose.
Leverstivhetsmålinger med elastografi har de siste årene erstattet behovet for leverbiopsi for å kvantifisere fibrosegrad. Elastografi benyttes i økende grad for å evaluere prognose, eller for å ta beslutninger om oppfølging og behandling ved ulike leversykdommer [3-5]. Leverstivhetsmålinger korrelerer med histologisk fibrosegrad, og predikerer prognose ved flere leversykdommer [6, 7].
Elastografi er en fellesbetegnelse på flere beslektede ultralydmetoder som måler, eller visualiserer, levervevets stivhet non-invasivt [8]. De mest benyttede metodene for leverstivhetsmåling er transient elastografi (TE, Fibroscan), point shear wave elastografi (pSWE) og 2D-shear wave elastografi (2D-SWE) [9]. Ved å bruke ultralyd måler metodene skjærebølgers hastighet gjennom levervevet. Jo raskere bølgene beveger seg, desto stivere er leveren. I klinisk praksis representerer medianverdien av 10 leverstivhetsmålinger leverens stivhet, så lenge raten av ugyldige målinger er under 40%, og variasjonen i målingene er innenfor en bestemt grense (IQR/median < 30%) [10]. Elastografi har ikke kjente bivirkninger, gir ikke smerter eller ubehag og oppleves som en vanlig ultralydundersøkelse for pasientene. Ved utførelse av elastografi bør pasienten faste i minimum 3 timer før undersøkelsen, da matinntak kan føre til falsk forhøyet leverstivhet [11].
Ulike elastografimetoder gir imidlertid ulike estimat for leverstivhet i en og samme lever [9]. Grensene mellom fibrosegrader i levervevet må derfor tolkes ut i fra den metoden som er benyttet. I en nylig publisert studie undersøkte vi normal leverstivhet i en frisk norsk populasjon, og fant at leverstivheten målt ved GE 2D-SWE var høyere enn ved Samsung pSWE (4.5±0.8 kPa vs. 4.1±0.8 kPa). Videre fant vi høyere leverstivhet hos friske menn enn hos kvinner, men ingen signifikant forskjell mellom ulike BMI- eller aldersgrupper. Det var ingen signifikant forskjell i median leverstivhet (LS) ved 10 og 5 målinger, og disse funnene kan tyde på at leverstivhet basert på 5 leverstiv-hetsmålinger gir samme resultat som 10 målinger hos leverfriske [12].
Transient Elastografi (TE)
TE var en av de første metodene, og benevnes i dag som den non-invasive gullstandarden. TE er markedsført som Fibroscan, et eget apparat for leverstivhetsmåling med innebygde kvalitetsparametre for de 10 målingene som skal til for beregning av median leverstivhet. Ved leverstivhetsmåling med TE gir en mekanisk puls fra et stempel på ultralydprobens overflate opphav til skjærebølger som passerer interkostalt i probens lengderetning, og inn i leveren. Leverstivhetsmålingen uttrykkes i kiloPascal (kPa). Metoden er forholdvis enkel å lære, men krever at undersøkeren er sertifisert og har fått opplæring. Imidlertid kommer metoden til kort hos mange overvektige pasienter, pasienter med ascites og trange interkostalrom. Fibroscan har ikke mulighet for B-mode skanning, og man kan derfor ikke kontrollere at pasienten er fastende ved galleblæremåling. Måltid inntatt mindre enn tre timer før elastografi kan i noen tilfeller bidra til overestimering av leverstivheten [11].
Point shear wave (pSWE) og 2-dimensjonal shear wave elastography (2D-SWE)
pSWE og 2D-SWE er integrert i ultralydapparater med mulighet for å kombinere leverstivhetsmåling med en fullstendig UL undersøkelse. Ved disse elastografimetodene skapes skjærebølgene av en eller flere akustiske pulser som sendes inn i levervevet. Undersøkeren kan fritt bestemme måleområdet i et gråtonebilde. Det er viktig at måleområdet er fritt for kar og galleganger, og at det er minimum 2 cm under leverkapselen, da disse strukturene kan føre til feilmålinger av leverstivheten. Måleboksen ved pSWE er ikke regulerbar i størrelse, mens den ved 2D-SWE er regulerbar og større. En annen forskjell er at 2D-SWE visualiserer leverstivheten i et større område i form av en fargekode som er lagt oppå gråtonebildet, i tillegg til kvantitativ stivhetsmåling hvor som helst innenfor det fargede området. Leverstivhetsmålingen ved pSWE og 2D-SWE kan uttrykkes både i skjærebølgehastighet meter per sekund (m/s) og kPa.
Kontrastforsterket ultralydundersøkelse (CEUS)
Dersom man finner fokale lesjoner ved konvensjonell B-mode ultralyd, er det ofte behov for å karakterisere lesjonen nærmere. Dette kan gjøres umiddelbart med kontrastforsterket ultralyd. Ved kontrastforsterket ultralyd benytter man et intravenøst kontrastmiddel bestående av mikrobobler som gir en diagnostisk tidsramme på 5-30 minutter. Vi skiller mellom tre faser som er relatert til leverperfusjonen, henholdsvis arteriell fase (0-30 sekund), portal fase (30-120 sekund), sinusoidal/parenkymatøs/senfase (2-4 minutt). Kontrastmønsteret i disse tre fasene varierer mellom ulike tilstander. I Norge har vi to ulike kontrastmidler tilgjengelig for kontrastforsterket ultralyd: Sonovue (svovel-hexafluoride) og Sonazoid (perfluorobutan). Disse brukes mye om hverandre, og hver av dem har sine fordeler.
Content goes hereIndikasjon for kontrastultralyd:
• Deteksjon av fokale lesjoner
• Karakterisering av fokale lesjoner
• Karakterisering av noduler ved kronisk hepatitt og cirrhose
• Guiding ved biopsitaking • Guiding ved intervensjon
Sonovue er et rent intravaskulært kontrastmiddel som ikke beveger seg ekstravasalt eller tas opp i celler. Sonazoid derimot, gir en «ekstra postvaskulær fase» som varer i opptil 30 minutter i levervev grunnet opptak i kupfferceller, som er leverens makrofager. Mikroboblene er mer robuste, det vil si at det skal mer energi til for å ødelegge disse mikroboblene, noe som betyr at man kan skanne med høyere mekanisk indeks (MI) over en lengre periode. Dette er en fordel ved visse tilstander hvor en ønsker å undersøke med høyere frekvens og/eller over lengre tid, som eksempelvis ved små levermetastaser, der kontrasten vaskes ut, mens den varer lenger i omliggende levervev.
Sonovue har mikrobobler som er lettere å ødelegge. Dette kan i blant være en fordel fordi det er lettere å knuse boblene med en akustisk puls for deretter å se hvordan mikroboblene fyller seg tilbake i vevet i en lesjon («replenishment»). Dette kan eksempelvis være til hjelp dersom en ønsker å skille mellom fokal nodal hyperplasi (FNH) og adenom, og en ikke har lyktes å se det tydelig i arteriefasen. I slike tilfeller kan en trykke på flash-knappen, da knuses boblene og en får en refilling (kvasi-arteriefase) som gir en mulighet til å studere detaljene på nytt i sann tid.
En viktig klinisk problemstilling er undersøkelse av cirrhotisk lever ved mistanke om hepatocellulært karsinom. Halvårlig screening med alfa-føtoprotein (AFP) og ordinær ultralyd anbefales, men har begrenset sensitivitet. Her kan det være nyttig å legge til kontrastforsterket ultralyd dersom man oppdager en fokal lesjon for å kunne skille mellom regenerasjonsknuter og hepatocellulære karsinom. Den europeiske foreningen for medisinsk ultralyd (EFSUMB) har i sine retningslinjer gitt oversiktlige anbefalinger for fortolkning av resultater for de ulike lesjonstypene i ulike faser [13]. Nasjonal kompetansetjeneste for gastroenterologisk Ultralyd (NSGU) har også utarbeidet nyttige videoer om undersøkelsesteknikk [14].
Antallet leverbiopsier er blitt sterkt redusert etter innføringen av CEUS og elastografi. Indikasjonene for leverbiopsi er ofte relative, og det er tilstander som resulterer i behandlingsmessige og/eller prognostiske konsekvenser. Leversykdommer som ofte leder til leverbiopsi er mistanke om autoimmun hepatitt (AIH), primær biliær cholangitt (PBC), rejeksjon etter transplantasjon og akutt leversvikt. Til tross for fremskritt i diagnostisk serologi og radiologiske teknikker, anses leverbiopsi fortsatt som gullstandard ved mange leversykdommer. Dette til tross for at en biopsiprøve kun representerer ca. 1/45 000 av leveren, og at ”sampling error” kan forekomme.
Leverbiopsi kan gjennomføres perkutant, transvenøst og lapraskopisk. Perkutan leverbiopsi kan gjennomføres blindt, ultralydveiledet eller ultralydassistert. Ved biopsitakingen er det to ulike biopsinåler som benyttes: Tru Cut og Menghini. Disse kan benyttes manuelt eller automatisk ved bruk av en såkalt biopsipistol. Menghini-metoden er den mest brukte i verden og gjøres oftest UL assistert, ved at man først bruker UL og markerer egnet innstikksted for deretter å stikke ”blindt”. En nederlandsk studie sammenlignet manuell biopsitaking og biopsitaking med pistol, og konkluderte med at pistolbiopsi var fordelaktig hos leger med ingen eller begrenset erfaring med leverbiopsitaking [15].
Det er flere kontraindikasjoner for transkutan leverbiopsi, blant annet pasienter som ikke samarbeider, har økt blødningsfare, ascites og/eller dilaterte galleveier ved punksjonsstedet. Ved høy INR og blødningsfare kan en gjennomføre en transvenøs biopsi via vena cava. Denne undersøkelsen utføres vanligvis av intervensjonsradiologer. Den vanligste komplikasjonen ved leverbiopsi er lokale smerter. Andre komplikasjoner er blødning, hvor subkapsulære og intrahepatiske blødningene oftest er selvbegrensede, mens blødning ut i bukhulen kan være livstruende. Videre komplikasjoner som kan oppstå er pneumothorax og galleblæreperforasjon.
Ultrasonografi med sine ulike modaliteter, CEUS og elastografi er blitt en helt sentral del av diagnostikken ved leversykdommer [16]. Det optimale er om hepatologen, som kjenner pasientens sykehistorie, kliniske funn samt biokjemiske resultater utfører ultralydundersøkelsen selv, og dermed raskt kan planlegge videre utredning og behandling. På sikt vil non-invasive bildemarkører og andre biokjemiske biomarkører erstatte flere leverbiopsier, og brukes som verktøy til å ikke bare diagnostisere, men også følge utvikling og prognose ved kroniske leversykdommer [17].
Sjekkliste ved sykdomsfokusert ultralyd av lever:
• Leverstørrelse
– Kvinner: 12-15 cm
– Menn: 13-16 cm
• Leverkapsel
– Jevn og glatt?
• Foreligger ascites?
• Leverparenkymogekkostruktur
– Homogen?
– Økt ekkotetthet?
– Fokale lesjoner?
• Normal diameter på blodkar
– Levervener
– Vena porta
– Arteria hepatica
• Doppler: Riktig retning av flow i portvenen (reversert flow?)
• Galleblære
– Konkrementer? Polypper?
– Økt galleveggtykkelse? ( Normal:<2-3mm)
• Utvidet ductus choledochus? (Normal:<6mm)
– Utvidede intra- og ekstrahepatiske galleganger?
• Forstørret milt?
(Normal: < 12 cm)
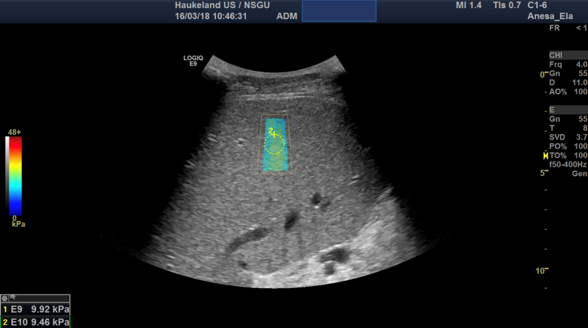
Bilde 3: Leverstivhetsmåling utført med 2D-SWE fra GE E9. Fargekodet boks viser måleområdet, fargekoden vises til venstre, hvor rødt er stivt og blått er mykt. Den stiplete gule sirkelen angir sted for stivhetsmåling, og kan flyttes til ønsket område innenfor det fargede området. Resultatet er angitt i kPa og vises i nedre venstre hjørne.
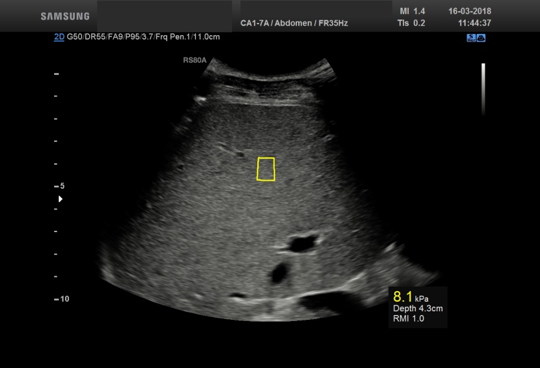
Bilde 4: Leverstivhetsmåling utført med pSWE fra Samsung RS80A med Prestige på samme pasient som i bilde 3. Den gule boksen viser måleområdet og er stedet for måling. Resultatet er angitt i kPa og vises i nedre høyre hjørne.
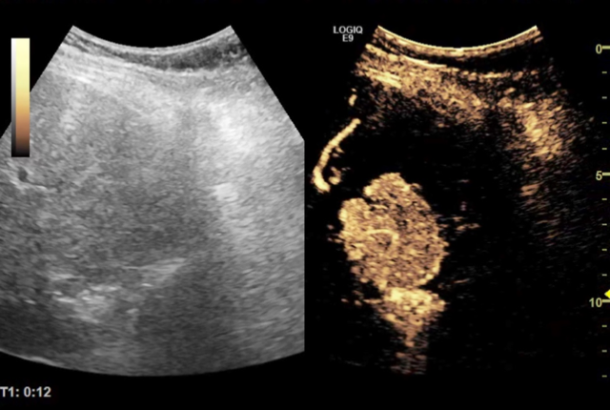
Bilde 5: Venstre: B-mode UL av lever. Høyre: Kontrastforsterket ultralyd med Sonazoid, som viser fokal nodal hyperplasi (FNH) i arteriefasen med rask oppladning, lenge før resten av det normale leverparenkymet.
Referanser