Andelen eldre i befolkningen kommer til å øke de nærmeste tiårene. Kardiovaskulær sykdom er vanlig hos eldre, og hjerte-karmidler er den vanligst brukte legemiddelgruppen i høy alder Det er ingen tvil om at moderne farmakologisk behandling og forebygging av hjerte- og karsykdom har en stor del av æren for at mennesker i vår del av verden lever lengre – og med bedre helse og funksjon – enn for noen få tiår siden. Kardiologiske legemidler er til åpenbar nytte for et stort antall eldre. Med økende alder og skrøpelighet blir imidlertid balansegangen mellom nytte og skade hos den enkelte pasient stadig vanskeligere. Potente legemidler gir bivirkninger, og bivirkningsrisikoen stiger med alderen – særlig med økende multisykelighet, polyfarmasi og funksjonstap.
De fleste randomiserte studier som evidensen for vår behandling hviler på, har eksplisitt ekskludert gamle eller bare inkludert relativt spreke gamle med lite komorbiditet (1). Vi vet derfor lite om effekten av ulike legemidler i mer komplekse situasjoner – som er dem man oftest står overfor i den kliniske hverdagen (2). Siden kvinner generelt er underrepresentert i kliniske studier, er kunnskapsgrunnlaget ekstra spinkelt når det gjelder eldre kvinner med komplekse helseproblemer (3, 4). I den grad alder er tatt i betraktning, fokuserer studiene stort sett bare på kronologisk alder. Kognitiv funksjon og skrøpelighet («frailty») er mer relevant, men sjelden beskrevet. Dertil kommer at de fleste studiene omfatter «harde endepunkter» som hjerteinfarkt, hjerneslag og kardiovaskulær død. Disse er selvsagt relevante også hos eldre, men i høy alder øker betydningen av supplerende endepunkter som livskvalitet, aktiviteter i dagliglivet (ADL) og fysisk og kognitiv funksjon (1, 4).
Den samlede konsekvensen av disse forholdene er at evidensbaserte retningslinjer har store hull når det gjelder behandlingsanbefalinger for skrøpelige eldre med kardiovaskulær sykdom.
Fysiologiske aldersforandringer påvirker legemidlers omsetning og effekt, og bidrar til å gjøre eldre sårbare for legemiddelbivirkninger (5-7). Aldringsprosessen fører til endringer i de fleste organsystemer, men det er store individuelle variasjoner i hvor klinisk betydningsfulle endringene er og når de oppstår. Mange gamle har sykdommer som kan forsterke effekten av aldersforandringene, og det kan være vanskelig å skille normalfysiologiske endringer fra endringer som skyldes sykdom.
Farmakokinetikk handler om legemidlenes omsetning i kroppen, og vi skal nevne noen av endringene som skjer med alderen.
Glomerulusfiltrasjonen reduseres med økende alder, men den fysiologiske reduksjonen varierer mye fra person til person. På grunn av redusert muskelmasse avtar også kreatininsyntesen, og det er viktig å huske at serum-kreatinin ofte overestimerer nyrefunksjonen, særlig hos de skrøpeligste gamle. Vanlig forekommende sykdommer som arteriosklerose, hypertensjon og diabetes kan føre til ytterligere kompromittert nyrefunksjon. En stor andel eldre har derfor betydelig svekket evne til å skille ut legemidler som elimineres renalt, slik som digoksin, de fleste ACE-hemmere, vannløselige betablokkere, spironolakton og metformin. Dersom dette ikke blir tatt hensyn til ved dosering av slike legemidler, risikerer man kraftig økt serumkonsentrasjon og bivirkninger.
Nyrenes tubulusfunksjon svekkes også med alderen. Dette har betydning for evnen til å regulere ionebalansen i plasma, og er trolig grunnen til at for eksempel hyponatremi ved bruk av tiazider er en mye vanligere bivirkning hos eldre enn hos yngre.
Med alderen endres kroppssammensetningen i retning av relativt høyere fettinnhold og lavere vanninnhold. For fettløselige legemidler, som acetylsalisylsyre, furosemid, verapamil og amiodaron, kan dette bety langsommere eliminasjon og forlenget virketid fordi distribusjonsvolumet øker (8). For vannløselige legemidler, som digoksin og mange ACE-hemmere, kan det føre til høyere toppkonsentrasjon etter hver dose, siden legemiddelet fordeles i et mindre volum. Bruk av diuretika kan redusere distribusjonsvolumet ytterligere og øker risikoen for toksiske effekter. Fordi gamle ofte samtidig har redusert nyreavhengig eliminasjon, medfører ikke nødvendigvis redusert distribusjonsvolum kortere halveringstid for vannløselige legemidler (9).
Kroppsvekten går gjerne ned hos de eldste, særlig hos pasienter med ernæringsproblemer, mange sykdommer og høyt legemiddelforbruk. Å bruke standarddoser av legemidler er sjelden optimalt hos denne pasientgruppen. For å unngå overdosering bør dosene ofte reduseres og justeres etter vekt, noe som er særlig viktig for legemidler med smal terapeutisk bredde.
Farmakodynamikk handler om legemidlenes effekt på virkestedet, og også her skjer det endringer med alderen. Et eksempel er at reseptortettheten i vev gjerne går ned med økende alder. Dette medfører at det skal mindre til av en antagonist (for eksempel en betablokker) for å gi effekt, mens en agonist (for eksempel en bronkodilaterende betastimulator) kan få svakere effekt hos eldre.
Aldring kan dessuten medføre en svekkelse av generelle homeostatiske mekanismer. En svekket baroreseptorrefleks fører for eksempel til redusert evne til å respondere raskt og presist på ortostatisk belastning, noe som øker faren for ortostatisk hypotensjon som bivirkning av legemidler som senker blodtrykket. Redusert nyrefunksjon svekker evnen til å opprettholde normal filtrasjon og væske- og elektrolyttbalanse, dermed blir sårbarheten større for legemidler som påvirker glomerulusfiltrasjonen (som ACE-hemmere og angiotensin II-reseptorblokkere) og for legemidler som påvirker tubulusfunksjonen (som diuretika).
Genetisk variasjon kan ha betydning for hvordan legemidler omsettes og påvirker biokjemiske og fysiologiske responser, og har vist seg å være spesielt relevant for metabolismen av mange legemidler. Generelt kan man si at det ved avvikende metabolisme enten er fare for mangelfull effekt eller økt risiko for bivirkninger ved bruk av standarddoser, noe som kan få spesielt store konsekvenser hos skrøpelige eldre. Det vil føre for langt å redegjøre i detalj for dette i denne artikkelen, men vi gir to eksempler på legemidler der aktuelle farmakogenetiske forskjeller kan bidra til stor individuell variasjon i effekt og bivirkninger ved samme dosering:
1) Metoprolol metaboliseres hovedsakelig via CYP2D6. 5-10 % av kaukasere har genvarianter som gir uvanlig langsom metabolisme («poor metabolizers»). Disse vil ha 3-5 ganger lengre halveringstid av metoprolol enn hva som er vanlig og dermed økt risiko for bivirkninger (10). I slike tilfeller anbefales alternative betablokkere (som atenolol eller bisoprolol) eller å redusere måldosen med 75 % (11).
2) Statiner fraktes fra blodbanen og inn i leveren primært via transportproteinet OATP1B1, som kodes av genet SLCO1B1. Medfødte mutasjoner i SLCO1B1-genet kan gi redusert OATP1B1-aktivitet og dermed redusert opptak av statiner fra blod til lever. Dette medfører økt systemisk eksponering og økt risiko for doseavhengige bivirkninger. 15-20 % av kaukasere har redusert OATP1B1-aktivitet, og sammenhengen mellom genetisk variasjon i OATP1B1-mediert opptak av statiner og risiko for muskelbivirkninger er godt dokumentert (12, 13). For eldre med redusert muskelfunksjon og dårlig balanse kan dette være av stor betydning, selv om påvirkningen ikke nødvendigvis er så alvorlig at den fører til forhøyet CK.
Komorbiditet og polyfarmasi kompliserer bildet ytterligere og medfører at responsen på et gitt legemiddel kan bli enda mer variabel. Gamle med kardiovaskulær sykdom har ofte mange andre sykdommer i tillegg, som diabetes, KOLS, nyresvikt, polynevropati, slagsekvele og demens. Det betyr ikke at hjerte-karmidler er unyttige, men det krever at nytte versus risiko for hvert enkelt legemiddel blir grundigere vurdert. Polyfarmasi øker naturligvis risikoen for legemiddelinteraksjoner, og i tillegg må risikoen for interaksjoner mellom legemidler og sykdom tas i betraktning.
Begrepet frailty (skrøpelighet, sårbarhet) brukes i økende grad i geriatrisk forskning og klinisk arbeid. Begrepet er ikke helt klart definert, men har sammenheng med funksjonelle organreserver, evne til å opprettholde fysiologisk homeostase, sårbarhet for bivirkninger og forventet gjenstående levetid. Multisykelighet kan, men behøver ikke nødvendigvis, medføre skrøpelighet. I klinisk geriatri identifiseres vanligvis skrøpelighet gjennom en bred klinisk vurdering som omfatter fysisk funksjon (f.eks. gripestyrke og ganghastighet), selvhjulpenhet i ADL, kognitiv funksjon, emosjonell status (i hovedsak fravær eller nærvær av depressive symptomer), ernæringsstatus, komorbiditet og polyfarmasi. En slik vurdering må altså være tilstrekkelig bred, men er ikke nødvendigvis spesielt tidkrevende dersom man har struktur og systematikk i arbeidet. Pasienter som er skrøpelige har høyere risiko for bivirkninger. Samtidig har de har kortere forventet gjenstående levetid og dermed mindre nytte av farmakologisk behandling som har til hensikt å redusere risikoen for sykdom langt frem i tid.
Som en grunnregel kan man si at jo mer skrøpelig en pasient er, dess større bør den antatte nytten av et planlagt behandlingstiltak være, og dess raskere bør effekten inntre for at tiltaket skal kunne forsvares. For eksempel vil bruk av blodplatehemmer og statin de første månedene etter en sikker koronar hendelse ha stor og raskt innsettende risikoreduserende effekt, og kan derfor forsvares også hos en ganske skrøpelig pasient. Det samme gjelder for antikoagulasjonsbehandling ved atrieflimmer. Statin som primærprofylakse hos en person med høyt serumkolesterol uten etablert kardiovaskulær sykdom har derimot svakere effekt, og effekten inntrer lenger frem i tid. Slik behandling bør derfor trolig reserveres for robuste eldre som ennå har en forventet levetid på flere år.
Det er viktig å være seg bevisst hva som er formålet med et medikamentelt behandlingstiltak, og spesielt hvorvidt tiltaket har symptomatisk eller forebyggende hensikt. Behandling som har til hensikt å bedre pasientens symptombelastning og funksjon her og nå, for eksempel analgetika, kan naturligvis være svært godt begrunnet også hos riktig skrøpelige pasienter. Dessuten er det i tvilstilfeller relativt enkelt å finne ut om middelet har den tiltenkte effekten (og om det har bivirkninger) ved å gjøre en forsøksvis dosereduksjon eller prøveseponering. For farmakologisk risikointervensjon derimot, må man gjøre seg opp en mening om hvorvidt den risikoreduksjonen man kan oppnå er meningsfull gitt pasientens grad av skrøpelighet, forventet gjenstående levetid og bivirkningsrisiko.
I mange tilfeller kan det være vanskelig å vite hvorfor en pasient bruker et gitt legemiddel, og mange legemiddelklasser brukes både med forebyggende og symptomlindrende hensikt. ACE-hemmer eller angiotensin II-reseptorblokker gitt mot hypertensjon faller i kategorien risikoreduksjon, og bør kanskje revurderes hvis pasienten er blitt svært skrøpelig og har andre alvorlige og livsbegrensende sykdommer. Ved hjertesvikt med redusert venstre ventrikkelfunksjon bidrar imidlertid de samme midlene til klart bedre symptomkontroll, og indikasjonen kan derfor være sterk også ved betydelig skrøpelighet og alvorlig komorbiditet. Tilsvarende vil nytten av betablokkade være ulik avhengig av om middelet er gitt som postinfarktprofylakse hos en symptomfri pasient eller om det er gitt for frekvenskontroll av rask atrieflimmer. Ikke sjelden kreves det en smule detektivarbeid i journalen for å finne ut hvorfor en pasient bruker et gitt legemiddel, men dette er viktig for å rydde opp i legemiddelbruk som ikke lenger er relevant – samtidig som man sikrer at pasienten får behandling som fortsatt er til nytte. I tabell 1 har vi kort kommentert bruken av enkelte kardiologiske legemidler hos gamle.
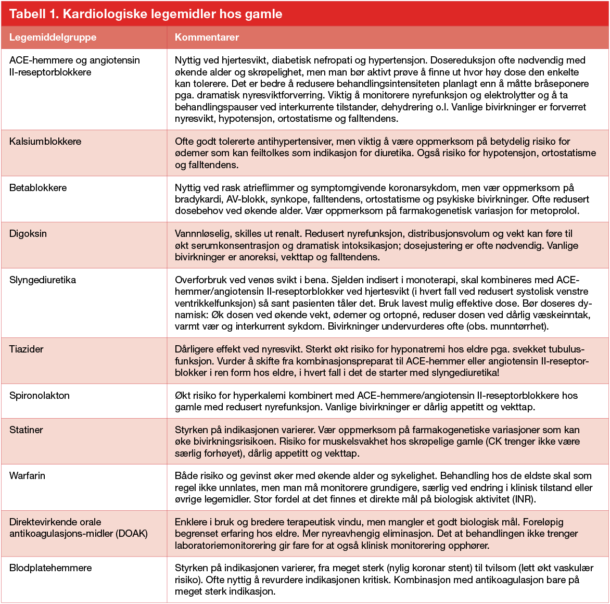
Tabell 1. Kardiologiske legemidler hos gamle
Både fysiologiske aldersforandringer, komorbiditet og polyfarmasi bidrar altså til at eldre er mer utsatt for bivirkninger enn yngre (14). Opp mot 10 % av sykehusinnleggelser hos gamle kan relateres til bivirkninger, og kardiologiske legemidler som betablokkere, antikoagulantia, digoksin, ACE-hemmere og kalsiumblokkere er blant de vanligste legemidlene som er involvert (15). De fleste bivirkninger skyldes kjente farmakologiske egenskaper ved legemidlene (14), som bradykardi og AV-blokk av betablokkere og digitalis og blødninger av antitrombotiske midler. Studier anslår at minst halvparten av bivirkningsrelaterte innleggelser kunne vært unngått med tettere monitorering (16, 17).
Det er viktig å være oppmerksom på risikoen for alvorlige bivirkninger. For gamle pasienter kan imidlertid mindre dramatiske bivirkninger, som svimmelhet, falltendens, forvirring, dårlig matlyst og obstipasjon, ha svært stor betydning både for helse og livskvalitet. Slike bivirkninger er vanlige, blir sjelden spontanrapportert og er ofte uspesifikke og vanskelige å identifisere. Identiske symptomer kan i noen tilfeller skyldes sykdom eller aldersforandringer og i andre tilfeller være utløst av et legemiddel eller av flere legemidler i kombinasjon. Man må derfor lete aktivt etter bivirkninger ut fra mistanke og alltid være bevisst på at et klinisk problem kan tenkes å representere en legemiddelbivirkning. Siden det er vanskelig både å identifisere et gitt symptom som en bivirkning og å forstå hvilket legemiddel (eller kombinasjoner av legemidler) som i tilfelle er ansvarlig, må det ofte gjøres systematiske seponeringsforsøk for å finne nærmere ut av dette. Se tabell 1 for eksempler på vanlig forekommende bivirkninger ved bruk av enkelte kardiologiske legemidler.
Uheldige legemiddelreaksjoner hos gamle skyldes ofte at man ikke har tatt hensyn til svekket homeostase og økt legemiddelfølsomhet og dermed gitt for høy dose av et lege-
middel, eller forskrevet for mange legemidler med lignende effekt eller bivirkningsprofil. For å unngå bivirkninger er det avgjørende at man starter med lave doser og ved behov øke dosene gradvis under tett klinisk oppfølging. Måldosene vil ofte være lavere hos eldre enn hos yngre. Selv om en eldre pasient har tålt et gitt legemiddelregime i mange år, kan toleransen endres med økende alder og komorbiditet, og det er viktig med tett monitorering og jevnlig revurdering av behandlingen også over tid. I dag er det ikke vanlig klinisk praksis å måle serumkonsentrasjonen av for eksempel ACE-hemmere, angiotensin II-reseptorblokkere, kalsiumblokkere eller diuretika, men metoder for dette er under stadig utvikling. På sikt kan slike målinger tenkes å bli nyttige for å gi eldre bedre og mer individualisert behandling.
Farmakokinetiske interaksjoner skyldes at legemidlene påvirker hverandres opptak, transport, nedbrytning og/eller utskillelse. Et vanlig sete for slike interaksjoner er cytokrom P-450-systemet i leveren (CYP-systemet). Et eksempel er interaksjonen mellom metoprolol og flere antidepressive legemidler. Som tidligere nevnt metaboliseres metoprolol hovedsakelig via CYP2D6. Mange antidepressiva (som paroksetin, fluoksetin, citalopram og escitalopram) har egenskaper som CYP2D6-hemmere. Ved å kombinere metoprolol med slike legemidler kan systemisk tilgjengelig dose av metoprolol øke betydelig (18). Risikoen for farmakokinetiske interaksjoner øker med økende antall legemidler i bruk, men påvirkes ikke av alderen i seg selv. Interaksjonene er gjerne godt dekket av oppslagsverk som interaksjoner.no og er derfor mulige å unngå hvis man husker å sjekke pasientens legemiddelregime opp mot en slik tjeneste.
Farmakodynamiske interaksjoner skyldes at legemidlene forsterker eller svekker hverandres effekt på virkestedet. Dette har ofte stor klinisk betydning hos eldre, ikke minst ved bruk av kardiologiske legemidler. Som et eksempel er kombinasjonen ACE-hemmer, betablokker og diuretika anbefalt ved hjertesvikt. For mange pasienter vil slik behandling være nyttig og uproblematisk, men for en skrøpelig pasient med svekkede homeostatiske reserver kan interaksjonene bli klinisk relevante og for eksempel føre til alvorlig ortostatisme og synkope. De fleste farmakodynamiske interaksjoner lar seg forutse, siden de skyldes legemidlenes forventede effekter. Fordi de er så avhengige av den kliniske konteksten, er de imidlertid dårlig dekket i interaksjonsdatabasene. Flere eksempler er vist i tabell 2.
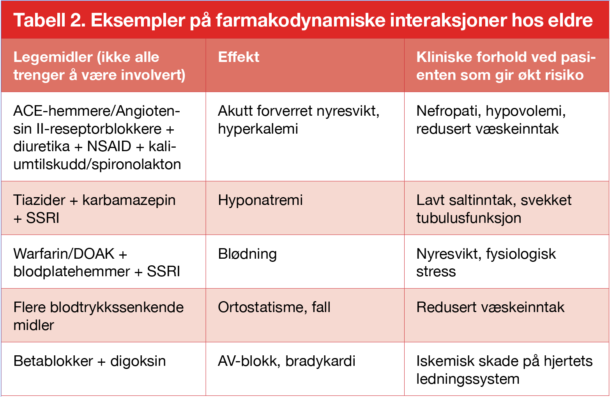
Tabell 2. Eksempler på farmakodynamiske interaksjoner hos eldre
Det er viktig å ha fokus på bivirkninger, men samtidig må man ikke glemme at mange gamle ikke får medikamentell behandling som kunne vært til nytte for dem. Et tilsynelatende paradoks er at polyfarmasi er en risikofaktor for underbehandling. Ved nærmere ettertanke er det muligens ikke så overraskende at en lang legemiddelliste utgjør en psykologisk barriere mot å forordne enda et legemiddel, selv om dette middelet kanskje ville vært til klar nytte. Av og til vil det være fornuftig å sette inn et middel med stor antatt nytteverdi og heller seponere noe annet og mindre nyttig, mens andre ganger skal man nok forordne et nytt middel selv om det blir nummer 8 eller 10 på listen. Jo mer uttalt polyfarmasien er, dess mer omsorgsfull må imidlertid indikasjonsstillingen og vurderingen av den samlede behandlingen være.
Eksempler på vanlig forekommende underbehandling av hjertesyke gamle er monoterapi med diuretika ved hjertesvikt og redusert venstre ventrikkelfunksjon i tilfeller der en ACE-hemmer eller angiotensin II-reseptorblokker kunne vært god tolerert og gitt bedre symptomkontroll, behandling av atrieflimmer med digitalis der en betablokker ville gitt bedre frekvenskontroll, og unnlatelse av å gi antikoagulasjon ved atrieflimmer.
Forebygging og behandling av hjerte-karsykdom er til stor nytte for mange gamle, men jo eldre og skrøpeligere pasientene er, jo vanskeligere blir avveiningene mellom nytte og risiko. Både fysiologiske aldersforandringer, komorbiditet og polyfarmasi gjør eldre sårbare for negative effekter av legemiddelbehandling, og pasientenes kompleksitet gjør at man ikke kan følge retningslinjer blindt. Grundige kliniske vurderinger med individuelt tilpassede legemiddelvalg og doser er avgjørende for et vellykket resultat. Man må huske at bivirkninger er hyppig forekommende hos gamle, men ofte uspesifikke og vanskelige å oppdage. Fordi nye sykdommer eller forbigående interkurrente tilstander er vanlige, er det viktig med tett monitorering og en dynamisk legemiddelbruk.
Innlegget er tidligere publisert i Hjerteforum nr 1 2018 og trykkes med tillatelse.
Referanser