Levercirrhose er kraftig underdiagnostisert i Norge. Prognosen er ofte alvorlig, men kan i noen tilfeller bedres ved å fjerne årsaken til leversykdommen. For å håndtere komplikasjoner optimalt bør pasienter med levercirrhose tilbys regelmessig oppfølging av engasjert gastroenterolog i samarbeid med fastlegen.
Levercirrhose er som regel asymptomatisk i tidlig fase, og diagnosen er derfor ofte ukjent både for pasient og lege. Ikke minst gjelder dette pasienter der alkoholisk leversykdom (ALD) og nonalkoholisk fettleversykdom (NAFLD) er årsak til cirrhosen. Denne underdiagnostiseringen kom tydelig til uttrykk i et norsk materiale på pasienter med hepatocellulært carcinom (HCC). Blant dem som hadde cirrhose (majoriteten av pasientene) var cirrhosediagnosen ukjent i 65% av tilfellene (1). De første symptomene som inntreffer ved cirrhose er ofte uspesifikke, slik som nedsatt almenntilstand og vekttap. Vi ser fra tid til annen at pasienter som henvises med spørsmål om malignitet, viser seg å ha levercirrhose. Etter hvert som sykdommen utvikler seg, oppstår mer spesifikke og kjente tegn som ikterus, ascites (figur 1), øsofagusvaricer og encefalopati. Sykdommen er da som regel kommet i en mer avansert fase.
Da de fleste tilstander som leder til cirrhose kan behandles effektivt, er det viktig med tidlig diagnostikk. I Norge er livstidsinsidensen av levercirrhose ca 1-1,5% (2). Alle indremedisinere og allmennpraktikere vil derfor treffe en del pasienter med cirrhose i løpet av sin karriere.
*Jo høyere Fib4, jo høyere sannsynlighet for leverfibrose.
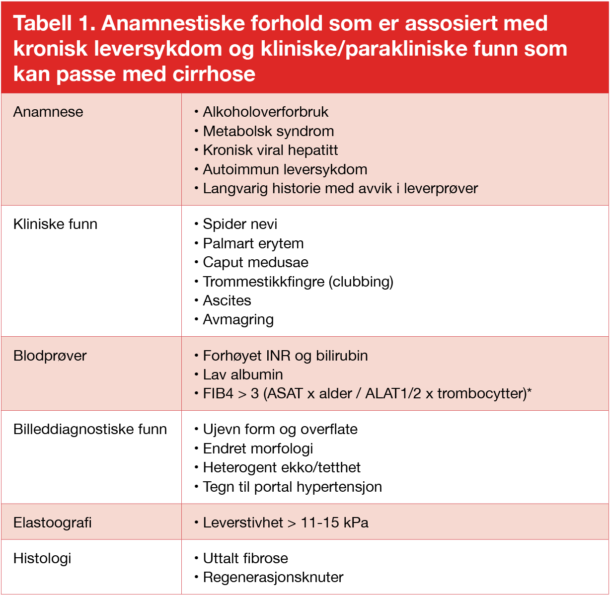
Levercirrhose er i utgangspunktet en histologisk diagnose definert av omfattende leverfibrose med endret leverarkitektur og dannelse av regenerasjonsknuter. I praksis vil diagnosen ofte kunne stilles ved å kombinere anamnese (påvisning av risikofaktorer), klinisk undersøkelse, blodprøver, billeddiagnostikk og leverelastografi der dette er tilgjengelig. Leverelastografi har de senere år etablert seg som et særdeles viktig hjelpemiddel for å identifisere pasienter med avansert leverfibrose og cirrhose (se egen artikkel om diagnostiske metoder i denne utgaven). Det er viktig å vurdere systematisk så mange aspekter som mulig (Tabell 1). Husk å be radiologene om å se etter tegn til cirrhose og/eller portal hypertensjon, ellers er det ikke alltid dette rapporteres. Kutane tegn bør alltid vurderes (Fig 1).
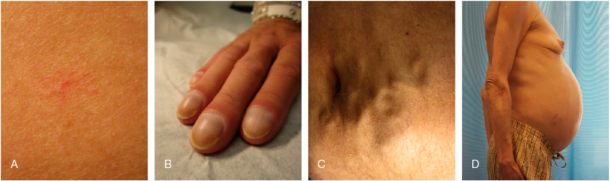
Figur 1. Kutane tegn som kan ses ved levercirrhose: Spider naevi (A), clubbing (B), caput medusae (C), ascites og avmagring (D). (Med tillatelse fra Fagbokforlaget fra: Indremedisin I & II, 2017)
Child Pugh-klassifikasjonen (tabell 2) ble første gang publisert i 1973 (3), og er fortsatt en av de viktigste prediktorer for overlevelse ved cirrhose. I en metaanalyse publisert i 2006 fant man 95%, 80%, 50% 1-årsoverlevelse, og 90%, 70%, 38% 2-årsoverlevelse ved henholdsvis Child Pugh klasse A, B og C (4).
Prognosen kan likevel bedres ved å fjerne den tilgrunnliggende årsak til cirrhosen. Forbausende nok gjelder dette også når årsaken fjernes på et avansert stadium. Eksempelvis vil pasienter med etablert levercirrhose på grunn av kronisk hepatitt C (HCV) ha økt overlevelse dersom de blir kvitt sin virusinfeksjon etter antiviral behandling (5). Med moderne direktevirkende antivirale midler mot HCV er det nå mulig å tilby behandling også til pasienter med avansert cirrhose, noe som var svært vanskelig tidligere på grunn av dårlig effekt og potensielt alvorlige komplikasjoner ved interferonbasert behandling.
Tilsvarende som for HCV vil overlevelsen for pasienter med dekompensert alkoholisk cirrhose bedres signifikant i gruppen som slutter å drikke alkohol (6). Disse to sykdommene utgjør tilsammen om lag 65% av norske cirrhosepasienter (2). I tillegg er det også mulig å bremse sykdomsprogresjonen for bl.a. pasienter med kronisk hepatitt B (HBV), for pasienter med autoimmun hepatitt (AIH) og for pasienter med primær biliær cholangitt (PBC).
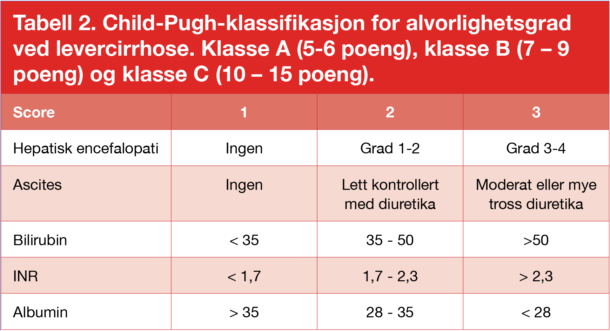
Tabell 2. Child-Pugh-klassifikasjon for alvorlighetsgrad ved levercirrhose. Klasse A (5-6 poeng), klasse B (7 – 9 poeng) og klasse C (10 – 15 poeng).
Utover det å gjøre noe med grunnsykdommen er det en rekke andre tiltak som vil bedre prognosen og øke livskvaliteten hos pasienter med levercirrhose. For den enkelte pasient er det viktig å avklare hva som er målet med oppfølgingen. For noen handler det om å oppnå bedre livskvalitet, og kanskje forlenge levetiden, for andre handler det om å normalisere leveutsiktene ved hjelp av levertransplantasjon. Selv om levertransplantasjon bare er mulig for et mindretall av pasientene med levercirrhose, er det viktig å avklare med den enkelte pasient om dette kan være aktuelt. Indikasjoner og kontraindikasjoner omtales ikke her, men det er forfatterens personlige oppfatning at denne behandlingsmuligheten noen ganger underkommuniseres med pasientene. I Norge utføres det per i dag mer enn hundre levertransplantasjoner hvert år, de fleste på bakgrunn av avansert levercirrhose med eller uten HCC.
Leveren er et vitalt organ med et mangfold av funksjoner knyttet til detoksifisering og ekskresjon av endogene og eksogene avfallsstoffer, proteinsyntese og homeostase av mange funksjoner som blant annet energistoffskifte, «trombose/blødnings-balanse» og immunforsvar. Det er også nyttig å tenke på leveren som et filter. Veneblodet fra magesekk, tarm, pankreas og milt samler seg i portvenen for deretter å passere langsomt gjennom leverparenchymet. Når filteret er skadet og preget av ekstensiv fibrose og regenerasjonsknuter, fungerer det dårlig. Portveneblodet sildrer ikke lenger pent og pyntelig forbi hepatocyttene som det skal, og det oppstår både intra- og ekstrahepatisk shunting. De strukturelle endringer i leveren fører etterhvert til forhøyet trykk i vena porta. I tillegg til dette ses også økt risiko for celleforandringer og HCC som følge av langvarig inflammasjon. Nedenfor beskrives cirrhosekomplikasjoner delt inn i tre kategorier:
På grunn av leverens store reservekapasitet er det først i avanserte stadier av cirrhose at de vanligste funksjonsmarkører (INR, albumin, bilirubin) blir patologiske. Andre avvik kan inntreffe på tidligere stadier.
Når leveren ikke renser blodet på grunn av redusert hepatocyttfunksjon og fordi sphlancnicusblodet shuntes forbi leveren, kan det inntreffe en særegen nevropsykiatrisk forstyrrelse som benevnes hepatisk encefalopati (HE). Manifest HE deles inn i fire grader:
Det er bemerkelsesverdig hvordan grad av HE kan variere i løpet av få timer ved interkurrent sykdom. De senere år er det fokusert mye på såkalt minimal HE, der tilstanden ikke er klinisk detekterbar. Ved spesifikk testing kan man se signifikant reduksjon i psykomotorisk tempo, noe som er assosiert med redusert livskvalitet og redusert evne til å betjene maskiner og kjøre bil. Behandling med laktulose er basisbehandling ved HE. I tillegg brukes rifaximin, et ikke-absorberbart antibiotikum som endrer tarmfloraen. Effekten av rifaximin er godt dokumentert ved klinisk manifest HE, og som forebyggende behandling etter dette (7). Medisinen refunderes via blåreseptordningen på disse indikasjonene, men er foreløpig ikke godkjent til behandling av minimal HE. Flere studier viser imidlertid effekt også ved denne tilstanden.
Leveren spiller normalt en koordinerende rolle i energistoffet. Ved levercirrhose ses diabetes hos hele 35-70 %, noe avhengig av årsaken til cirrhose (8). Mekanismene for dette er ikke helt klarlagt.
Samtidig er underernæring vanlig ved cirrhose og studier viser at dette er en uavhengig prediktor på død. Det er mange årsaker til underernæring, en interessant faktor er redusert evne til å tåle faste. Mens friske kan klare seg uten næringsinntak i 72 timer før proteiner nedbrytes, skjer dette allerede etter åtte timer hos pasienter med cirrhose (9). Cirrhosepasienter bør av den grunn anbefales næringsinntak før leggetid.
Leveren er en viktig del av vårt immunforsvar, blant annet på grunn av et stort antall immunceller i leveren, og dens anatomiske rolle som filter for portveneblodet. Risikoen for sepsis er mer enn doblet ved cirrhose, og gitt sepsis, er det også doblet risiko for død (10). Ved mistanke om bakteriell infeksjon hos pasienter med cirrhose bør det være lavere terskel for antibiotikabehandling enn hos leverfriske, også fordi den kliniske presentasjon av infeksjon kan være atypisk.
En særegen infeksjon ved cirrhose er spontan bakteriell peritonitt. Diagnosen baserer seg på påvisning av økt antall hvite blodceller i ascitesvæsken.
I motsetning til hva mange tror, beskytter cirrhose-betinget høy INR ikke mot trombose. En årsak til det er at leverens syntese av antitrombotiske faktorer også er nedsatt. Ved cirrhose er risikoen for venetromboser faktisk 1,5 – 2 ganger høyere enn i normalbefolkningen (11). Portvenetrombose er spesielt vanlig. Langsom og noen ganger pendulerende eller reversert blodstrøm er den viktigste årsak til dette.
På den annen side vil pasienter med levercirrhose ofte ha økt blødningstendens, dels på grunn av varicer og lettblødende slimhinne som følge av portal hypertensjon og dels på grunn av trombocytopeni (pga hypersplenisme og redusert trombopoeitin) og høy INR.
Økt arteriell blodstrøm inn i splanchnicus-gebetet er en velkjent konsekvens ved levercirrhose som bidrar til alvorlige sirkulasjonsforandringer. Årsaken til dette er ikke helt klarlagt. Ettersom portveneblodet dreneres gjennom leveren, hvor det også er økt vaskulær motstand på grunn av cirrhosen, blir konsekvensen gradvis utvikling av portal hypertensjon. I neste omgang fører dette til portosystemisk shunting og utvikling av varicer, vanligst i distale øsofagus og proximale ventrikkel.
Portosystemisk shunting bidrar til HE ettersom leveren frarøves muligheten til effektiv rensing av portveneblodet. Portosystemisk shunting er også av farmakokinetisk betydning for medikamenter med høy grad av «first-pass-metabolisme».
Varicer i øvre gastrointestinal-traktus er asymptomatiske inntil de eventuelt sprekker og forårsaker blødning. Situasjonen kan fort bli meget alvorlig med ukontrollert blødning ledsaget av høy morbiditet og mortalitet. Alle pasienter med levercirrhose bør screenes for varicer. Ved store varicer, ved små varicer med blødningsstigmata og ved små varicer hos pasienter med dekompensert cirrhose (Child Pugh C) er det indikasjon for primærprofylakse, enten ved å senke portvenetrykket medikamentelt [ikke-selektiv betablokker eller kombinert alfa/beta-blokker (karvedilol)] eller ved endoskopisk behandling (strikkligatur eller injeksjonsbehandling) (12).
Ved akutt blødning er det indikasjon for kombinert endoskopisk og medikamentell behandling, deretter repeterte endoskopiske prosedyrer for eradikasjon av varicer parallelt med medikamentell sekundærprofylakse. I tilfeller der det er vanskelig å få blødningskontroll, eller ved repeterte, alvorlige blødninger, spesielt hos pasienter med dekompensert cirrhose, kan det være indikasjon for å legge inn transjugulær intrahepatisk portosystemisk stent (TIPS), det vil si en intrahepatisk stent som effektivt senker portvenetrykket.
Tilstedeværelse av varicer ved levercirrhose indikerer en alvorlig situasjon med høy mortalitet. Child Pugh-status er en robust prediktor på overlevelse også for disse pasientene (figur 2).
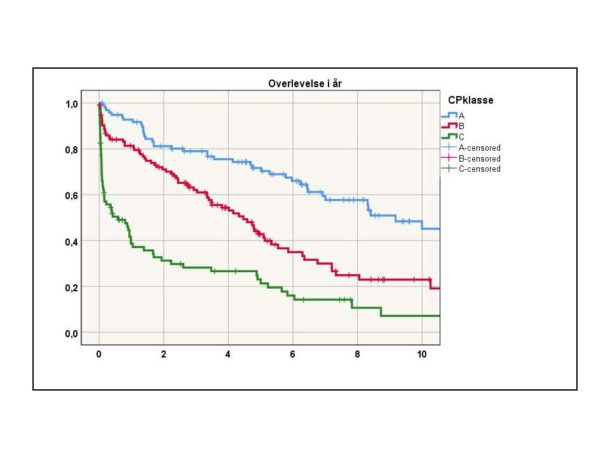
Figur 2 Overlevelse etter variceblødning
Som følge av økt arteriell blodstrøm i splanchnicus-gebetet inntreffer «relativt lavt blodvolum» i resten av kroppen med lavere systemisk blodtrykk til følge. Dette resulterer i økt nivå av antidiuretisk hormon (ADH) og aktivering av sympatikus- og renin/angiotensin-systemet, som igjen medfører økt retensjon av vann og natrium i nyrene med overvæsking til følge. Væsken akkumuleres primært i form av ascites på grunn av økt trykk i vener og lymfebaner relatert til abdominalhulen, men også deklivt i underekstremitetene. Ettersom vann retineres mer enn natrium utvikles en fortynningshyponatremi. Disse pasientene har altså ikke mangel på salt, men for mye fritt vann. Behandlingen er i sekvensiell rekkefølge: salt- og væskerestriksjon, diuretika, terapeutisk ascitestapping og eventuelt innsetting av TIPS.
Selv om cirrhosepasienter lett blir overvæsket, har de også tendens til intravaskulær hypovolemi, med risiko for renal hypoperfusjon. Også her er homeostasemekanismer satt under press. Hepatorenalt syndrom er en alvorlig form for nyresvikt som må forstås på denne bakgrunn.
Forekomsten av HCC er raskt økende. I Norge diagnostiseres nå i underkant av 300 tilfeller per år. HCC er en svært alvorlig kreftform med 5-års-overlevelse omkring 20%. Tilstanden er vanligvis ikke kurabel når den avdekkes etter at det har utviklet seg symptomer, eksempelvis smerter eller ascites. Hvis HCC derimot diagnostiseres i tidlig, asymptomatisk stadium, kan kurativ behandling være mulig.
Ved etablert levercirrhose regner man med at den årlige risikoen for HCC ligger mellom 1 og 4 %. Dette er en relativt høy årlig kreftrisiko, og ettersom kurativ behandling ofte er mulig ved tidlig diagnostikk, er det for pasienter med levercirrhose anbefalt HCC-overvåking med ultralydundersøkelse hver 6. måned (13). Det er vist at overlevelsen er bedre når HCC diagnostiseres ved regelmessig overvåking enn når tilstanden diagnostiseres på bakgrunn av symptomer. Aktuelle kurative behandlingsmodaliteter ved HCC er kirurgisk reseksjon, radiofrekvensablasjon og levertransplantasjon.
I Norge følges antagelig anbefalinger om overvåking i økende grad, men fortsatt er det svært mange med cirrhose som ikke tilbys slik overvåking. På den annen side er det viktig å begrense overvåkingen til pasienter der eventuelt funn av HCC kan tenkes å få terapeutisk konsekvens. Regelmessig overvåking er derfor mindre aktuelt for pasienter som på grunn av alder og komorbiditet har forventet levetid på mindre enn noen få år. Det samme gjelder pasienter med dekompensert levercirrhose som ikke er aktuelle for levertransplantasjon, og som heller ikke vil tåle annen kurativt rettet behandling.
I artikkelen har jeg understreket betydningen av å diagnostisere levercirrhose og behandle den tilgrunnliggende årsak hvis det er mulig. Jeg har videre redegjort for vanlige, potensielt alvorlige komplikasjoner. Ettersom sykdomsbildet fort kan bli komplekst, bør pasienter med levercirrhose tilbys regelmessig oppfølging av både fastlege og spesialist i gastroenterologi. Å påse at screening og behandling av varicer gjennomføres, samt organisere ultralydovervåking med hensyn på HCC, står sentralt i oppfølgingen. Man bør også være oppmerksom på eventuelt andre komplikasjoner, og klarer man å fjerne årsak,stimulere til god ernæring, behandle encefalopati og forstyrrelser i væskebalansen er man kommet et godt stykke på vei.
Referanser