En stor andel pasienter opplever vedvarende plager og funksjonsnedsettelse etter lunge-emboli. En generell dekondisjonering etter lungeemboli-hendelsen er trolig mest plausible forklaring.
Lungeemboli (LE) har en insidens rundt 0,5/1000 personår, tilsvarende rundt 2500 – 3000 tilfeller årlig i Norge, basert på tall fra helseundersøkelsen i Nord-Trøndelag [1]. Symptomer og funn vil være avhengig av utbredelse av embolier, og det kliniske bildet varierer fra tilfeldig påviste embolier hos asymptomatiske pasienter til plutselig sirkulasjonskollaps og død. Ofte blir lungeemboli betraktet som akutt tilstand som er kurert og ferdigbehandlet etter en periode med antikoagulasjon, med unntak av noen uheldige få prosent (2-4 %) som utvikler kronisk tromboembolisk pulmonal hypertensjon (CTEPH)[2]. Det er økende evidens for at spekteret av mulige langtidsutfall etter LE er mer nyansert enn tidligere antatt.
Ofte vil dyp venetrombose (DVT) og lungeemboli forekomme samtidig; ved DVT er det anslått at 40-50 % har koeksisterende LE tross ingen symptomer [3, 4], og over 80 % av LE-pasienter vil samtidig ha radiologisk verifiserbar DVT [5]. Ofte brukes samlebegrepet venøs tromboembolisme (VTE).
Ved gjennomgått symptomatisk DVT vil opp mot 50 % utvikle såkalt PTS (post trombotisk syndrom) som følge av venøs okklusjon, venøs hypertensjon, klaffedestruksjon og sekundær inflammasjon [6]. PTS gir symptomer og funn i form av smerter, hevelse, hudforandringer og eventuell sårdannelse. Standard behandling ved DVT utover antikoagulasjon har vært elastiske kompresjonsstrømper for å unngå utvikling til PTS, men enkelte studier senere tid har sådd noe tvil rundt nytteeffekten av dette [7].
Nedbrytningen av tromboembolisk materiale ved LE skjer ved mekanisk fragmentering, endogen fibrinolyse og rekanalisering gjennom et samspill mellom endoteliale celler, mononukleære celler og fibroblaster [8]. Men til tross for adekvat antikoagulasjon og nødvendig tid fra den akutte LE, vil det hos opptil 20-30 % være radiologiske holdepunkt for inkomplett nedbrytning av trombe 6 – 12 måneder etter den akutte hendelsen [9-12]. Ekkokardiografiske tegn til høyre ventrikkel dysfunksjon og/eller pulmonal hypertensjon er vanlig i det akutte forløpet av LE, men selv etter 6-12 måneder vil opp mot 25 % av LE-pasienter stadig ha slike ekkokardiografiske funn [13-15]. Vedvarende patologiske radiologiske og ekkokardiografiske funn, talende for gjenværende strukturelle eller fysiologiske abnormaliteter, er altså ikke uvanlig etter LE, men hvorvidt dette har betydning for den enkelte pasient med hensyn til symptomer, fysisk kapasitet og livskvalitet har vært mer uklart.
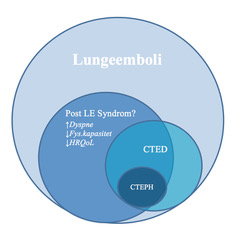
Figur 1. Skjematisk fremstilling av potensielle følgetilstander etter lungeemboli, størrelsesorden er ikke representativ for faktisk prevalens. CTED = chronic thromboembolic disease, CTEPH = Chronic thromboembolic pulmonary hypertension (inspirert av figur fra artikkelen “The post-PE syndrome: a new concept for chronic complications of pulmonary embolism” av F. A. Klok og kollegaer, publisert I Blood Reviews, vol. 28, utgave 6, november 2014).
Kronisk tromboembolisk pulmonal hypertensjon (CTEPH) er en alvorlig tilstand med betydelig komorbiditet og mortalitet, og rammer 2-4 % av pasienter som har gjennomgått lungeemboli. Den reelle prevalensen og insidens av pulmonal hypertensjon ved tromboembolisk sykdom er dog noe usikker, da symptomene er uspesifikke, og en betydelig andel av diagnostiserte CTEPH-pasienter ikke har historikk på tidligere VTE [16]. Tilstanden antas å oppstå som følge av ufullstendig resolusjon og organisering av trombe med påfølgende remodellering og fibrosering av lungekarsengen, med utvikling av økende motstand i lungekarsengen, progredierende pulmonal hypertensjon og etter hvert høyre ventrikkelsvikt.
For å stille diagnosen CTEPH kreves tilstedeværelse av følgende etter minimum 3 måneder adekvat antikoagulasjon;
CTEPH er en potensielt kurabel tilstand ved kirurgi; pulmonal endarterektomi (PEA) er den foretrukne metoden, men perkutan ballong angioplastikk kan være et alternativ for de med perifere lesjoner og komorbiditet som gjør pasienten uegnet for PEA [18]. Enkelte post-LE pasienter vil ha radiologiske tegn til kronisk tromboembolisk sykdom og symptomer uten at de oppfyller de trykkmessige kriteriene for pulmonal hypertensjon/CTEPH, og ofte brukes betegnelsen «chronic tromboembolic disease» eller CTED. Optimal behandling av denne pasientgruppen er under diskusjon, men enkelte studier tyder på at de med klare symptomer og tilgjengelig sykdom bør tilbys behandling på lik linje med CTEPH-pasienter [19].
Majoriteten av tidligere studier på lungeemboli har vært sentrert rundt det akutte og subakutte forløpet, med fokus på korttidsutfall slik som mortalitet og risiko for residiv VTE i ukene og månedene etter den initiale hendelsen. Overraskende få studier har fokusert på langtidsutfall etter lungeemboli, med unntak av den alvorlige, men relativt sjeldne komplikasjonen CTEPH. De senere år er det altså kommet økende evidens for at LE også kan påvirke pasienters helse og livskvalitet også på lang sikt, og at potensielle langtidsutfall etter LE nok er mer nyansert enn tidligere antatt:
I en studie ved Sykehuset Østfold av M. Tavoly og kollegaer, som involverte 213 post-LE-pasienter, fant man at omtrent 50 % rapporterte varierende grad av dyspne 1-10 år etter LE-diagnosen. Den samme pasientgruppen viste redusert fysisk kapasitet målt ved gangtest (6-minute walk test) og rapporterte dårligere helserelatert livskvalitet (HRQoL) sammenlignet både mot LE-pasienter uten dyspne og mot normalbefolkningen [20]. Videre analyser avdekket ingen assosiasjon mellom komorbiditeter (bedømt ved Charlson comorbidity index) og HRQoL, gangtest eller dyspne [21].
I 2017 ble det utgitt en metaanalyse av 26 studier, totalt 3671 pasienter, hvor fokus var persisterende høyre ventrikkel dysfunksjon, nedsettelse av fysisk kapasitet og HRQoL etter LE [22]. Etter en median oppfølgning på 40 måneder, oppga 33,2 % av pasientene minst mild funksjonsnedsettelse, definert som NYHA-klasse (New York Heart Association) II-IV, 11 % anga moderat/alvorlig funksjonsnedsettelse tilsvarende NYHA-klasse III-IV.
Kahn og kollegaer publiserte i 2017 en prospektiv studie av 100 akutt LE-pasienter som ble undersøkt med bl.a. kardiopulmonal belastningstest (CPET), ekkokardiografi, perfusjonsscintigrafi med mer [23]. 46,5 % av post-LE pasientene hadde lavere maksimalt oksygenopptak (VO2 max) enn forventet ved 1 år, og den samme gruppen skåret lavere på helserelatert livskvalitet og anga høyere grad av dyspne. Man fant ingen assosiasjon med lungefunksjonstester eller ekkokardiografiske parametere, og forfatterne konkluderer med at funksjonsnedsettelsen mest sannsynlig skyldes muskeldekondisjonering fremfor annen sirkulatorisk eller ventilatorisk begrensning.
Albaghdadi og kollegaer publiserte tidligere i år en prospektiv studie av 20 pasienter med submassiv og massiv LE som ble vurdert med klinisk evaluering, ekkokardiografi og CPET ved 1 og 6 måneder etter utskrivelse [24]. 45 % av pasientene rapporterte vedvarende dyspne (NYHA II-III) og 60 % hadde redusert VO2-max ved 6 måneder, definert som < 80 % av alder/kjønn predikert VO2-max ved CPET. Videre tydet resultatene fra CPET på verken kardiell eller respiratorisk årsak til funksjonsnedsettelse, og man konkluderer også i denne studien med global dekondisjonering som mest sannsynlig forklaring på funksjonsnedsettelsen.
Flere studier de seneste år viser altså at en stor andel pasienter opplever vedvarende plager i form av økt dyspne, redusert fysisk kapasitet og redusert livskvalitet etter gjennomgått LE. Symptombyrden er mindre uttalt enn ved CTEPH, men absolutt til stede. Denne pasientgruppen har av enkelte fått betegnelsen «Post Pulmonary Embolism Syndrome» eller «post LE-syndrom», som en analog til det etablerte begrepet PTS i underekstremitetene, og man har stilt spørsmål om CTEPH er den ekstreme manifestasjon av en større sykdomsgruppe. Det er foreløpig ingen klar konsensus om hvordan man eventuelt skal definere «post LE-syndrom».
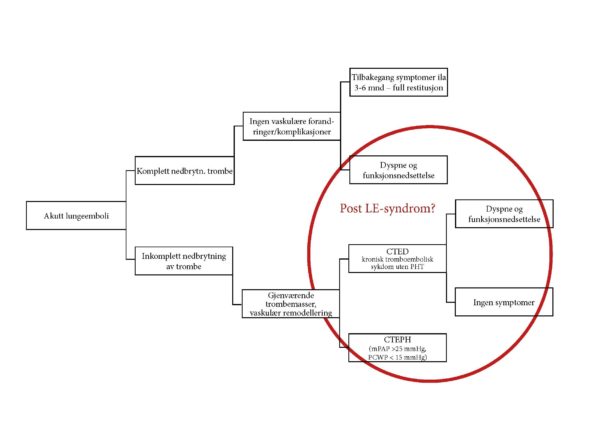
Figur 2. Flytdiagram for mulige utfall etter lungeemboli
Uavhengig av om man kaller denne tilstanden «post-lungeemboli syndrom» eller ei, og hvordan man eventuelt definerer dette, synes en stor andel å oppleve vedvarende plager og funksjonsnedsettelse etter lungeemboli. Det foreligger i dag ingen klare retningslinjer verken nasjonalt eller internasjonalt om hvordan man skal håndtere disse pasientene, og det foreligger heller ingen validerte behandlingsalternativer. Studier har så langt ikke kunne avdekke noen underliggende patofysiologisk mekanisme/sekvele etter lungeemboli, og en generell dekondisjonering i forbindelse med lungeemboli-hendelsen anses foreløpig som mest plausible forklaring. Fysisk trening og rehabilitering fremstår da som en potensiell behandlingsform. Rehabilitering er allerede en etablert og godt validert behandling ved andre årsaker til dyspne og funksjonsnedsettelse, slik som ved kronisk obstruktiv lungesykdom og hjertesvikt [25-28].
Ved Sykehuset Østfold Kalnes pågår det nå en klinisk randomisert studie hvor vi undersøker effekten av et 8 ukers fysioterapiveiledet rehabiliteringsprogram på post-LE pasienter med vedvarende uforklart dyspne og funksjonsnedsettelse. Studiedeltagerne gjennomgår i tillegg omfattende utredning med bl.a. ekkokardiografi, VQ-scintigrafi, magnetisk resonanstomografiundersøkelse av hjertet med mer. Hvis intervensjonen viser seg å ha effekt, kan denne studien danne grunnlaget for en ny evidensbasert behandling for en stor pasientgruppe som per i dag står uten reelt behandlingstilbud.
Referanser