Artikkelen er basert på et innlegg holdt på høstmøtet i Norsk indremedisinsk forening 18. oktober 2018. Onkologisk immunterapi har gitt nytt håp til pasienter med alvorlige kreftformer som malignt melanom. Behandlingen har imidlertid potensielt alvorlige bivirkninger som alle leger bør kjenne til. Rask diagnose og behandling av kortisolmangel kan i enkelte tilfeller være livreddende.
Tasuko Honjo (f.-42) fra universitetet i Kyoto og James P Allison (f.-48) fra University of Texas delte i 2018 Nobelprisen i fysiologi og medisin for sine oppdagelser av regulatoriske mekanismer i immunsystemet. Honjo har identifisert og beskrevet “programmed cell death protein 1” (PD-1). Allison er blant de første til å forstå og beskrive T-celle antigen-reseptor-kompleks generelt og “cytotoxic T-lymphocyte antigen-4” (CTLA-4) spesielt.
Et velfungerende immunsystem forutsetter balanse i stimulerende og hemmende signalveier. Manglende aktivering av immunsystemet gir immunsvikt, mens et for aktivt immunsystem kan gi autoimmune sykdommer. Immunforsvaret vårt identifiser og dreper virus og bakterier, og det har en viktig oppgave i kampen mot kreftceller. Det er en gammel drøm å kunne aktivere immunsystemet til målrettet kreftbehandling. PD-1 og CTLA-4 reseptor-ligand systemene er viktige regulatoriske bremser i immunsystemet vårt (figur 1 og 2), som blant annet hindrer selvdestruksjon. En slik regulatorisk brems kalles på engelsk “immune checkpoint” eller immun-kontrollpunkt på norsk. Honjo og Allisons forskning har gjort det mulig å utvikle antistoffer som blokkerer disse signalveiene og dermed forsterker immunresponsene. Det er i dag utviklet “immune checkpoint hemmere” både mot CTLA-4 reseptor og mot PD-1 reseptor og PD-1 ligand som nå brukes i behandling av kreft (figur 1 og 2).
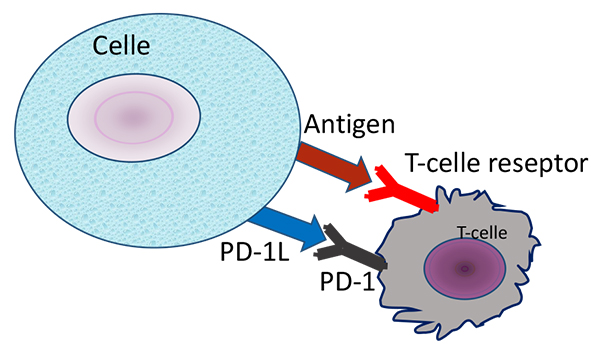
Figur 1a. PD-1 ligand binder PD-1 reseptor på en T-celle og hindrer celledrap når T-cellen har gjenkjent antigen på cellen.
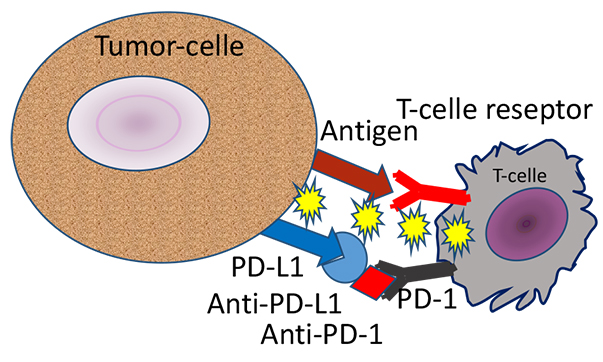
Figur 1b. Når binding av PD-ligand 1 til PD-1 reseptor blokkeres av antistoff rettet mot liganden eller reseptoren vil antigenbinding utløse en cytotoksisk T-cellerespons. Tumorcellen drepes.
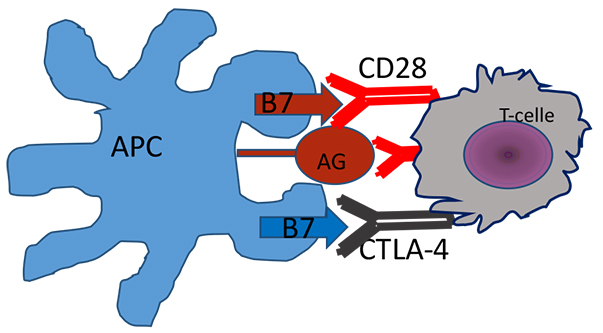
Figur 2a. En regulatorisk T-celle gjenkjenner et antigen (AG) på en antigenpresenterende celle (APC), mens samtidig binding av CTLA-4 hindrer en immunrespons.
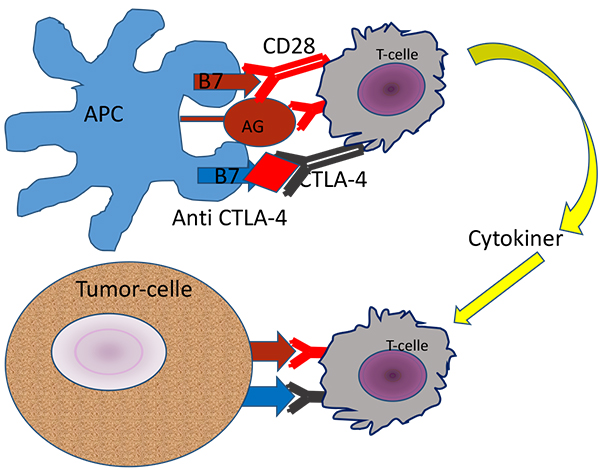
Figur 2b. Blokkering av CTLA-4 med antistoff utløser frigjøring av cytokiner fra en regulatorisk T-celle etter gjenkjenning av antigen. Cytokiner stimulerer en cytotoksisk t-celle til drap av tumorcelle.
Metastatisk malignt melanom er kreft med svært dårlig prognose. I 2010 ble det i New England Journal of Medicine publisert en studie hvor CTLA-4 antistoffet ipilimumab ga signifikant bedre overlevelse enn annen behandling (1). I 2015 ble det i samme tidsskrift publisert en studie av kombinert behandling med antistoffer mot to «immun checkpoints», PD-1 og CTLA-4, ved metastatisk malignt melanom (2). Kombinasjonsbehandlingen ga revolusjonerende resultater med mer enn 50 prosent progresjonsfri overlevelse etter 15 måneder. Per 2018 har Food and Drug Administration i USA (FDA) godkjent 6 ulike antistoffer mot CTLA-4, PD-1 og PDL-1 til behandling av malignt melanom, ikke-småcellet lungekreft, nyrekreft, Hodgkins lymfom, Merkel cellekreft og urothelial kreft.
Å ta bort naturlige bremser i immunforsvaret kan gi uønskede bieffekter. Alvorlige bivirkninger av behandlingen er dessverre relativt vanlige. Alvorlig kolitt kan kreve høye doser steroider for å hindre fatale komplikasjoner. Andre kjente bivirkninger er karditt, pneumonitt, artritt, meningitt, vaskulitt, nefritt, nevritt, anemi, leukopeni og trombopeni. Det endokrine systemet går heller ikke fri. I de initiale studiene med ipilimumab var dosene høyere enn det som brukes i dag, og ti prosent av pasientene utviklet hypofysitt under behandlingen. Tyreoiditt med både hyper- og hypotyreose er svært vanlige bivirkninger. Det positive for pasientene er at prognosen for dem som får autoimmune bivirkninger ser ut til å være bedre hva gjelder kreftsykdommen (3).
Lymfocyttisk hypofysitt er en sjelden autoimmun tilstand med angitt insidens på 1 per 9 millioner per år. Den reelle forekomsten er nok vesentlig høyere. Ved behandling med nivulomab (PD-1 antistoff) vil mindre enn en prosent av pasientene utvikle hypofysitt, mens ipilimumab gir denne bivirkningen hos 2-6 % av pasientene (4). Tilstanden debuterer med akutt hodepine og i tillegg har pasientene tegn på kortisolmangel med kvalme, hypotensjon og asteni. Sepsis og intracerebrale katastrofer må utelukkes, men diagnostikken må ikke forsinke livsviktig behandling med glukokortikoider. MR av hode og hypofysen vil ved hypofysitt vise en forstørret kontrastladende hypofyse uten utvidelse av sella gropen. Oppad mot synsnervekrysningen vil hypofysen ved hypofysitt ofte ha form som en takvinkel, men sikre radiologiske kriterier for diagnosen finnes ikke (figur 3). I akuttfasen vil hypofysens hormonelle akser være påvirket og gi et bilde av total hypofyseforlappssvikt. Synsbanepåvirkning sees sjelden, og svikt i baklapp med polyuri er heller ikke vanlig. I løpet av måneder vil hevelsen i hypofysen gå tilbake. Nesten alle pasientene utvikler varig ACTH-mangel og dermed sekundær binyrebarksvikt (5). De øvrige hypofyseaksene vil som regel normaliseres.
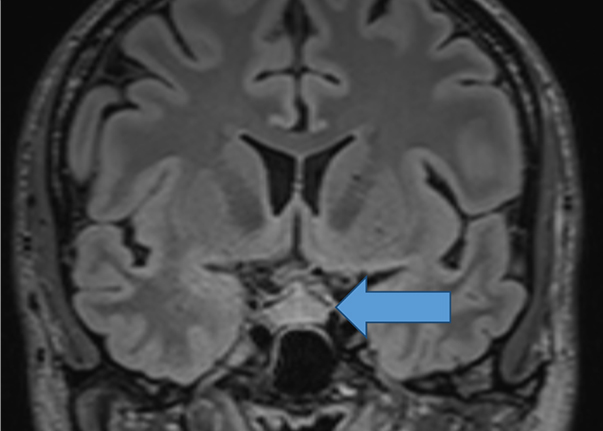
Figur 3. Forstørret kontrastladende hypofyse med «teltformet» tak. Sammen med anamnese, klinikk og blodprøver kan dette gi mistanke om hypofysitt. (Pasienten har samtykket til publikasjon av bildet).
Akutt binyrebarksvikt kan være en livstruende tilstand som krever rask behandling med glukokortikoider (intravenøst eller intramuskulært) og intravenøs væske, se nasjonal veileder i endokrinologi (www.endokrinologi.no). Når diagnosen er stilt, er behandlingen enkel å gjennomføre. Alle indremedisinere og onkologer bør være godt kjent med denne alvorlige bivirkning av moderne kreftbehandling. Når det akutte bildet klinger av, trappes glukokortikoid-dosen ned til vanlige doser for erstatningsbehandling, for eksempel kortison 25 mg ½ tablett morgen og midt på dagen. Dosene økes på vanlig måte ved infeksjonssykdommer eller annet stress. Pasientene må få skriftlig informasjon om kortisolmangel, og de skal utstyres med steroidmangelkort (figur 4). Dersom man i forløpet ønsker å vurdere om egenproduksjon av kortisol er normalisert kan en måle medikamentfastende kortisol i morgenprøve, eller gjøre en synachten test.

Figur 4. Alle pasienter med kortisolmangel skal utstyres med informasjonskort. Kontakt ROAS-registeret ved Helse-Bergen for å få tilsendt kort.
Ved kraftig hodepine i akuttfasen kan glukokortikoider i høy dose dempe symptomene, men behandlingen forhindrer ikke ACTH-svikten. Det er derimot data som taler for at glukokortikoider i stor dose reduserer effekten på kreftsykdommen (6).
Spesielt PD-1 antistoff gir risiko for tyreoideasykdom. Hypotyreose kan opptre raskt og behandles på vanlig måte med levotyroksin tabletter. Forløpet av hypertyreose minner om det en ser ved subakutt tyreoiditt med initialt svært høyt stoffskifte, som i løpet av uker går over i hypotyreose (7). I akuttfasen vil ofte symptomatisk behandling med betablokker være tilstrekkelig. Hypertyreosen skyldes stor lekkasje av hormoner fra tyreoidea som i liten grad påvirkes av tyreostatika. Pasientene er som regel TRAS og anti-TPO negative. Scintigrafi av tyreoidea viser redusert opptak.
Det er i tillegg rapportert bivirkninger med primær binyrebarksvikt og diabetes mellitus. Diabetes mellitus på bakgrunn av øycelleinflammasjon skyldes insulinmangel som kan debutere med ketoacidose. Ketoacidose er en akutt medisinsk tilstand som krever rask diagnostikk og behandling.
Moderne onkologisk immunterapi har bedret prognosen for enkelte kreftformer dramatisk. Behandlingen har høy frekvens av alvorlige bivirkninger som alle leger bør kjenne til. Når pasienter som mottar slik behandling blir akutt syke må kortisolmangel mistenkes og behandling iverksettes uten forsinkelse. Pasienten med kortisolmangel må få tildelt kortisolmangelkort.
Referanser