Antibiotikaresistens er erklært som en hovedtrussel mot liv og helse for hele verdens befolkning. Store nasjonale og internasjonale handlingsprogram er etablert for å bremse og redusere utbredelsen av mikrober med resistensegenskaper og gener som koder for dette. Norge er blant landene med lavest forekomst av antibiotikaresistens, men utviklingen følger likevel trender i Europa og verden for øvrig. I løpet av det siste tiåret har det norske resistensbildet endret seg betydelig, og det er viktigere enn noen gang å kjenne til hvilke problembakterier vi kan stå overfor i infeksjonsbehandling og smittevern.
Norsk overvåkingssystem for antibiotikaresistens hos mikrober (NORM) ble etablert som et nasjonalt helseregister i 1999. Registeret innhenter hvert år data fra alle mikrobiologiske laboratorier i Norge for utvalgte infeksjoner, bakterier og antibiotika. Data er lett tilgjengelig for publikum i nettversjonen av NORM/NORM-VET rapporten og kartprogrammet NORM-atlas (https://norm-atlas.no/). Her kan man følge utvikling av antibiotikaresistens over tid og forskjeller mellom regioner i Norge. I dette innlegget har vi fokusert på noen sentrale resistensfenomener i den siste tiårsperioden. NORM-rapporten viser hele resistensbildet, inkludert økt forekomst av resistens hos flere klinisk viktige kombinasjoner av bakterie og antimikrobielt middel som ikke nevnes her.
Meticillin-resistente gule stafylokokker (MRSA) som er motstandsdyktige mot alle betalaktam-antibiotika, var lenge kjent som det mest utbredte resistensproblemet i verden, især i sykehus. Tall fra Meldingssystem for smittsomme sykdommer (MSIS) viser at forekomsten av MRSA infeksjoner og kolonisering har vært jevnt økende i Norge i perioden 2008-2017 (1). Denne økningen skyldes først og fremst flere meldte tilfeller av MRSA kolonisering. Forekomsten av MRSA infeksjoner var svakt økende fram til 2014, men har deretter flatet ut ved 14-15 tilfeller per 100 000 person-år. Økningen i MRSA infeksjoner var delvis knyttet til immigrasjon og utenlandsreiser (2). Overvåkingen i NORM viser at andelen MRSA har vært under 1% ved infeksjoner med gule stafylokokker i blodbanen og under 1,6% ved sårinfeksjoner helt siden registreringen begynte for snart tjue år siden.
Tarmbakterier står for den mest dramatiske økningen i forekomst av antibiotikaresistens i Norge det siste tiåret. Dette skyldes stadig større utbredelse av gener som koder for produksjon av bredspektrede betalaktamaser (ESBL). ESBL-produserende bakterier er resistente mot penicilliner, monobaktamer og cefalosporiner. Overvåkingen i NORM av blodbaneinfeksjoner i perioden 2008-2017 viser økning i forekomsten av Escherichia coli ESBL fra 1,5% til 6,6% og Klebsiella pneumoniae ESBL fra 2,0% til 5,3% (1). Andel ESBL ved blodbaneinfeksjoner varierer mellom helseregionene i Norge, men generelt forekommer E. coli ESBL hyppigere ved de store sykehusene. Regioner med særlig høy forekomst av alvorlige infeksjoner forårsaket av K. pneumoniae ESBL har i samme periode rapportert utbrudd i sykehus. Den økende trenden i E. coli og K pneumoniae ESBL sees også for urinveisinfeksjoner, men forekomsten av ESBL er lavere enn ved blodbaneinfeksjoner for begge agens; i 2017 var forekomsten henholdsvis 3,0% og 3,7%.
Karbapenemase-produserende E. coli, K. pneumoniae, Acinetobacter og Pseudomonas aeruginosa er blant de mest kritiske resistensproblemene i verden. Karbapenemase kodes av gen på plasmider eller andre mobile genetiske elementer, som lett kan overføres mellom bakterier. Ved infeksjoner med slike superresistente bakterier, er det få behandlingsmuligheter og dødeligheten er høy. Karbapenem-resistente bakterier har også kommet til Norge (3), og det absolutte antallet pasienter med infeksjon eller kolonisering stiger år for år med totalt 35 tilfeller i 2017 (Figur 1) (1). Karbapenemase-produserende E. coli og K. pneumoniae utgjør ca 90% av tilfellene. To av tre tilfeller av karbapenem-resistens som ble meldt til MSIS i 2017, kunne knyttes til utenlandssmitte (Figur 2).
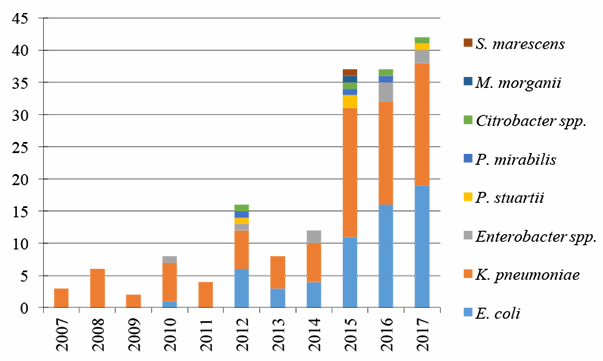
Figur 1. Antall karbapenemase-produserende Enterobacterales isolater fordelt på bakterietyper i Norge i 2007-2017. Figur kopiert fra artikkel ved Samuelsen Ø, Sundsfjord A, Elstrøm P og Kacelnik O i NORM/NORM-VET 2017 (1).
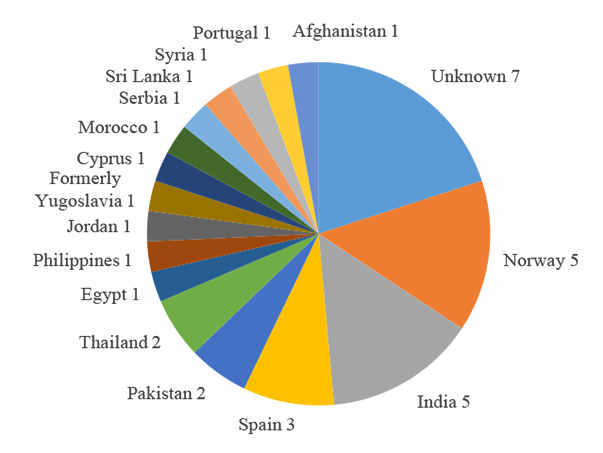
Figur 2. Smittested for tilfeller av kolonisering eller infeksjoner med karbapenemase-produserende Enterobacterales i Norge i 2017. Figur kopiert fra artikkel ved Samuelsen Ø, Sundsfjord A, Elstrøm P og Kacelnik O i NORM/NORM-VET 2017 (1).
Det er voksende bekymring knyttet til resistens mot gentamicin. NORM data viser at gentamicin-resistens hos E. coli ved blodbaneinfeksjoner økte fra ca 1% til 7-8% siden tusenårsskiftet og fram til 2017. I løpet av det siste tiåret var forekomsten av høygradig gentamicin-resistens relativt stabil rundt 40-50% hos Enterococcus faecium og fallende fra ca 35% til ca 15% hos Enterococcus faecalis ved infeksjoner i blodbanen. Denne utbredte gentamicin-resistensen hos klinisk viktige bakterier truer effekten av standard empirisk regime med et aminoglykosid i kombinasjon med benzylpenicillin til behandling av sepsis hos pasienter i norske sykehus. I tillegg er en tredel av gentamicin-resistente E. coli ESBL-produserende. Dermed snevres behandlingsalternativene ytterligere inn, og situasjonen kan på sikt bli svært problematisk.
Resistens mot ciprofloxacin har nådd et kritisk høyt nivå. I 2017 var 18% av E. coli fra infeksjoner i blodbanen resistente mot ciprofloxacin. NORM overvåkingen viser at forekomsten av ciprofloxacin-resistens økte jevnt i takt med økende forbruk av ciprofloxacin i perioden 2000-2011. På tross av 40% fall i forbruket fra 2012 og fram til 2017, har resistensforekomsten fortsatt å stige. Det samme mønsteret sees internasjonalt. Foreløpig vet man ikke om reduksjon i bruk av ciprofloxacin vil ha effekt på resistensproblemet på befolkningsnivå. Fortsatt overvåking vil kunne svare på dette.
Studier har imidlertid vist at reduksjon av antibiotikabruk alene i liten grad påvirker forekomst av resistente bakterier både hos mennesker og dyr (4). Derfor er det behov for utvikling av nye og smartere strategier basert på kunnskap om resistensmekanismer, egenskaper hos bakterien, medikamentet, verten og miljøfaktorer.
En fersk studie i The Lancet Infectious Diseases viser for første gang beregninger for sykelighet og død forårsaket av infeksjoner med antibiotikaresistente bakterier blant mennesker i hele Europa (5). Beregningene er gjort for 2015 og inkluderer antibiotikaresistente bakterier som regnes å ha betydning for folkehelsa. For Europa estimerte man at slike bakterier forårsaket opptil 38000 dødsfall og 1 million helsetapsjusterte leveår – DALY (pga. for tidlig død, svekket helse eller funksjonstap), mens tilsvarende tall for Norge var 69 dødsfall og opptil 2000 helsetapsjusterte leveår (5).
Hovedtyngden av sykdom og død knyttet til antibiotikaresistens bæres av land sør og øst i Europa. Italia og Hellas har langt større beregnet sykdomsbyrde enn øvrige land, primært på grunn av karbapenem- eller kolistin-resistente bakterier. Begge landene har publisert nasjonale handlingsplaner med vekt på å begrense spredning og infeksjoner med disse dødelige bakteriene i sykehus i tillegg til å etablere bedre praksis for antibiotikabruk.
Fire antibiotikaresistente bakterietyper er årsak til to tredeler av sykdomsbyrden målt i helsetapsjusterte leveår i Europa; E. coli ESBL er mest utbredt og veier tyngst foran MRSA, fulgt av karbapenem-resistent P. aeruginosa og K. pneumonia ESBL (5). Høy dødelighet ved infeksjon med karbapenem- og kolistin-resistente bakterier gjør at nærmere 40% av sykdomsbyrden kan tilskrives disse superresistente bakteriene. Både kjønn og alder er bestemmende for fordeling av sykdomsbyrden forårsaket av antibiotikaresistente bakterier; mer enn 60% av sykdomsbyrden er hos menn, og spebarn og eldre over 65 år påføres størst tap av liv og helse. Samtidig sier beregningene at om lag 75% av sykdom og død som følge av infeksjoner med antibiotikaresistente bakterier oppstår hos pasienter i sykehus eller sykehjem. Ettersom det er anslått at om lag halvparten av alle sykehusinfeksjoner kan forebygges (6), vil sykdomsbyrden forårsaket av antibiotikaresistente bakterier kunne reduseres betydelig ved styrket infeksjonsforebygging og smittevern i helsevesenet.
Studien i The Lancet Infectious Diseases viser også at sykdomsbyrden i Europa har økt for alle antibiotikaresistente bakterier i perioden 2007-2015 (5). Antall infeksjoner og dødsfall har økt raskest for karbapenem-resistente K. pneumonia med seksdoblet byrde, fulgt av karbapenem-resistente E. coli, og ESBL E. coli og K. pneumonia. Dette er dramatiske endringer i resistensbildet som krever oppmerksomhet og koordinerte tiltak over landegrensene.
Parallelt med de nye resistensutfordringene er det viktig å ha kontinuerlig fokus på MRSA og kartlegge og forstå endringer i MRSA epidemiologien. Samlede overvåkingsdata fra Europa viser at andel MRSA ved S. aureus infeksjoner i blodbanen gikk ned fra 27% i 2007 til 17% i 2015 (4). Samtidig har studier funnet økende insidens av MRSA infeksjoner (2,3); i Lancet-studien økte forekomsten av MRSA infeksjoner med 23% i perioden 2007-2015 (5). Ved nærmere analyse viser man at økningen i MRSA infeksjonsrisiko har funnet sted blant barn under fire år og eldre over 55 år (Figur 3). Slik kan demografisk og medisinsk utvikling med økende andel eldre mennesker og flere barn som lever etter for tidlig fødsel, bidra til en voksende befolkning av individer med forhøyet sårbarhet for S. aureus infeksjoner. Dette kan delvis forklare paradokset med lavere resistens og økt sykdomsbyrde for MRSA.
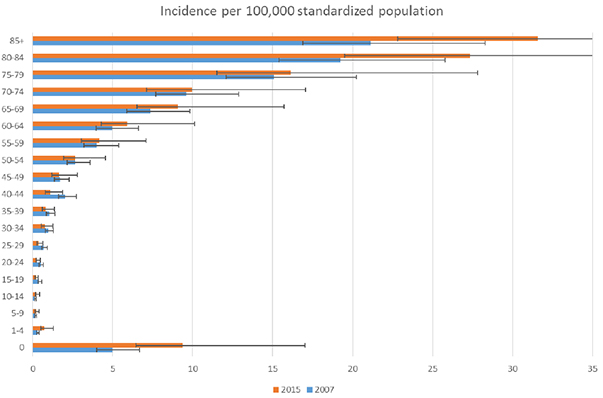
Figur 3: Insidens av MRSA infeksjoner i blodbanen for ulike aldersgrupper i 2007 og 2015. Søylene viser median og 95% usikkerhetsintervall. Figur kopiert fra “Supplement to: Cassini A, Högberg LD, Plachouras D, et al. Attributable deaths and disability-adjusted life-years caused by infections with antibiotic-resistant bacteria in the EU and the European Economic Area in 2015: a population-level modelling analysis. Lancet Infect Dis 2018; published online Nov 5.
http://dx.doi.org/10.1016/ S1473-3099(18)30605-4)” og gjenbrukt her i henhold til Creative Commons Attribution License (CC BY).
Den raske økningen av især multiresistente tarmbakterier kan innen relativt kort tid føre til en global krise i behandling av alvorlige infeksjoner. For å forebygge helsetap og for tidlig død av infeksjoner trengs nye tiltak mot antibiotikaresistens – som kan hindre at resistens oppstår og spres. I tråd med dette har det i løpet av det siste tiåret vokst fram et sterkere «En helse» perspektiv. Bakterier og resistensgener som er årsak til infeksjoner hos pasientene, gjenfinnes i stor grad også i mikrobiota i den friske befolkningen, i tillegg til hos dyr og i miljøet (7, 8). Antibiotikaresistens respekterer hverken geografiske eller biologiske barrierer. «En helse» for mennesker, dyr og miljø er derfor et helt nødvendig utgangspunkt for globalt arbeid mot antibiotikaresistens. Dette har også vært grunnlag for samlet flerfaglig norsk innsats i overvåking av antibiotikabruk og resistens både hos mennesker og dyr i den årlige NORM/NORM-VET rapporten (1).
Det er velkjent at den store fremveksten av bakterier med manglende følsomhet for antibiotika skyldes feil bruk og overforbruk av antibiotika i helsevesenet, veterinærmedisinen og landbruket, samt forurensning til miljøet. Videre spredning av antibiotikaresistente bakterier og resistensgener i vår del av verden er primært avhengig av kvaliteten og omfanget av smittevern, og oppmerksomhet rundt importsmitte ved reiser og immigrasjon. I andre deler av verden er det fremdeles store utfordringer knyttet til vannkvalitet og sanitære forhold. WHO sine mål for «En helse» og bevaring av virksomme og trygge antibiotika til behandling av infeksjoner hos mennesker og dyr vektlegger riktig diagnostikk og bruk av antibiotika, inkludert tilgang på dette (7).
Referanser