Autonom kortisolsekresjon skyldes overproduksjon av kortisol fra binyrer med tumor eller hyperplasi. Tilstanden foreligger hos 5 – 30% av pasienter med binyreinsidentalom, og er ofte preget av lavgradig hyperkortisolisme uten klassiske symptomer og funn på Cushings syndrom. Pasienter med autonom kortisolsekresjon kan ha en eller flere komponenter av det metabolske syndrom, og trolig derfor økt kardiovaskulær morbiditet og mortalitet.
Tilfeldig funn av tumor eller hyperplasi i binyren (binyreinsidentalom) er vanlig med den utstrakte bruken av CT og MR i helsevesenet. Opptil 5 % av befolkningen har slike binyreinsidentalom. Prevalensen er høyere hos eldre og hos pasienter med hypertensjon, diabetes type 2 og overvekt [1, 2]. I 10-15% av tilfellene er binyreincidentaomene bilaterale [3]. De fleste binyretumorer er godartede, men binyrebarkkreft og metastaser må utelukkes [2]. CT binyrer uten kontrast er den beste modaliteten for å skille mellom benigne og maligne lesjoner. Viktige kriterier for å ekskludere malignitet er tumorstørrelse under 4 cm, tumortetthet under 10-20 hounsfield enheter og rask relativ eller absolutt utvasking av kontrast ved kontrastforsterket CT [4].
De fleste binyreinsidentalomene produserer ikke biologisk aktive steroider. Studier viser imidlertid at ca. 1 % produserer aldosteron, omlag 3 % er feokromocytom, og 5-30 % har varierende grad av kortisoloverproduksjon [5, 6]. Kortisoloverproduksjon er vanligere ved bilaterale binyretumorer/hyperplasi enn ved unilaterale [8]. Når kortisoloverproduksjonen forårsakes av binyreadenom eller hyperplasi kalles tilstanden autonom kortisolsekresjon (AKS) [4].
Pasienter med AKS har et varierende symptombilde fra å være helt asymptomatiske til å ha fulminant Cushings syndrom (Figur 1). Lavgradig hyperkortisolisme er assosiert med det metabolske syndrom. Flere studier har vist økt prevalens av både diabetes mellitus type 2 [5, 6] og hypertensjon [5, 9], overvekt og hyperkolesterolemi [5, 9, 10]. Den ugunstige metabolske profilen fører til økt risiko for både kardiovaskulære hendelser [5, 9, 11] og økt kardiovaskulær mortalitet [11, 12]. I tillegg har AKS negativ påvirkning på beinhelse med høyere prevalens av osteoporose og brudd sammenliknet med bakgrunnsbefolkningen [13]. Svært få pasienter med AKS utvikler fulminant Cushings syndrom[4].
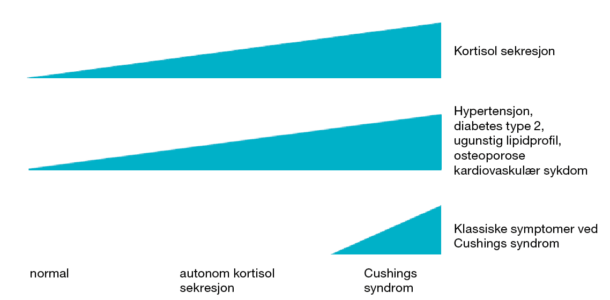
Figur 1. Økende kortisolsekresjon er assosiert med komponenter av det metabolske syndrom. Kun ved riktig høye kortisolkonsentrasjoner finner man klassiske symptom og tegn på fulminant Cushings syndrom.
AKS defineres ofte som en kombinasjon av lav plasma-ACTH i en morgenprøve (<2.5 pmol/L), og inadekvat suppresjon av kortisol etter kort deksametason suppresjonstest (DST). Kortisol mellom 50 og 140 nmol/L etter DST kalles «mulig ACS», og kortisol over 140 nmol/L kalles ACS [4]. Figur 2 demonstrerer deksametasons virkning på den kortikotrope akse, med tilstedeværelse av en tumor i binyren som produserer for mye kortisol. DST har lav diagnostisk spesifisitet (80%) og gir dermed mange falskt positive prøvesvar. Lav biotilgjengelighet av deksametason (pga. dårlig absorbsjon eller rask omsetning) og bruk av østrogener (p-piller) er de viktigste feilkildene, og medfører fare for overdiagnostisering av AKS. Lav biotilgjengelighet kan utelukkes ved samtidig måling av deksametason og kortisol under DST [14]. Tilbud om dexamethasonmåling er tilgjengelig ved Hormonlaboratoriet, Haukeland Universitetssykehus i Bergen, og vil snart bli det også ved Hormonlaboratoriet på Aker, Oslo Universitetssykehus.
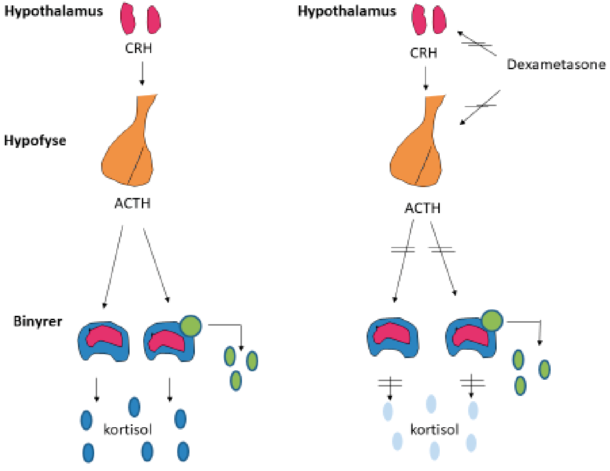
Figur 2. Produksjon av kortisol fra binyrebarken stimuleres vanligvis av CRH fra hypothalamus, og ACTH fra hypofysen. Ved tilstrekkelig kortisol tilstede undertrykkes denne stimuleringen. Når man inntar dexametason vil kroppen oppleve å ha tilstrekkelig kortisol, og produksjonen av CRH og ACTH undertrykkes. Et adenom i binyren med autonom kortisolsekresjon er imidlertid uavhengig av denne overordnede kontrollen, og hemmes ikke av dexametason. Figur av Bjørn G. Nedrebø, modifisert og gjengitt med tillatelse.
Også ACTH-analysen er beheftet med usikkerhet. Analytisk kryssreaktivitet og interferens kan lede til at man måler falsk forhøyet verdi og dermed overser pasienter med lav/supprimert ACTH. Dette kan føre til underdiagnostikk av AKS [15, 16].
Spyttkortisol tatt om kvelden er mye brukt i diagnostikken av fulminant Cushings syndrom. Testen er imidlertid ikke godt validert for AKS og inngår ikke i den anbefalte utredningsalgoritmen for binyreinsidentalom [4]. Døgnurinmåling av kortisolsekresjon, som er ansett som gullstandard for diagnostikk av fulminant Cushings syndrom, er for lite sensitiv til å identifisere pasienter med AKS [17].
I fremtiden vil nok steroid profilering (simultan måling av mange forløpere og nedbrytningsprodukt i kortisolsyntesen) i blod og urin, samt genetiske analyser bli et viktig tilskudd til utredningen.
Den mest hensiktsmessige behandlingen av pasienter med AKS er fremdeles under debatt. Flere mindre studier har vist bedring i metabolske parametre ved adrenalektomi sammenliknet med konservativ behandling av de komorbide tilstandene [18-21]. Medikamentell behandling som hemmer kortisolsekresjonen er lite utprøvd ved AKS. Erfaring fra fulminant Cushings syndrom er at det kan være vanskelig å titrere og monitorere slik behandling og at faren for bivirkninger er stor.
Dessverre er kunnskapsgrunnlaget vårt dårlig for hva som er best behandling av AKS. De fleste studier er retrospektive eller tverrsnittundersøkelser med ulike definisjoner av AKS, ulike endepunkter og kort oppfølgingstid. Kun en randomisert kontrollert studie er publisert [20]. Denne fulgte 23 opererte og 22 konservativt behandlede pasienter med binyreinsidentalom og AKS over 7 år. Studien fant bedret metabolsk profil i den opererte gruppen. Prospektive kontrollerte studier med lang tids oppfølging og harde endepunkt (kardiovaskulære hendelser, død) mangler fremdeles. Europeiske retningslinjer anbefaler individuell håndtering av pasienter med AKS basert på grad av metabolske komplikasjoner, generell kardiovaskulær risikoprofil og pasientens ønsker [4].
Valg av kirurgisk behandling er spesielt utfordrende ved bilaterale forandringer. Hos slike pasienter er det vanskelig å avgjøre hvilken binyre som skal fjernes. Noen sentre opererer den binyren med størst tumor og hevder at suksessraten er god [22]. Andre forsøker å kun fjerne tumorvev på begge sider samtidig som en forsøker å bevare normalt binyrevev [23]. Av og til kan bilateral adrenalektomi være aktuelt, men da hovedsakelig ved fulminant Cushings syndrom.
Studier av primær hyperaldosteronisme har lært oss at foci for hormonell overproduksjon i binyrene kan være mikroskopiske, og dermed ikke synlig ved CT og MR. Binyrevenekateterisering anses derfor som gullstandard for å skille mellom bilateral og unilateral overproduksjon [24]. Ved AKS har inntil nylig binyrevenkateterisering kun vært brukt i en liten studie og enkelte kasuistiske rapporter [25]. Binyrescintigrafi (kolesterolscintigrafi) er en alternativ metode brukt for å skille mellom uni- og bilateral overproduksjon av kortisol. Metoden har begrenset tilgjengelighet, og det er ikke klare kriterier for tolkning av resultatene [26, 27]. Vår forskningsgruppe har nylig vist at binyrevenekateterisering er en nyttig undersøkelse ved AKS for å avgjøre om kortisolsekresjonen er uni- eller bilateral [28]. Både binyrevenekatetersiering og binyrescintigrafi ved AKS er tilgjengelig ved Haukeland Universitetssykehus.
AKS er hyppig forekommende hos pasienter med binyreincidentalom og er assosiert med metabolske komplikasjoner som hypertensjon, diabetes mellitus type 2, overvekt, ugunstig kolesterolprofil og osteoporose. Pasientene har økt risiko for kardiovaskulær sykdom og død i forhold til bakgrunnsbefolkningen. Diagnostikken er vanskelig da de tilgjengelige testene har utilstrekkelig sensitivitet og/eller spesifisitet. Behandlingen er omdiskutert med manglende kunnskapsgrunnlag. Inntil kunnskapsgrunnlaget blir bedre er det rimelig å vurdere adrenalektomi ved signifikant metabolsk byrde og om pasienten selv ønsker slik behandling. Diagnostikk med tanke på om kortisolsekresjonen er uni- eller bilateral bør vurderes før en eventuell adrenalektomi.
Referanser
1. Barzon, L., et al., Prevalence and natural history of adrenal incidentalomas. Eur J Endocrinol, 2003. 149(4): p. 273-85.
2. Mantero, F., et al., A survey on adrenal incidentaloma in Italy. Study Group on Adrenal Tumors of the Italian Society of Endocrinology. J Clin Endocrinol Metab, 2000. 85(2): p. 637-44.
3. Barzon, L., et al., Incidentally discovered adrenal tumors: endocrine and scintigraphic correlates. J Clin Endocrinol Metab, 1998. 83(1): p. 55-62.
4. Fassnacht, M., et al., Management of adrenal incidentalomas: European Society of Endocrinology Clinical Practice Guideline in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol, 2016. 175(2): p. G1-G34.
5. Morelli, V., et al., Long-term follow-up in adrenal incidentalomas: an Italian multicenter study. J Clin Endocrinol Metab, 2014. 99(3): p. 827-34.
6. Terzolo, M., A. Pia, and G. Reimondo, Subclinical Cushing’s syndrome: definition and management. Clin Endocrinol (Oxf), 2012. 76(1): p. 12-8.
7. Vassiliadi, D.A. and S. Tsagarakis, Endocrine incidentalomas–challenges imposed by incidentally discovered lesions. Nat Rev Endocrinol, 2011. 7(11): p. 668-80.
8. Vassiliadi, D.A., et al., High prevalence of subclinical hypercortisolism in patients with bilateral adrenal incidentalomas: a challenge to management. Clin Endocrinol (Oxf), 2011. 74(4): p. 438-44.
9. Di Dalmazi, G., et al., Progressively increased patterns of subclinical cortisol hypersecretion in adrenal incidentalomas differently predict major metabolic and cardiovascular outcomes: a large cross-sectional study. Eur J Endocrinol, 2012. 166(4): p. 669-77.
10. Terzolo, M., et al., Adrenal incidentaloma: a new cause of the metabolic syndrome? J Clin Endocrinol Metab, 2002. 87(3): p. 998-1003.
11. Di Dalmazi, G., et al., Cardiovascular events and mortality in patients with adrenal incidentalomas that are either non-secreting or associated with intermediate phenotype or subclinical Cushing’s syndrome: a 15-year retrospective study. Lancet Diabetes Endocrinol, 2014. 2(5): p. 396-405.
12. Debono, M., et al., Cortisol as a marker for increased mortality in patients with incidental adrenocortical adenomas. J Clin Endocrinol Metab, 2014. 99(12): p. 4462-70.
13. Chiodini, I., et al., Bone mineral density, prevalence of vertebral fractures, and bone quality in patients with adrenal incidentalomas with and without subclinical hypercortisolism: an Italian multicenter study. J Clin Endocrinol Metab, 2009. 94(9): p. 3207-14.
14. Ueland, G.A., et al., Simultaneous assay of cortisol and dexamethasone improved diagnostic accuracy of the dexamethasone suppression test. Eur J Endocrinol, 2017. 176(6): p. 705-713.
15. Yener, S., et al., Interference in ACTH immunoassay negatively impacts the management of subclinical hypercortisolism. Endocrine, 2017. 56(2): p. 308-316.
16. Pecori Giraldi, F., et al., Assessment of ACTH assay variability: a multicenter study. Eur J Endocrinol, 2011. 164(4): p. 505-12.
17. Nieman, L.K., et al., The diagnosis of Cushing’s syndrome: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab, 2008. 93(5): p. 1526-40.
18. Chiodini, I., et al., Beneficial metabolic effects of prompt surgical treatment in patients with an adrenal incidentaloma causing biochemical hypercortisolism. J Clin Endocrinol Metab, 2010. 95(6): p. 2736-45.
19. Iacobone, M., et al., Adrenalectomy may improve cardiovascular and metabolic impairment and ameliorate quality of life in patients with adrenal incidentalomas and subclinical Cushing’s syndrome. Surgery, 2012. 152(6): p. 991-7.
20. Toniato, A., et al., Surgical versus conservative management for subclinical Cushing syndrome in adrenal incidentalomas: a prospective randomized study. Ann Surg, 2009. 249(3): p. 388-91.
21. Tsuiki, M., et al., Cardiovascular risks and their long-term clinical outcome in patients with subclinical Cushing’s syndrome. Endocr J, 2008. 55(4): p. 737-45.
22. Debillon, E., et al., Unilateral Adrenalectomy as a First-Line Treatment of Cushing’s Syndrome in Patients With Primary Bilateral Macronodular Adrenal Hyperplasia. J Clin Endocrinol Metab, 2015. 100(12): p. 4417-24.
23. Kageyama, Y., et al., A case of ACTH-independent bilateral macronodular adrenal hyperplasia successfully treated by subtotal resection of the adrenal glands: four-year follow-up. Endocr J, 2002. 49(2): p. 227-9.
24. Funder, J.W., et al., The Management of Primary Aldosteronism: Case Detection, Diagnosis, and Treatment: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab, 2016. 101(5): p. 1889-916.
25. Young, W.F., Jr., et al., The clinical conundrum of corticotropin-independent autonomous cortisol secretion in patients with bilateral adrenal masses. World J Surg, 2008. 32(5): p. 856-62.
26. Katabami, T., et al., Contralateral adrenal suppression on adrenocortical scintigraphy provides good evidence showing subclinical cortisol overproduction from unilateral adenomas. Endocr J, 2016. 63(12): p. 1123-1132.
27. Papierska, L., et al., Adrenal (131)I-6beta-iodomethylnorcholesterol scintigraphy in choosing the side for adrenalectomy in bilateral adrenal tumors with subclinical hypercortisolemia. Abdom Imaging, 2015. 40(7): p. 2453-60.
28. Ueland, G.A., et al., Adrenal venous sampling for assessment of autonomous cortisol secretion. J Clin Endocrinol Metab, 2018.