Hepatitt C-infeksjon er et alvorlig helseproblem med høy mortalitet som i høy grad rammer en marginalisert pasientgruppe. Svært effektive legemidler mot hepatitt C er nå tilgjengelig for alle og innen 2023 skal hepatitt C elimineres som folkehelseproblem i Norge. For å nå dette ambisiøse målet kreves tverrfaglig koordinert innsats og god samhandling på tvers av nivåene i helsetjenesten.
Høyt på dagsorden
Infeksjon med hepatitt C virus (HCV) forårsaker betydelig mortalitet som følge av levercirrhose og hepatocellulært karsinom (HCC) (1). Globalt lever omlag 70 millioner mennesker med kronisk HCV-infeksjon og majoriteten av disse vet ikke at de er smittet (2). I Norge regner vi nå med at ca. 10 000 pasienter har kronisk HCV-infeksjon, hvorav 80% er smittet gjennom injiserende rusmiddelbruk og over halvparten fortsatt er rusavhengige.
WHO har som mål at HCV-infeksjon skal elimineres som trussel mot folkehelsen innen 2030, noe som innebærer 80% reduksjon i insidens og 65% reduksjon i mortalitet (2). I 2018 fulgte Norge opp med en revidert nasjonal strategi med mål om eliminasjon av HCV-infeksjon innen 2023 (3). Våren 2019 lanserte Helsedirektoratet en implementeringsplan for denne ambisiøse strategien (4). Det understrekes her at de regionale helseforetakene skal invitere kommunene i sin region til et felles samarbeid for å sikre at flest mulige diagnostiseres, og at det må utarbeides rutiner for forenklede behandlingsforløp slik at alle med kronisk HCV-infeksjon kan tilbys behandling.
Direktevirkende antivirale legemidler
Få medisinske fremskritt kan måle seg med introduksjonen av direktevirkende antivirale legemidler (DAA) mot HCV-infeksjon i 2014. Fra et langvarig interferonbasert behandlingsregime med kun 50% kurasjonsrate og betydelige immunologiske, hematologiske og nevropsykiatriske bivirkninger, har vi nå fått svært effektive legemidler som kurerer infeksjonen hos mer enn 95% etter en tablettkur på 8-12 uker uten vesentlige bivirkninger (5). De få som ikke blir kurert vil ha god effekt av andrelinjebehandling.
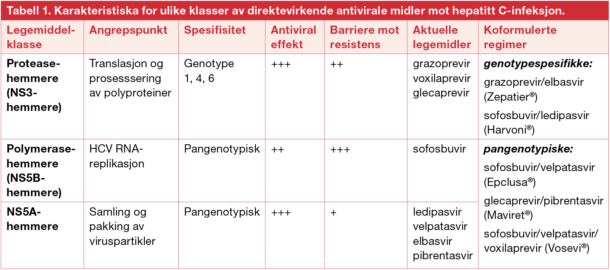
DAA-behandling representerer et paradigmeskifte i HCV-feltet og baserer seg på direkte hemming av tre angrepspunkter i virusets replikasjonssyklus. Dette gir opphav til tre klasser av legemidler som kan kombineres på ulik måte, oftest i koformulerte tabletter (Tabell 1). Dette er trygge legemidler med få kontraindikasjoner, men proteasehemmere må ikke gis til pasienter med dekompensert leversykdom og sofosbuvir-baserte regimer må unngås hos pasienter med kronisk nyresykdom stadium 4-5. Interaksjoner med andre legemidler forekommer (www.hep-druginteractions.org). Risikoen for antiviral resistens er svært lav for de fleste pasienter, men i noen tilfeller er resistenstesting nyttig. Foretrukne behandlingsregimer i henhold til legemiddelinnkjøpssamarbeidets anbefalinger for 2019-2020 er vist i Tabell 2.
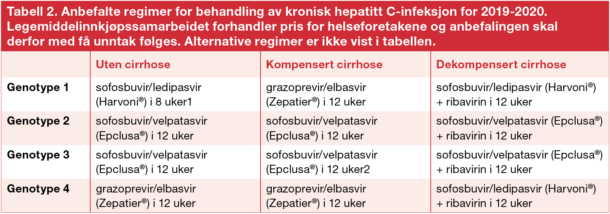
1 Forutsetter NS5A resistenstesting ved genotype 1a med virusmengde over 800 000 IU/ml
2 Forutsetter resistenstesting med negativ Y93H, eventuelt tillegg av ribavirin ved avansert cirrhose
Vellykket DAA-behandling defineres som ikke-påvisbart virus (HCV RNA) 12 uker etter avsluttet behandling (sustained virologic response). Pasienter som oppnår dette har klart bedret overlevelse og opptil 70 prosent redusert risiko for HCC sammenliknet med pasienter som ikke blir varig virusfri (6). Komplikasjoner til HCV-infeksjon var lenge den viktigste årsak til levertransplantasjon, men etter at DAA-behandling ble tilgjengelig, har man i både USA og i Europa observert en klar nedgang i antall transplantasjoner på grunn av HCV. Det foreligger også data som indikerer at fibroseutviklingen i leveren til en viss grad kan reverseres etter vellykket behandling.
Naturlig forløp av HCV-infeksjon
Akutt HCV-infeksjon er vanligvis asymptomatisk og diagnostiseres sjelden. For 20-40% er infeksjonen selvbegrensende med spontan virusfrihet innen 6 måneder, mens de resterende 60-80% utvikler kronisk infeksjon. Kronisk HCV-infeksjon er en langsomt progredierende tilstand med gradvis akkumulasjon av fibrose i leveren. Utvikling av levercirrhose kan ta 20-40 år, avhengig av individuelle risikofaktorer for progresjon, som alkoholoverforbruk og diabetes type 2/metabolsk syndrom (7). Først ved etablert cirrhose oppstår risiko for alvorlige komplikasjoner i form av HCC, portal hypertensjon og leversvikt. Før dette inntreffer er sykdommen oftest asymptomatisk.
Hos pasienter med cirrhose vil HCC utvikles hos ca. 5% per år så lenge infeksjonen er ubehandlet. Etter vellykket behandling reduseres denne risikoen betydelig, men er fremdeles 1–2% per år (6). Pasienter som har utviklet cirrhose skal derfor følges på ubestemt tid med halvårig ultralyd av leveren og blodprøver (alfa-føtoprotein) som ledd i HCC-overvåkning (8). Denne oppfølgingen har som mål å forbedre pasientoverlevelsen ved at en eventuell tumor oppdages tidlig og dermed blir tilgjengelig for kurativ behandling.
Kronisk HCV-infeksjon er en systemsykdom som også kan vise seg som ekstrahepatiske manifestasjoner sekundært til viral replikasjon i lymfocytter eller kronisk inflammasjon (9). De best beskrevne tilfellene oppstår på bakgrunn av kryoglubulinemi og inkluderer membranoproliferativ glomerulonefritt, kutan vaskulitt og visse typer B-cellelymfom. Det foreligger også en assosiasjon til kardiovaskulær sykdom og neurokognitive forstyrrelser, men sistnevnte er fortsatt kontroversielt.
Diagnostikk og stadieinndeling
HCV-smitte kan diagnostiseres gjennom påvisning av HCV-antistoff (anti-HCV), men tilstedeværelsen av antistoff skiller ikke mellom tidligere eller aktuell infeksjon og man må derfor utføre PCR for påvisning av HCV RNA. Kronisk HCV-infeksjon defineres ved påvisbar HCV RNA i minst seks måneder. For pasienter som har vært i risiko for HCV-smitte over noe tid, vil positiv HCV RNA i én prøve sannsynligvis innebære kronisk infeksjon og det er ikke nødvendig å gjenta testen før behandling gis.
Det finnes 7 genotyper (og nesten 70 subtyper) av HCV som skiller seg noe i virulens og geografisk distribusjon (10). Globalt dominerer genotype 1, mens i Norge utgjør genotype 3 50% og genotype 1 40% av tilfellene. Bestemmelse av genotype er i utgangspunktet nødvendig for valg av behandlingsregime (Tabell 1 og 2), men det finnes pangenotypiske behandlingsalternativer som gjør genotyping unødvendig hos pasienter som vil ha utfordringer med å følge opp nye undersøkelser (11).
Forenklet HCV-diagnostikk ved hjelp av pasientnære ”point-of-care” tester er nå tilgjengelig og muliggjør diagnostikk og oppstart av behandling under samme konsultasjon (11). Anti-HCV finnes som hurtigtest (5 minutter) hvor det kreves enten en bloddråpe fra finger eller saliva. Hurtig-PCR av HCV RNA i kapillærblod (60 minutter) kan gjøres via egne plattformer som mange steder allerede er tilgjengelig for diagnostikk av tuberkulose, og som nå er i ferd med å bli utprøvd i Norge. Det er også mulig å utføre ”Dried Blood Spots” med en tørket bloddråpe på et proteinbevarende pappkort som kan fraktes til aktuell testfasilitet.
Ved påvisning av kronisk HCV-infeksjon er det vesentlig å avklare hvorvidt det foreligger levercirrhose, da dette kan være avgjørende for valg av behandlingsregime og dessuten gir prognostisk informasjon med føringer for behovet for oppfølging etter behandling. Dette kan utføres raskt (<5 minutter) og non-invasivt med elastografi, som måler stivheten i levervevet ved hjelp av ultralyd-baserte teknikker (12). Den best etablerte metoden for dette er FibroScan®, som dessuten finnes i en bærbar variant. Ved leverstivhet <12 kPa foreligger svært lav sannsynlighet for cirrhose, mens denne risikoen øker betydelig ved leverstivhet 14-15 kPa og oppover. Risikoen for lever-relaterte komplikasjoner øker med økende leverstivhet, men ved målinger <20 kPa og normale trombocytter er sannsynligheten for signifikant portal hypertensjon ubetydelig. Dersom elastografi ikke er tilgjengelig, kan stadium av leversykdom også vurderes ut fra enkelt tilgjengelige serum-fibrosemarkører som APRI score (AST to Platelet Ratio Index) eller FIB-4.
HCV-behandling hos rusmiddelbrukere
HCV-smitte kan til en viss grad forebygges gjennom skadereduserende tiltak med legemiddelassistert rehabilitering (LAR) og tilgang på rent brukerutstyr, men foreløpig finnes ingen vaksine. En Cochrane-metaanalyse konkluderte med at LAR reduserer smitterisikoen med 50% og at denne effekten øker til 74% ved samtidig bruk av rent injeksjonsutstyr (13). Dekningen av skadereduksjon er imidlertid for lav, og for å oppnå reduksjoner i HCV-prevalens av betydning vil det i tillegg være nødvendig med kraftig oppskalert HCV-behandling blant personer som kan smitte andre (behandling som forebygging) (14). Matematisk modellering har vist at eliminasjon av HCV-infeksjon gjennom en kombinasjon av behandling og skadereduksjon er realistisk i mange land, inkludert Norge (15).
DAA-behandling har vist seg å være like effektiv hos rusavhengige som hos øvrige pasientgrupper. En fersk metaanalyse av 38 studier konkluderte med svært gunstige resultater både hos LAR-pasienter og aktive rusmiddelbrukere så lenge behandlingen fullføres (16). Mye tyder på at vellykket behandling slett ikke krever 100% etterlevelse, men en hovedutfordring ved behandling av rusavhengige er å beholde kontakt med pasienten underveis.
Siden HCV-smitte ikke gir beskyttende immunitet, vil personer som fortsetter å injisere rusmidler ha omlag 4–6% årlig risiko for reinfeksjon etter vellykket behandling (17). Nøkkelen til å dempe omfanget av dette problemet består i rask oppskalering av behandling på populasjonsnivå i kombinasjon med forebyggende tiltak på individnivå (LAR og tilgang på rent brukerutstyr) og effektiv behandling av eventuelle reinfeksjoner. Når prevalensen av HCV blant sprøytebrukere reduseres, vil også risikoen for reinfeksjon synke. Pasienter med pågående risikoatferd bør derfor følges med halvårige kontroller av HCV RNA etter vellykket behandling og raskt tilbys ny behandling dersom det påvises reinfeksjon.
Nye behandlingsmodeller
Da DAA-behandling kom på det norske markedet i 2014 var prisene svært høye og helseforetakene innførte derfor restriksjoner med krav om en viss grad av leverfibrose før behandling kunne startes. Helseforetakenes anbudsordning har heldigvis fasilitert priskonkurranse med betydelige prisfall, og siden februar 2018 har alle HCV-pasienter i Norge hatt tilbud om behandling uten restriksjoner. Figur 1 viser sammenhengen mellom antall årlige DAA-behandlinger i Norge og prisen på rimeligste behandlingsregime upubliserte data. Fra å koste omtrent en Tesla i 2014 er nå kostanden for en kur redusert til en el-sykkel. Parallelt har antall behandlinger økt kraftig, og i 2018 ble det behandlet mer enn 3000 pasienter i Norge.
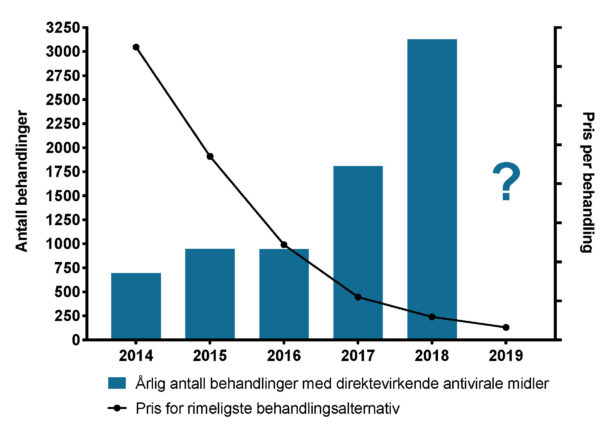
Figur 1. Søylene viser årlig antall behandlinger med direktevirkende antivirale midler 2014-2018 (venstre y-akse) og linjen viser prisen for rimeligste behandlingsalternativ (høyre y-akse). De eksakte prisene er utelatt da dette er konfidensielt utenfor helseforetaket. Figuren er basert på data fra Sykehusinnkjøp HF.
Aktive rusmiddelbrukere er imidlertid grovt underrepresentert i denne statistikken og utgjør sannsynligvis kun 5% av de behandlede (upubliserte data). Dette illustrerer en av utfordringene med den tradisjonelle modellen for diagnostikk og behandling av HCV-infeksjon i spesialisthelsetjenesten. Mange pasienter møter ikke til konsultasjon etter henvisning og har problemer med å gjennomføre spesialisthelsetjenestens tilbud. I tillegg må resept på DAA-behandling forskrives på H-resept av lege ansatt i helseforetaket, i praksis spesialist i infeksjonsmedisin eller gastroenterologi.
Dette har ført til at helsetjenesten i liten grad har nådd den mest sårbare pasientgruppen med aktivt rusmiddelbruk og psykososiale utfordringer. Dagens enkle DAA-behandling gjør det imidlertid mulig å tilpasse tjenestene til brukernes behov ved å flytte oppgavene fra spesialisthelsetjenesten til primærhelsetjenesten gjennom oppgaveglidning fra sykehusspesialister til pasientnære behandlere som allmennleger, sykepleiere i rusomsorgen og behandlere i psykisk helsevern. H-resept kan i de fleste tilfeller forskrives etter en kort telefonkonsultasjon forutsatt at et minimum av utredning er gjennomført.
Det er godt dokumentert at behandlingen med fordel kan integreres i rusomsorgens arenaer, slik at pasientene kan behandles der de er uten å måtte henvises til spesialist (18). HCV-behandling i LAR, lavterskel-klinikker, tverrfaglige rusbehandlingsinstitusjoner (TSB) og fengsler er eksempler på modeller som nå utforskes i Norge (Figur 2). I Oslo har vi sett gode resultater av HCV-behandling i en lavterskel-klinikk i velferdsetatens lokaler i sentrum (19). I Bergen pågår et prosjekt med integrert behandling i LAR-poliklinikker.
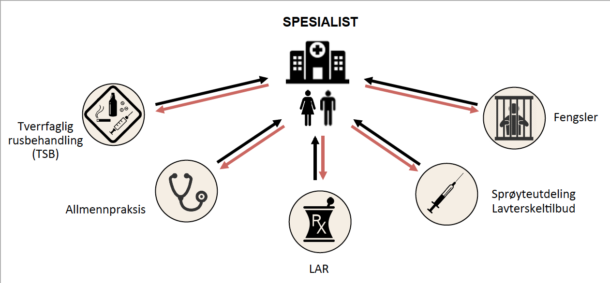
Figur 2. Eksempler på nye modeller for hepatitt C-behandling for rusavhengige pasienter i Norge. Illustrasjonen er modifisert og gjengitt med tillatelse fra professor Jason Grebely, Kirby Institute, Australia.
Globale perspektiver
Globalt utgjør HCV-infeksjon et stort folkehelseproblem. I 2013 var virale hepatitter den 7. ledende dødsårsaken i verden og antall årlige dødsfall har nå oversteget tuberkulose, malaria og HIV-infeksjon (2). I mange av landene hvor sykdomsbyrden av HCV er størst er det også størst usikkerhet rundt epidemiologiske data.
Det er antatt at Egypt er det landet i verden med høyest sykdomsbyrde med en prevalens på 10-15% i den generelle befolkningen. Dette skyldes massiv iatrogen smitte som resultat av at egyptiske myndigheter mellom 1950 og 1980 gjennomførte en nasjonal kampanje med intravenøs behandling mot schistosomiasis. Egypt var tidlig ute med å identifisere HCV-infeksjon som et folkehelseproblem. Gjennom tidlige, betydelige prisreduksjoner fra legemiddelindustrien og tilgang på generisk produserte legemidler er Egypt nå på vei mot å realisere WHOs insidensmål (20).
Som et resultat av den massive bekjempelsen av HCV-infeksjon i Egypt er det ventet at Pakistan snart blir det landet i verden med høyest prevalens. I likhet med Egypt forklares epidemien i stor grad av iatrogen smitte og i visse subgrupper er prevalensen av anti-HCV hele 70% (21). Det anslås at Pakistan må behandle 880 000 personer per år for å nå WHOs målsetning dersom ikke betydelige smitteforebyggende tiltak blir iverksatt i tillegg (22).
Til tross for av at omlag 100 land har kommet med nasjonale planer for eliminasjon av HCV har få fulgt opp dette med økonomiske forpliktelser. Per nå er kun 12 land på vei til å nå WHOs insidensmål (23). Med sine 330 000 innbyggere og litt over 1000 HCV-pasienter forventes Island å bli det det første landet i verden til å nå målet (24), men Norge burde være en god kandidat for andreplassen.
Oppsummering
HCV-infeksjon er blitt en sykdom som enkelt kan kureres i pasientnære fasiliteter. Hovedutfordringen i arbeidet med å nå det norske målet om eliminasjon innen 2023 blir å identifisere pasientene og knytte dem til behandlingstjenester pasienten kan nyttiggjøre seg av, parallelt med god smitteforebygging gjennom skadereduserende tiltak og intensivert behandling hos aktive sprøytebrukere. Dette vil kreve ekstra innsats i alle ledd av helsetjenesten og effektiv samhandling mellom primær- og spesialisthelsetjeneste.
Referanser