Etter en nyretransplantasjon er pasientene i dag avhengige av daglig livslang immunsuppresiv behandling. Økt forståelse av immunsystemet og bruk av immundempenede legemidler har gitt betydelig færre rejeksjonsepisoder. Vi omtaler rasjonale bak den immunosuppresive kombinasjonsbehandlingen som brukes i dag og gir noen tanker rundt fremtidige behandlingsalternativer.
Dagens immunosuppresive behandling har redusert antall rejeksjonsepisoder etter nyretransplantasjon til <10%, og 1-års graft- og pasientoverlevelse er nå >96%. Etter organtransplantasjon er det viktig å finne den kombinasjonen av medikamenter som gir pasienten adekvat immunsuppresjon, slik at resipienten unngår avstøtning og samtidig opplever minst mulig bivirkninger. Det kan være utfordrende da disse legemidlene induserer en rekke alvorlige bivirkninger allerede i terapeutiske doser. Det er utarbeidet behandlingsprotokoller (basert på kliniske studier) som gir grunnlag for valg av immunosuppresive legemiddelkombinasjoner og doseringsnivå i den initiale fasen. Terapeutisk legemiddelmonitorering (TDM) er nødvendig for dosering av noen av legemidlene. I langtidsoppfølgingen tilstreber man en individualisering av behandlingen. Man har beveget seg bort fra «one-size fits all»-doseringer til såkalte «tailored» (skreddersydde) behandlingsalternativer. Målsetningen er å tilpasse den immunosuppresive behandlingen i en kombinasjon og på et lavest mulig nivå, og slik redusere risikoen for infeksjoner, kardiovaskulære hendelser, utvikling av malignitet og post-transplantasjon diabetes, uten avstøtning eller medikamentelt induserte bivirkninger. Over- eller underdoserer man de immundempende legemidlene, kan dette få fatale konsekvenser for resipienten. Denne balansegangen krever godt samarbeid med resipienten og bred erfaring med monitorering av de immundempende legemidlenes blodkonsentrasjoner og bivirkningsmønster.
I Norge lever i dag ca. 3800 pasienter med et fungerende nyretransplantat. Type immundempende behandling resipienten bruker avhenger i stor grad av når – i hvilken tids-æra – pasienten ble transplantert. Den første organtransplantasjonen i Norge var en nyretransplantasjon utført i 1956 på Rikshospitalet. Immunsuppresjonen bestod av helkropps radioaktiv bestråling og steroider. Nyren fungerte i 4 uker, og pasienten døde under en reoperasjon. Den første vellykkede transplantasjonen i Norge ble utført på Ullevål Sykehus i 1963. Graftet varte i 22 år, under immunsuppresjon med azatioprin og prednisolon. Kombinasjonen azatioprin/prednisolon var standardbehandling og eneste alternativ frem til 1983, da soppen fra Hardangervidda – ciklosporin A (Sandimmun®) – ble tatt i klinisk bruk. I 1993 ble FK506, takrolimus (Prograf®), tatt i bruk, og i 1999 kom mykofenolat mofetil (CellCept®) til Norge. I 2001 ble mammalian target of rapamycin (mTOR) inhibitorene (Sirolimus; Rapamycin®/everolimus; Certican®) og 2011 belatacept (Nulojix®) godkjent. Stadig kommer flere generika som skal være bioekvivalente, men dette er ikke alltid tilfelle, og siden «grensen» mellom over- og under-immunsuppresjon er så smal og utfallet av spesielt underimmunsuppresjon er så fatalt, har dette medført en restriktiv holdning til bruken av disse i Norge [1].
Det utføres nå årlig 250-300 nyretransplantasjoner ved Rikshospitalet, og graftoverlevelsen blir stadig bedre (Se fig.). Dette til tross for at man transplanterer flere såkalte immunologisk høyrisikopasienter (med kjente donor spesifikke antistoffer (DSA) og ABO-uforlikelige pasienter). I tillegg blir resipientene eldre, og det brukes organer fra stadig flere eldre avdøde givere (såkalte Expanded Criteria Donors; ECD). Noe av årsaken til at graft- og pasientoverlevelse allikevel forbedres er økt kunnskap og forståelse av hvordan den immunosuppresive behandlingen påvirker immunsystemet samt bedret immunosuppresiv monitorering.
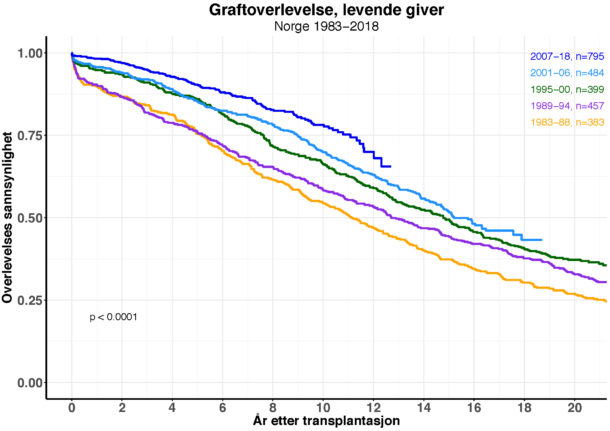
Figur 1. Kaplan-Meier analyse av graftoverlevelse etter første nyretransplantasjon hos norske resipienter av nyre fra levende giver i ulike tidsperioder fra 1983 til 2018. Totalt 2.518 pasienter i perioden. Sensureringsdato 23.09.2019.
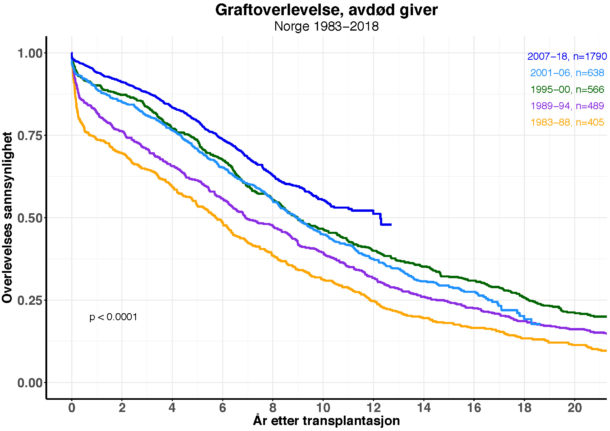
Figur 2. Kaplan-Meier analyse av graftoverlevelse etter første nyretransplantasjon hos norske resipienter av nyre fra avdød giver i ulike tidsperioder fra 1983 til 2018. Totalt 3.888 pasienter i perioden. Sensureringsdato 23.09.2019.
I forbindelse med selve transplantasjonen får alle pasientene induksjonsbehandling med metylprednisolon i.v. samt et spesifikt T- eller B-celle hemmende legemiddel avhengig av pasientens immunologiske risikoprofil. Ved standard immunologisk risiko uten donorspesifikke HLA antistoffer eller blodtype uforlik, gis i.v. basiliximab (Simulect®). Basiliximab påvirker T- celleproliferasjon (et viktig steg i den cellulære immunresponsen involvert i organrejeksjon) ved å blokkere interleukin-2 (IL-2) reseptoren. Effekten vedvarer 20-35 dager. Ved immunologisk intermediær risiko (dvs. påvisninga av antistoffer mot HLA, men ikke donorspesifikke antistoffer) benyttes i.v. anti-thymocytt globulin (ATG, Thymoglobuline®) som induksjon. ATG virker hovedsakelig ved komplementavhengig lyse (CDC) av en rekke sirkulerende T-celler. [2]. Den immunologiske effekten vedvarer i måneder. Hos pasienter med kjent DSA eller ved høye antistofftiter gis kombinasjonen av rituximab (MabThera®), basiliximab og humant immunglobulin som induksjon. Rituximab medierer B-celle lysering. Effekten kan vedvare i år. Transplantasjon med blodtype uforlik har også økt immunologisk risiko og egen protokoll. Det er viktig å ha kunnskap om induksjonsbehandlingen da medikamentene påvirker pasientens immunsystem i måneder og år etter selve transplantasjonen.
Etter en organtransplantasjon trenger pasienten livslang peroral immunosuppresiv behandling for å motvirke organavstøtning. Målet er hele tiden å finne den optimale kombinasjon med få/ingen bivirkninger som gir lang pasient- og graftoverlevelse. Individuell doseringen er en utfordrende balansegang mellom for lite (fare for rejeksjon) og for mye immundemping (bivirkninger/infeksjon/malignitet). Doseringen av de fleste immunosuppresive medikamenter justeres ved TDM.
Standardbehandling på transplantasjonstidspunktet er i dag en kombinasjon av prednisolon, takrolimus og mykofenolat. Denne behandlingen velges uavhengig av immunologisk risikoprofil, men «terapeutisk vindu» justeres opp ved økt risiko.
Prednisolon
Prednisolon startes på transplantasjonstidspunktet og trappes ned til 5 mg (anbefalt vedlikeholdsbehandling). Bivirkningene er velkjente. Vi mener at risikoen ved bruk av 5 mg daglig er marginal og effekten oppveier bivirkningene.
Ved nyretransplantasjon betraktes kalsineurinhemmere (CNI) som det viktigste immunosuppresive medikamentet. Dette er T-celle spesifikke medikamenter som hindrer celleaktivering. CNI undertrykker ikke hematopoesen og har ingen effekt på fagocytterende cellers funksjon.
En stor utfordring med CNI etter nyretransplantasjon er nyretoksisitet. Årsaken er fortsatt omdiskutert, men involverer både en akutt, og sannsynligvis reversibel hemodynamisk effekt, og en (etter hvert) irreversibel fibrosedannelse. I tillegg gir disse legemidlene ofte hypertensjon, hyperlipedimi, økt kreftfare og post-transplantasjons diabetes mellitus (PTDM).
Mykofenolat er tilgjengelig som en inaktivt prodrug, mykofenolatmofetil (CellCept®) og som enterodrasjert mykofenolatnatrium (Myfortic®). Mykofenolat påvirker celler som er i rask deling (stort behov for puriner) og spesifikt T-og B- lymfocytter som er avhengig av de novo purin syntese.
Utfordringene med bruk av mykofenolat er knyttet til effekten på spesielt hurtigdelende celler i benmarg (benmargshemming) og på GI-traktus (diare). Ca. 15-20 % av pasienten utvikler diare – uten at det er noen prinsipiell forskjell på de to medikamentene (CellCept®, Myfortic®). Årsak til diaréen kan være utfordrende å diagnostisere riktig og behandle [3]. Ofte leder det til dosejusteringer, som igjen øker faren for avstøtning/grafttap.
mTOR inhibitorene/proliferasjonshemmerne er ikke nyretoksiske og ble primært utviklet som et alternativ for å erstatte de nyretoksiske CNI:ene. Sirolimus (Rapamune®) og everolimus (Certican®) har felles virkningsmekanisme og gir nedsatt celleproliferasjon og hemmet aktivering av T- og B-celler.
mTOR-inhibitorene er noe mindre potente enn CNI. Brukt fra transplantasjonstidspunktet (i kombinasjon med mykofenolat) medfører dette noe høyere rejeksjonsinsidens. I tillegg virker de hemmende på sårtilhelningen, og man har derfor vært tilbakeholdne med å bruke disse medikamentene ved transplantasjonstidspunktet. Andre utfordringer er bl.a. en betydelig hyperlipidemi, kjemisk pneumonitt, aftøs stomatitt som oftest er behandlingsrefraktær, akne samt proteinuri/ødemtendens [4]. Ca. 30 % av pasientene får bivirkninger i så alvorlig grad at de må slutte med medikamentet.
Belatacept (Nulojix®) ble også utviklet for å erstatte CNI og gi en mindre nyretoksisk behandling. Medikamentet gis i.v. 1 gang/mnd og doseres etter kroppsvekt. Belatacept hindrer T-celle immunaktivering. Studier har vist gode langtidsresultater med mindre bivirkninger enn dagens CNI-baserte regime. Utfordringene har vært at ca. 20% av pasienter utviklet rejeksjon i den tidlige fasen – også alvorlige – vs. 7% i ciklosporin-armen. De som fortsatte behandling med belatacept hadde imidlertid signifikant bedre GFR ved 6 mnd som holdt seg (og faktisk bedret seg) ved 7 års oppfølging [5]. Resultatene må tolkes med stor forsiktighet, og det har vært kritikk av studiedesignet. Så langt er det heller ikke utført gode sammenlignende studier med dagens primære hovedbehandling; lavdose takrolimus/mykofenolat/prednisolon vs. belatcept. I tillegg ble det i de opprinnelige studiene heller ikke inkludert immunologisk intermediær-/høyrisiko pasienter. For å redusere faren for utvikling av post-transplantasjons lymfom (PTLD) må pasienter som skal behandles med belatacept være EBV IgG positive. [6, 7]. Grunnet begrenset tilgang (produksjonsutfordringer) gjennom mange år samt at medikamentet må gis i.v. på sykehus og belastes sykehusbudsjettet (ca. 65.000 NOK/år/pasient) har belatacept så langt ikke fått noen stor utbredelse i Norge.
I tillegg til overnevnte medikamenter brukes fortsatt azatioprin (Imurel®) av de fleste pasienter transplantert før 1999, da oftest i kombinasjon med ciklosporin. For pasienter med inflammatorisk tarmsykdom (Crohns sykdom/ulcerøs kolitt) og for pasienter som får GI bivirkninger av mykofenolat er fortsatt azatioprin et alternativ. Transplanterte kvinner som ønsker å bli gravide bytter mykofenolat til azatioprin, da mykofenolat gir høy risiko for misdannelser hos barnet. Azatioprin blir da brukt i kombinasjon med tacrolimus eller ciklosporin.
De fleste pasienter blir oftest værende på det medikamentelle regiment de startet med på transplantasjonstidspunktet som i dag vil si prednisolon, takrolimus og mykofenolat. Dette fordi bivirkningene oftest er lite dominerende/«er til å leve med». Etter en vellykket transplantasjon foretrekkes trygghet fremfor risiko for nye bivirkninger og rejeksjon, som skifte av immunsuppresjon kan medføre. Man følger en protokoll som gir en noe kraftigere immunsuppresjon i tiden umiddelbart etter transplantasjon når risikoen for avstøtning er størst, og deretter nedtrapping til lavere nivåer utover i forløpet. Men vi har ikke noen god biomarkør for å bestemme om pasientene er tilstrekkelig immunsupprimert og for å være på den «sikre siden» vil vedlikeholdsnivået nødvendigvis være litt høyere enn nødvendig hos de fleste pasienter. Oppstår det komplikasjoner eller alvorlige bivirkninger vil man vurdere endring av regime. Et eksempel er at hvis pasienten bruker mTOR hemmere (da i kombinasjon med mykofenolat) tidlig etter transplantasjonen er risikoen for visse type virusinfeksjoner sannsynligvis redusert. BK-virus infiserer urotel og kan bli aktivert ved immunsuppresjon etter transplantasjon. BK-virus assosiert nefritt kan lede til tap av graft funksjon [8, 9]. Det finnes per i dag ingen effektiv antiviral behandling mot BK-viruset, så behandlingen er reduksjon av den totale immunosuppresive byrden med økt fare for rejeksjon. Nytten av å bytte til et mTOR basert regime ved pågående virusinfeksjon er ikke dokumentert, men pga. manglende behandlingsalternativer blir dette ofte prøvd. Et annet eksempel er å utnytte den antiproliferative effekten til mTOR hemmere da den har vist seg å ha noe effekt på visse krefttyper. Derfor vurderes alltid bytte til mTOR hemmere hvis pasienten har hatt kreft tidligere i livet (før transplantasjon) eller hvis pasienten utvikler kreft etter transplantasjonen. Effekten av dette er også omdiskutert og også her vil faren for avstøtning alltid være tilstede.
De siste 10-15 årene har det vært utført flere store fase 2 mulitisenter studier på nyretransplanterte med forskjellige immunosuppresive medikamenter uten at noen av medikamentene har blitt godkjent. Oftest har slike studier non-inferior design og komparatorarmen er alltid CNI-basert. Manglende godkjenning skyldes uventede bivirkninger eller økt rejeksjonsinsidens/manglende bedring i GFR.
Pasienter med nyresvikt har økt risiko for hjerte-kar sykdom. For å bedre langtidsoverlevelse etter nyretransplantasjon har det vært økt fokus på behandling av kjente risikofaktorer som hypertensjon, hyperlipidemi og post transplantasjon diabetes mellitus. Det har også vært særlig fokus på å redusere CNI doser på grunn av CNI nefrotoksisitet og ugunstig kardiovaskulær profil. Dagens «terapeutiske vinduer» for CNI er betydelig lavere nå enn for 10-15 år siden [10, 11]. Det er imidlertid relativ dårlig korrelasjon mellom trough/C0 (måling av blodkonsentrasjon medikamentfastende på morgenen), som brukes ved dagens TDM, og total eksponering (area under the curve –AUC) samt stor interindividuell variabilitet. Studier har vist at 12-timers AUC-målinger kan bedre resultatene ytterligere. Måling av 12-timers farmakokinetikk i en klinisk hverdag er imidlertid tidkrevende, kostbart og ikke praktisk gjennomførbart. Ved Rikshospitalet har vi derfor sett på mulighetene for «hjemmetakning» av blodprøve for måling av takrolimus konsentrasjon. Ved bruk av såkalt Volumetric Absoptive Microsampling (VAMS®) teknologi har vi gjennomført prosjekter der pasientene tar takrolimus prøven hjemme på lignende måte som ved å ta blodsukker [12]. (https://ekspertsykehusetblog.wordpress.com/2018/12/12/nyretransplanterte-sparer-tid-ved-a-ta-blodprover-hjemme/)
Vi har også utviklet en databasert takrolimus modell der man kun trenger 3 konsentrasjonsmålinger for å kunne predikere takrolimus AUC [13, 14]. Ved å bruke hjemmebasert blodprøvetaking, en databasert takrolimus model og en App vi har utviklet, TusenTac®, vil det være praktisk gjennomførbart å bruke mini-AUC i en klinisk hverdag.
Videreutvikling av kostimulasjonsblokkerende medikamenter har vært i fokus fordi man initialt trodde dette kunne indusere toleranse. Hvis kroppens immunsystem istedenfor å «angripe» det nye organet tolererte det, ville man kunnet unngå å bruke immunsuppresjon i langtidsforløpet og dermed redusert bivirkninger og langtidskomplikasjoner. Per i dag har dette kun vært mulig ved å samtidige utføre en benmargstransplantasjon fra samme donor. Utfordringene har da bl.a. vært toksisk effekt av prekondisjoneringen før benmargstransplantasjon og utvikling av graft-versus-host disease [15].
For tiden er det store forventninger til et nytt kostimulasjons blokkerende immundempende legemiddel – CFZ533 (iscalimab). Det gir angivelig en mer «spesifikk» kostimulasjons blokkerende effekt enn belatacept. Håpet er at pasientene kan greie seg med dette medikamentet alene (uten mykofenolat/prednisolon) og medikamentet settes s.c. av pasienten selv. Det foregår en stor multisenterstudie (CIRRUS1) som skal inkludere 350 pasienter som skal følges i 1 år. Preliminære resultater forventes først i 2021-2022.
Alle organtransplanterte pasienter har immunhemmende behandling som medfører økt infeksjonsrisiko og økt risiko for kreft. Nyretransplanterte pasienter har høy kardiovaskulær risiko og oftest redusert nyrefunksjon.
Når en nyretransplantert pasient blir innlagt på sykehus, må en tenke på immunnosuppresive medikamenter så fort pasienten er stabilisert og akutt behandling er iverksatt. Unngå å hoppe over doser og om nødvendig må pasienten få medisiner på sonde eller i.v. Ved spørsmål om dosering konferer med nefrolog eller kontakt Avdeling for transplantasjonsmedisin, OUS. RH. Mål medikament konsentrasjoner som null-verdier (Tabell 1). Doser andre medikamenter ut fra estimert GFR og husk å undersøke om det er interaksjoner, særlig med ciklosporin og takrolimus. Om mulig unngå nefrotoksiske medikamenter.
Det er ingen nyrer å miste – ta kontakt og spør dersom du er usikker.

Medikamentene brukes i forskjellige kombinasjoner
*; tilgjengelig therapeutic drug monitoring (TDM). #; tilgjengelig i.v.
Referanser