Nyrearteriestenose er en viktig årsak til hypertensjon og tap av nyrefunksjon hos pasienter med aterosklerotisk sykdom. Store studier har vist at de fleste kan behandles medikamentelt, men det er fortsatt viktig å vurdere enkelte pasienter for blokking og stenting. Denne artikkelen gjennomgår diagnostisk utredning og seleksjon av pasienter til invasiv utredning og behandling.
For å ivareta oppgavene med glomerulær filtrasjon og tubulær reabsorbsjon, er nyrene svært godt perfundert. I kortere perioder kan nyrene klare seg med så lite som 1/10 av den ordinære blodgjennomstrømningen, men om dette vedvarer, iverksettes kompensasjonsmekanismer som fører til hypertensjon, fibrose og tap av nyrefunksjon.
Hovedårsaken til nyrearteriestenose er aterosklerotisk sykdom og forekommer vanligvis sent i livet, gjerne hos pasienter med avansert kardiovaskulær sykdom. Komorbiditet er en vesentlig årsak til den alvorlige prognosen ved denne tilstanden.
Nyrearteriestenose på bakgrunn av fibromuskulær dysplasi er sjeldnere og kan være årsak til hypertensjon hos noe yngre pasienter, ofte uten komorbiditet. Tilstanden er vanligst hos kvinner. Både genetiske og miljømessige faktorer antas å være årsak til sykdommen, men patogenesen er dårlig kartlagt (1).
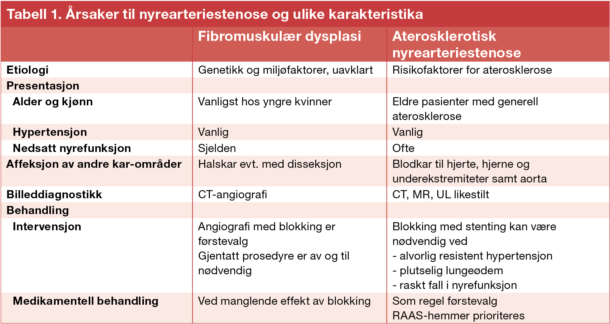
Tabell 1. Årsaker til nyrearteriestenose og ulike karakteristika
Nyrearteriestenose er blant de hyppigste årsakene til sekundær hypertensjon. Aterosklerotisk innsnevring av nyrearterier opptrer hos eldre pasienter, vanligvis over 50 år, og er assosiert med generalisert aterosklerose. Insidensen er økende, noe som sannsynligvis reflekterer både økende levealder og bedre behandling av andre aterosklerotiske komplikasjoner som hjerteinfarkt og hjerneslag. Aterosklerotisk nyresykdom er påvist hos 11 til 42 % av pasienter som gjennomgår koronar- eller underekstremitetsangiografi. Symptomatisk forekomst av fibromuskulær dysplasi i nyrearteriene er sjeldnere og anslått til 4/1000.
Aterosklerotisk sykdom i nyrearteriene har de samme risikofaktorene som aterosklerotisk sykdom ellers i kroppen, men har ofte en sen manifestasjon. Risikofaktorene er arv, mannlig kjønn, høy alder, røyking, hypertensjon, diabetes og hyperkolesterolemi. Aterosklerotiske stenoser er vanligvis lokalisert proksimalt i nyrearterien, gjerne ostealt og lesjonene har ofte både aterosklerotiske plakk og kalknedslag.
Den molekylære etiologien bak fibromuskulær dysplasi er ukjent. Ulike gener er foreslått, men ingen spesifikk mutasjon eller mekanisme er avdekket. 90 % av pasientene er kvinner. Miljøfaktorer som røyking er også assosiert med tilstanden. Fibromuskulær dysplasi kan i prinsippet affisere alle tre lag i blodåreveggen med fibrose, bortfall av elastisk vev og glatt muskel hyperplasi. Dette kan medføre stenoser, aneurismer og disseksjoner. Fibromuskulær dysplasi forekommer oftest i nyrearterier, dernest i precerebrale kar. Prinsipielt kan alle blodkar affiseres. Typisk lokalisasjon i nyrearteriene er i midtre og distale deler inkludert de første forgreningene, ofte bilateralt (Figur 1).
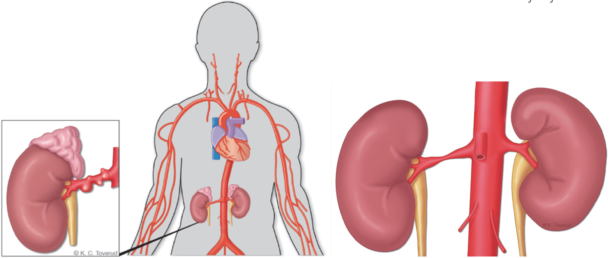
Figur 1: Fibromuskulær dysplasi (til venstre) kan i prinsippet affisere alle blodkar, men nyrearterier og halskar er predileksjonssteder. Aterosklerotisk nyrearteriestenose (til høyre) er ledd i generell aterosklerotisk sykdom og sitter ofte proksimalt i nyrearterien, til og med osteal.
Det er vesentlige forskjeller mellom stenose i en av to nyrearterier, og stenose i begge nyrearterier eller stenose i arterie til singel nyre. Bakgrunnen for denne kunnskapen er Goldblatts eksperimenter fra tidlig 1900-tall (2). Nedsatt sirkulasjon til nyrevevet fører til aktivering av renin-angiotensin-aldosteron-systemet (RAAS). Tubulær påvirkning av angiotensin II og aldosteron gir økt reabsorbsjon av natrium og vann, mens angiotensin II i tillegg gir arteriolær vasokonstriksjon. Begge hever blodtrykket. Dersom stenosen er ensidig, vil den andre nyren utsettes for høyt blodtrykk, som igjen medfører trykknatriurese og normalisering av volumstatus. Da er det hovedsakelig den perifere arteriolære effekten av angiotensin II som opprettholder det høye blodtrykket. Dersom stenosen er bilateral, eller til en singel nyre, blir det ingen trykknatriurese. Når det ekstracellulære volumet og systemisk blodtrykk stiger høyt nok, blir blodtrykket bak stenosen høyere og aktiveringen av RAAS opphører. Da har man en hovedsakelig volumdrevet hypertensjon.
En nyrearteriestenose utvikler seg imidlertid ikke plutselig slik som i Goldblatts forsøk, men gradvis over måneder og år. Kronisk iskemi påfører nyren irreversibel skade med fibrose. Etter lengre tids iskemi vil ikke revaskularisering kunne berge nyrefunksjonen, selv om nyrefunksjonen forbigående kan bedres. Over tid vil også renin-nivåene falle, selv ved ensidig nyrearteriestenose og ved uendret eller økende stenosegrad. Det samme gjør responsen på medikamentell RAAS-hemming, som er en viktig del av behandlingen. Aktivering av det sympatiske nervesystemet er en av mekanismene som tar over og opprettholder det høye systemiske blodtrykket som kreves for perfusjon av den iskemiske nyren.
Studier av det naturlige forløpet av nyrearteriestenose ble muliggjort av bedre ultralydteknikk på 90-tallet. Før det hadde man bare kunnskap basert på retrospektive angiografistudier av svært selekterte pasientgrupper (3). Ultralydstudiene viste en progresjon hos rundt 30% over en 3-årsperiode, avhengig av stenosegraden i utgangspunktet. (4, 5). Studier har ikke klart å påvise signifikante endringer i nyrefunksjon, blodtrykk eller andre risikofaktorer som kan skille de som progredierer fra de som ikke gjør det. Det er vanligvis minimale forandringer i serum kreatinin, og progresjon kan ofte forekomme uten store forandringer i blodtrykk.
Prognosen for pasienter med aterosklerotisk nyrearteriestenose er alvorlig, først og fremst på grunn av generalisert aterosklerose med hjerteinfarkt og hjerneslag som dødsårsaker. Retrospektive studier viser 3- og 5-års overlevelse på 30 og 35 %.
Det naturlige forløpet av fibromuskulær dysplasi varierer, men progresjon forekommer, både med økende stenose og involvering av flere kar-segmenter. I de fleste tilfellene avtar utviklingen med økende alder. Fibromuskulær dysplasi er sjelden årsak til iskemisk nyresykdom, men ubehandlet hypertensjon kan føre til hypertensive forandringer med atrofi av nyrebarken.
Den klassiske presentasjonen av nyrearteriestenose er behandlingsresistent hypertensjon. En del pasienter har sannsynligvis god effekt av antihypertensiv behandling, slik at billedundersøkelser ikke blir gjort, og diagnosen ikke stilt. Pasienter med aterosklerotisk renovaskulær hypertensjon har ofte flere kardiovaskulære risikofaktorer og mer alvorlige endeorganskade enn pasienter med essensiell hypertensjon. De har oftere venstre ventrikkelhypertrofi og mangler nattlig blodtrykksfall på 24-timers BT-måling. Kliniske og anamnestiske funn med lavere sensitivitet er stenoselyd i abdomen, hypokalemi og fravær av hypertensjon i familieanamnesen. Urinfunn er ofte beskjedne. Fallende GFR uten proteinuri kan tale i retning av renovaskulær sykdom.
Ved bilateral nyrearteriestenose, eller ved stenose til singel nyre, kan pasienten presenteres med relativt raskt fallende nyrefunksjon. Dette er sjelden ved fibromuskulær dysplasi. Funn av asymmetrisk nyrestørrelse gir sterk mistanke om nyrearteriestenose. Den atrofiske nyren har da gått tapt i en tidligere nyrearteriestenose. Nyrefunksjonen kan være bevart ved hyperfiltrasjon i gjenværende nyre. Fallende nyrefunksjon må da gi mistanke om nyrearteriestenose til den tidligere uaffiserte nyren. Hos pasienter over 50 år har opptil 70 % nyrearteriestenose ved påvisning av tydelig asymmetri (6).
Ved nedsatt nyrefunksjon kan det være vanskelig å skille primær renovaskulær sykdom fra nyresykdom av andre årsaker, spesielt hypertensivt betinget nefrosklerose. Bilateral nyrearteriestenose uten sikker klinisk betydning er tilstede hos mellom 30 og 50 % av pasienter med generell nefrosklerose, ensidig nyrearteriestenose er enda vanligere.
Av og til oppdages nyrearteriestenose ved at pasientene får akutt nyreskade i forbindelse med oppstart av blodtrykksmedisiner. Dette skjer særlig ved oppstart med RAAS-hemmer. Akutt nyresvikt er i denne situasjonen ofte reversibel.
En sjeldnere variant av nyresvikt er plutselig anurisk nyresvikt. Da må man mistenke nyrearterieokklusjon av arterie til singel nyre. Nyrevevet kan holdes viabelt ved marginal sirkulasjon i uker til måneder videre. Kommer man raskt til intervensjon, kan nyrefunksjonen gjenvinnes. I motsatt fall er det behov for kronisk nyreerstattende behandling.
Pasienter som innlegges med plutselig kardialt lungeødem, der utredning ikke avdekker vesentlig hjertesykdom, må vurderes med tanke på nyrearteriestenose. Denne presentasjonen oppstår vanligvis ved bilateral nyrearteriestenose, og det antas at volumbelastningen er årsak til lungeødemet.
Dersom sykehistorien, klinisk undersøkelse eller laboratorieprøver gir mistanke om nyrearteriestenose, gjøres bildediagnostikk i de tilfellene der man mener intervensjon er indisert. Mer om indikasjonsstilling i avsnittet under. Renal angiografi er gullstandard, men utføres vanligvis som terapeutisk prosedyre. Stenosegrad over 75 % vurderes som signifikante. Om stenosegraden er usikker, benyttes trykkmåling over stenosen som et funksjonelt mål. Trykkfall på 20 % regnes som signifikant og er et mer pålitelig mål enn visuell fremstilling av stenosen.
Valg av modalitet kommer først og fremst an på hvilken modalitet radiologene lokalt har erfaring med. Ikke-invasiv bildediagnostikk har noe lavere sensitivitet for fibromuskulær dysplasi, da disse lesjonene oftere affiserer mer distale deler av nyrearteriene. Moderne CT-angiografi har tilnærmet like god sensitivitet og spesifisitet som konvensjonell angiografi, og bør foretrekkes hvis fibromuskulær dysplasi mistenkes. (Figur 2 og 3)
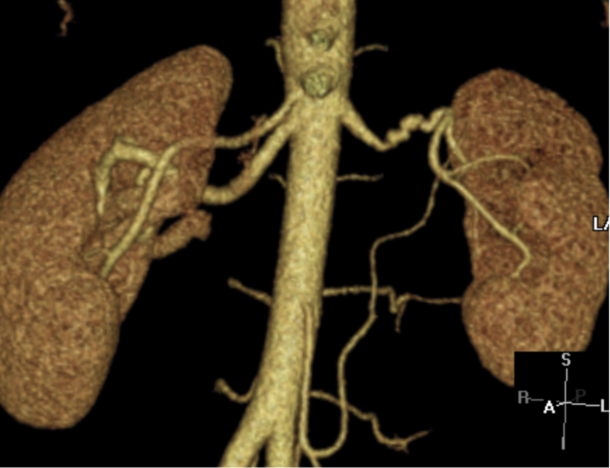
Figur 2: Rekonstruksjon fra CT-angiografi av fibromuskulær dysplasi. Typisk presentasjon med kaliberveksling i midtre og distale deler av nyrearterien. Klinikk for bildediagnostikk, St. Olavs hospital
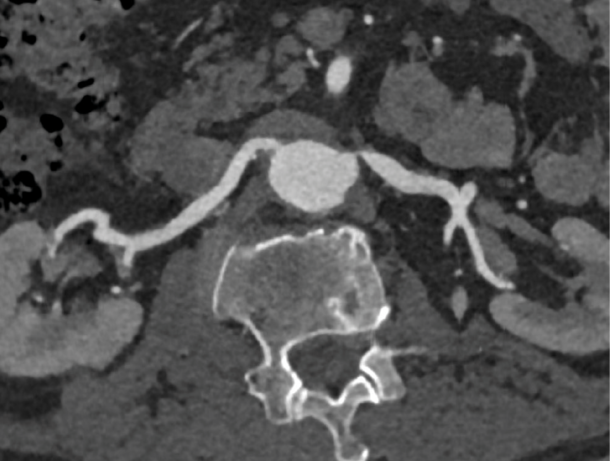
Figur 3: CT med kontrast i arteriell fase viser godt den proksimalt beliggende stenosen til venstre nyrearterie. Klinikk for bildediagnostikk, St. Olavs hospital
MR angiografi med kontrast gir utmerket fremstilling av proksimale nyrearterier. MR gir i tillegg funksjonell fremstilling av nyrevevet.
Ultralyd doppler gir god funksjonell fremstilling av nyrearterien og stenosen. Maksimal systolisk hastighet over stenosen har størst diagnostisk verdi. Den anatomiske fremstillingen kan være noe dårligere enn for MR og CT. Undersøkelsen er tidkrevende for radiolog, og resultatet avhenger både av pasientens habitus og erfaringen hos radiologen. Metoden egner seg best til proksimale stenoser og er godt egnet til overvåkning av en stenose over tid.
Pasienter med ensidig nyrearteriestenose vil ha kraftig RAAS aktivering, i alle fall initialt, og man kan få mistanke om nyrearteriestenose på bakgrunn av høy renin og høy aldosteron. Målinger av renin og aldosteron fanger ikke opp tilfeller uten RAAS aktivering, spesielt ved bilateral nyrearteriestenose.
Renografi med kaptopril kan påvise forsinket utskillelse av radioisotop fra begge nyrer ved bilateral nyrearteristenose, og gir i tillegg utmerket funksjonell fremstilling av nyrene med god estimering av GFR. Metoden mangler fremstilling av nyrearterienes anatomi. Undersøkelsen kombineres ofte med målinger av renin og aldosteron i serum.
Blodtrykkskontroll er svært viktig ved renovaskulær sykdom. Både for å beskytte den uaffiserte nyren og for å forebygge andre kardiovaskulære hendelser.
RAAS-hemming er spesielt effektivt, men samtidig potensielt skadelig. Rollen til RAAS-hemming ved nyrearteriestenose har vekket stor interesse og debatt siden de første ACE-hemmerne kom på markedet på slutten av 70-tallet. Det kom raskt rapporter som beskrev reversibel akutt nyresvikt under kaptopril-behandling (7). På den andre siden har observasjonsstudier av pasienter med renovaskulær sykdom behandlet med RAAS-blokade, vist bedret blodtrykkskontroll, langsommere progresjon av nyresvikt, færre kardiovaskulære hendelser og lavere mortalitet (8-11). Dette er foreløpig ikke undersøkt i randomiserte studier, og er derfor fortsatt et kontroversielt tema. I CORAL-studien sto bare halvparten av pasientene på RAAS-hemmer ved inklusjon (12). Dette reflekterer klinikernes skepsis til RAAS-hemming ved nyrearteriestenose. I klinisk praksis titreres RAAS-hemming langsomt opp under tett observasjon, ofte supplert med flere andre medikamenter.
Statiner reduserer progresjon av nyrearteriestenoser og kan tidvis redusere plakk og stenoser(13). Disse bør gis uavhengig av kolesterolnivå. Som ved annen aterosklerotisk sykdom er lavdose acetylsalisylsyre (ASA) indisert. Alle pasienter med avansert karsykdom må på det sterkeste oppfordres til røykeslutt.
Fibromusklær dysplasi med hypertensjon behandles effektivt med angioplastikk med ballongdilatasjon uten stent. 35 til 45 % blir kurert til normalt blodtrykk uten medikamenter. Omtrent like mange får re-stenosering og må behandles på nytt. Ved store aneurismer kan kirurgisk revaskularisering være aktuelt.
Dersom man velger intervensjon mot aterosklerotiske lesjoner, bør det brukes stent. Langtidseffekten av intervensjon er imidlertid langt dårligere enn ved fibromuskulær dysplasi. Store randomiserte studier, sist CORAL-studien, viser at intervensjon ikke har bedret blodtrykkskontroll, bevart nyrefunksjonen eller bedret overlevelsen. Per i dag er den rådende oppfatningen at man skal være tilbakeholden med å behandle nyrearteriestenose så lenge man har god medikamentell blodtrykkskontroll, og nyrefunksjonen ikke er truet (14, 15).
Pasienter med kritisk nyrearteriestenose, plutselig lungeødem, alvorlig resistent hypertensjon eller raskt fall i nyrefunksjon er ikke inkludert i disse studiene. Hos disse pasientene gjøres ofte blokking og stenting for å forhindre kardiovaskulære komplikasjoner og berge nyrefunksjonen, men uten dokumentasjon fra randomiserte studier. I en registerstudie var 77 % av pasientene uten nye episoder av flash lungeødem etter at stenosen var blokket og stentet. De som hadde residiv, var pasienter med stenttrombose eller re-stenose (16).
Dersom man bestemmer seg for intervensjon, er det en fordel å gjøre det tidlig i forløpet, før nyren får kroniske iskemiske skader. Ved bilateral stenose skal man alltid blokke nyrearterien til den største nyren, da den minste må antas å ha irreversible iskemiske skader.
Referanser