I følge Global Observatory on Donation and Transplantation (GODT), www.transplant-observatory.org, gjennomgår 135.000-140.000 pasienter organtransplantasjon hvert år, og 90.000 av disse får et nyretransplantat. Posttransplantasjons-diabetes (PTDM) er betegnelsen på diabetes som diagnostiseres etter organtransplantasjon, og som ikke var oppdaget mens pasienten ble utredet for ventelisten til transplantasjon. I denne oversiktsartikkelen gjennomgås forekomst, årsaker, diagnostikk og behandling av tilstanden, med særlig fokus på PTDM hos nyretransplanterte.
Som sådan har PTDM mange likhetstrekk med diabetes type 2. PTDM har ikke en autoimmun årsak, og en del av risikofaktorene for å utvikle PTDM er også risikofaktorer for å utvikle diabetes type 2, for eksempel alder, arv og abdominal fedme. Det spesielle med PTDM er imidlertid at den også har utløsende årsaker som er direkte relatert til forløpet etter transplantasjon, spesielt medikamentene som brukes. Noen har også kalt PTDM for en «kjemisk» diabetes mellitus (1-3).
I internasjonal litteratur ble PTDM tidligere beskrevet som New-Onset Diabetes After Transplantation (NODAT). Denne betegnelsen har man gått bort fra, siden latent eller lavgradig diabetes ofte kan ha vært til stede før transplantasjonen, men ble oversett under utredningen (4). PTDM henspeiler derfor på tidspunktet for diagnose heller enn tidspunktet for sykdom. PTDM opptrer ved all organtransplantasjon som krever immunsuppresjon, det vil si transplantasjon av hjerte, lever, tarm, lunger og nyre. PTDM er best beskrevet hos nyretransplanterte, og det er denne pasientgruppen vi diskuterer i denne oversikten.
Forekomsten av PTDM har vært rapportert hos 10-40 % av alle pasienter som gjennomgår nyretransplantasjon. Den eksakte forekomsten er imidlertid usikker siden den avhenger av de diagnostiske kriterier som brukes, og i hvor stor grad man har utelukket diabetes før transplantasjon. I Norge har vi gjennom vår egen database fullstendig kartlagt forekomsten av PTDM etter nyretransplantasjon ved at vi rutinemessig utfører en oral glukosebelastning 8 uker etter transplantasjon. De tilfellene vi påviser med PTDM er for en stor del også NODAT, siden pasienten rutinemessig utfører en glukosebelastning under utredningen før de settes på venteliste til transplantasjon. Gjennomsnittlige ventetid på listen frem til transplantasjon er imidlertid 1 ½ – 2 år. Siden vi ikke utfører nye diagnostiske tester i ventetiden, kan noen få ha rukket å utvikle diabetes før transplantasjon. HbA1c som diagnostisk metode er uegnet hos disse pasientene med terminal nyresvikt. Disse pasientene har renal anemi på grunnet av nedsatt renal produksjon av erytropoietin og dermed nedsatt produksjon av røde blodlegemer. Mange blir behandlet med erytropoietin-injeksjoner, og endringer i benmargens produksjon av røde blodlegemer gjør HbA1c-verdien lite pålitelig (5).
I vårt materiale ved OUS Rikshospitalet finner vi PTDM hos 10 % av pasientene og nedsatt glukosetoleranse (IGT) hos 15 % (2). De fleste av våre pasienter er av kaukasisk opprinnelse. Forekomsten har vært lett fallende de siste 15 årene, trass i at våre pasienter ser ut til å utvikle stadig høyere kroppsvekt slik man ser ellers i befolkningen (6). Årsaken er trolig at avstøtning av transplanterte nyrer er sjeldnere nå enn tidligere, og derfor er det mye sjeldnere at pasientene behandles med store doser metylprednisolon. En spansk studie har, ved oppfølging over flere år med flere glukosebelastninger, nylig vist at insidensen av PTDM ser ut til å ha en bifasisk kurve: Høyest det første året postoperativt, deretter fallende før insidensen på nytt øker etter 2 år (7) (fig 1). Personer med IGT tenderer også til å utvikle PTDM over tid, men like mange utvikler normal glukosetoleranse flere år etter transplantasjonen (8). Personer som har normal glukosetoleranse 3 måneder etter transplantasjon ser ut til å ha har veldig lav risiko for å utvikle PTDM de nærmeste årene etterpå (8).
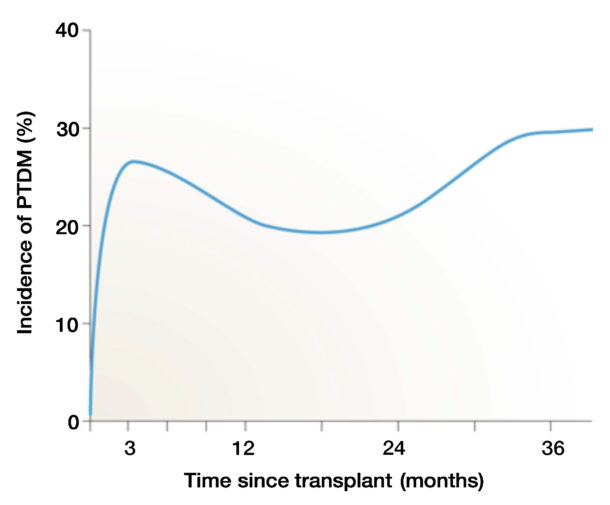
Figur 1. Figuren viser insidens av ny diabetes etter nyretransplantasjon (ref. 7).
Årsakene til PTDM hos nyretransplanterte deles ofte inn i de modifiserbare og de ikke-modifiserbare faktorene (v 2). Alder, kjønn, etnisitet og donor-recipient spesifikke forhold regnes som ikke-modifiserbare faktorer. Av de modifiserbare er det noen risikofaktorer felles med diabetes type 2 (for eksempel abdominal overvekt), men like viktig er legemidlene man bruker som immunsuppresjon.
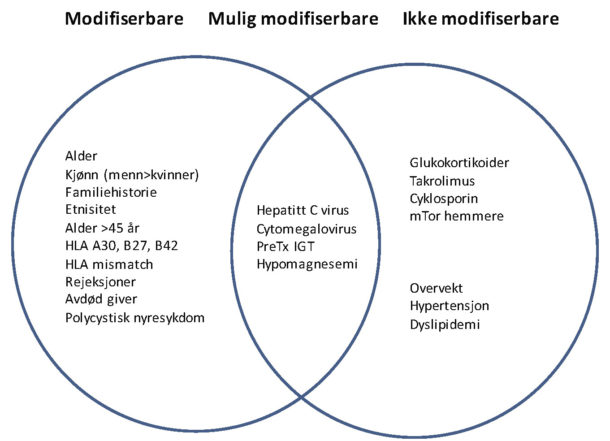
Figur 2. Figuren viser risikofaktorer for utvikling av posttransplantasjons-diabetes, inndelt etter om de er modifiserbare, mulig modifiserbare og ikke-modifiserbare.
Den klassiske triaden av immundempende legemidler som vi bruker, er prednisolon, kalsineurinhemmer (fortrinnsvis takrolimus) og mykofenolat. Av disse vet vi at prednisolon i aktuelle doser (>5 mg daglig) kan indusere insulinresistens, mens doser på 5 mg eller lavere sjeldnere gjør det (9). Man skal likevel huske at prednisolons farmakokinetikk kan variere betydelig fra person til person ved samme prednisolon-dose (10), så eksponeringen for medikamentet kan være veldig forskjellig hos to personer som bruker samme dose. Vi har dessverre ingen laboratoriemetode i klinikken som måler prednisolon-konsentrasjonen i blodprøver. Derimot monitorerer vi takrolimus-dosen ut fra fastende blodmålinger, og vi vet at høye doser av takrolimus (og i litt mindre grad ciklosporin) gir både insulinresistens og nedsatt beta-celle funksjon. Over lang tid kan forandringen i de langerhanske øyer bli irreversibel med fibrose. Effekten på insulinfrigjøringen forsterkes av høyt nivå av frie fettsyrer, slik at det spesielt er hos overvektige personer med insulinresistens, høye triglyserider og forhøyet nivå av frie fettsyrer (metabolsk syndrom) at takrolimus disponerer for PTDM (11). Bytte av takrolimus til en annen kalsineurin-hemmer (ciklosporin) kan til en viss grad bedre glukosenivåene ved PTDM (12), men ciklosporin har andre bivirkninger og regnes som mindre potent for å beskytte nyren mot avstøting. En medikamentgruppe som kalles mTor-hemmere brukes av og til som alternativ til mykofenolat eller takrolimus i behandlingen. Disse medikamentene har også bivirkninger som kan lede til diabetes (2).
Hepatitt C og cytomegalovirus (CMV)-infeksjon er assosiert med utvikling av PTDM (hepatitt C spesielt hos levertransplanterte), men det er ikke vist at antiviral behandling har noen effekt på PTDM. Abdominal fedme er disponerende for PTDM (13), og akkurat nå forfølger vi en hypotese om at magnesium-mangel kan være en bidragende årsak til PTDM hos nyretransplanterte. De fleste av våre pasienter har lave magnesium-nivå i blodet, dels på grunn av hyppig bruk av loop-diuretika, og dels fordi kalsineurin-hemmere (f.eks. takrolimus) øker magnesium-utskillelsen i urinen.
Oral glukose belastningstest har de siste 20 årene vært standard prosedyre for diagnostisering av PTDM (3, 14, 15). HbA1c som diagnostisk metode ved diabetes type 2 har etablert diagnostiske terskelverdier i forhold til risiko for å utvikle retinopati (1). Dette er ikke hovedproblemet ved PTDM, hvor risiko for pasientdød, kardiovaskulære komplikasjoner og grafttap er den viktigste bekymringen. Ikke bare PTDM, men også IGT etter nyretransplantasjon dobler mortaliteten til de nyretransplanterte over en periode på 10-12 år (fig. 3)(16). HbA1c og oral glukosebelastning definerer helt forskjellige populasjoner både ved diabetes type 2 (17) og ved PTDM (18). Når mer enn 1 år er gått etter transplantasjonen kan diagnostikken kanskje forenkles ved å bruke det såkalte «enten-eller-kriteriet» (enten fastende glukose ≥7 mmol/l eller HbA1c ≥48 mmol/mol (≥6,5%)). Dette kriteriet ser ut til å fange opp nær alle tilfellene av PTDM som diagnostiseres med en oral glukosebelastning (19) uten spesielt mange falsk positive diagnoser.
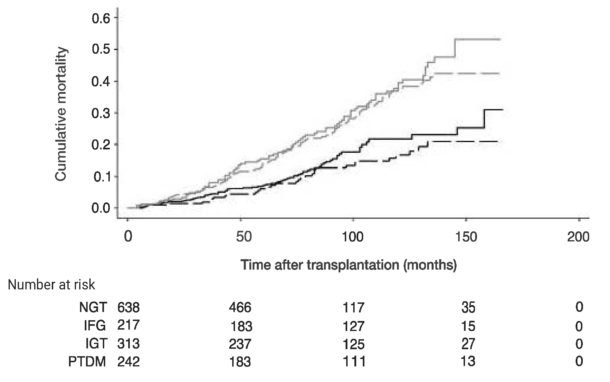
Figur 3. Figuren viser kummulativ mortalitet over tid etter nyretransplantasjon inndelt etter glukosestatus. NGT = normal glukosetoleranse, IFG = økt fastende glukose, IGT = nedsatt glukosetoleranse, PTDM = posttransplantasjons-diabetes (ref. 16).
PTDM har mange karakteristika til felles med type 2 diabetes: Nedsatt insulin-produksjon, insulinresistens og også mangelfull GLP-1 (glucagon-like peptide-1) regulering av insulin og glukagon (20). Likevel har PTDM hos nyretransplanterte særpreg som er spesielle og som må tas hensyn til ved valg av behandling:
Pasientene er avhengige av å bruke immunsuppressive legemidler, og disse kan interagere med andre legemidler, for eksempel de glukosesenkende medikamentene. Vi er derfor skeptiske til at resultater fra studier utført ved diabetes type 2 overføres direkte til pasienter med PTDM.
Pasientene har en spesielt høy kardiovaskulær risiko med uttalt arteriosklerose etter flere år med nyresvikt og uremi før transplantasjon. Koronar arteriosklerose med eller uten symptomer er vanlig, og behandling som øker faren for hypoglykemi er ikke å foretrekke.
Pasientene er transplantert med kun én nyre, så de har lavere GFR enn normalbefolkningen. GFR er i gjennomsnitt 50-60 ml/min/1.73m2.
Våre pasienter får generell instruksjon om sunt og vektstabiliserende kosthold etter operasjonen. Preoperativt er det et krav om at pasienten har BMI <30-32 kg/m2, dette for å redusere risikoen for kirurgiske komplikasjoner. I årene etter det er imidlertid vektkurven ofte stigende og ikke ulik vektkurven man ser i befolkningen for øvrig. Det fins ingen gode studier blant organtransplanterte på hvordan endring i levevaner påvirker PTDM, og det er sterkt ønskelig at slike studier gjøres.
I valg av glukosesenkende legemidler er det viktig å ta hensyn til pasientens immunsuppresjon, nyrefunksjon og kardiovaskulære risiko. På grunn av faren for hypoglykemi brukes nærmest ikke sulfonylurea-preparater lenger hos disse pasientene. Det er utført små sikkerhets- og effektstudier på enkelte medikamenter, men studiene er av kort varighet. Blant DPP4-hemmerne er det utført studier med sitagliptin (21, 22) og vildagliptin (23), mens metformin og GLP-1 receptor-agonister ikke er utprøvd og rapportert annet enn som kasuistikker. Alle studiene er av kort varighet (<1 år). Siste året er det publisert to rapporter på bruk av SGLT2-hemmeren empagliflozin (24, 25), hvorav den ene er en randomisert, placebo-kontrollert og dobbel-blindet studie av 24 ukers varighet (24). Medikamentet synes trygt å bruke uten økt infeksjonstendens i urinveiene, og gir vektreduksjon hos pasientene. Den glukosesenkende effekten er sterkt avhengig av den renal glukoseutskillelsen, og forsvinner når GFR er <50 ml/min/1.73m2.
Ved behov for glukosesenkende medikamenter velger vi ofte hos oss å starte med en DPP4-hemmer, for eksempel sitagliptin, og supplerer eventuelt med en SGLT2-hemmer (empagliflozin). Det er studier på gang som ser på effekt og sikkerhet av metformin-behandling ved PTDM, men disse studiene er ikke ferdige ennå.
Insulin brukes i kombinasjon med de foran nevnte medikamentene når glukosereguleringen svikter, men aldri som førstehånds medikament utenom i den postoperative situasjonen. På grunn av arteriosklerose og komorbiditet er streng glukoseregulering ikke anbefalt, anbefalt HbA1c under oppfølging er <58 mmol/mol (<7,5%). Algoritme for bruk av glukosesenkende medikamenter er nylig publisert i en review-artikkel (2).
Retningslinjene for kardiovaskulær risikoreduksjon følger stort sett de samme anbefalingene som for befolkningen for øvrig, selv om det ikke fins mange store randomiserte studier som dokumenterer risikoreduksjonen. Røykeslutt anbefales sterkt før organtransplantasjon. Blodtrykket bør ideelt holdes lavere enn 130/80, også av hensyn til den transplanterte nyren som gjerne har nedsatt autoregulering av intrarenalt blodtrykk. Den eneste randomiserte behandlingsstudien av noen størrelse er ALERT-studien, som viste at kolesterolsenking med fluvastatin var trygt uten vesentlig interaksjon med de immunsuppressive legemidlene, og behandlingen forebygget kardiovaskulære hendelser (26).
Referanser