 Ann-Elin Meling Stokland konstituert overlege, Medisinsk avdeling, Haugesund sykehus
Ann-Elin Meling Stokland konstituert overlege, Medisinsk avdeling, Haugesund sykehus Bjørn G. Nedrebø, overlege, dr.med. medisinsk avdeling., Haugesund sykehus og Universitetet i Bergen
Bjørn G. Nedrebø, overlege, dr.med. medisinsk avdeling., Haugesund sykehus og Universitetet i Bergen
Graves sykdom er vanligste årsaken til hypertyreose. Symptomer og manifestasjoner er svært varierende, fra tilfeldig oppdaget til en livstruende tilstand. Vi har flere behandlingsmuligheter ved Graves, og internasjonalt diskuteres fortsatt hva som er den optimale behandlingen.
Graves sykdom er den vanligste årsaken til hypertyreose, og en tilstand som en generell indremedisiner må kunne utrede og behandle. Som ved mange andre autoimmune sykdommer rammes kvinner oftere enn menn, med en rapportert ratio på 1:4-6 (1-2). Regionale forskjeller i insidens av hypertyreose og hvor stor andel som skyldes Graves sykdom, relateres blant annet til jodstatus i befolkningen og genetiske faktorer (3). Vi har ingen gode data på forekomsten av Graves sykdom i Norge, men data fra Nord-Trøndelagstudien fra 1995-1997 viste at 2,5% av kvinnene og 0,6% av mennene hadde hypertyreose (4). Svenske og danske data rapporterer en indsidens på 20-30/100.000, med høyest forekomst i aldersgruppen 30-60 år (1,3,5-6). I svenske datasett ser insidensen ut til å være økende.
Graves sykdom er en autoimmun sykdom som karakteriseres av autoantistoffer mot tyreotropin reseptor (TRAS). TRAS er oftest stimulerende, men kan også være blokkerende og føre til hypotyreose. Det er forholdet mellom stimulerende og blokkerende aktivitet som bestemmer hvilken stoffskifteforstyrrelse som inntreffer. En trofisk effekt av TRAS med strumautvikling sees ofte. Etiologien er ikke fullstendig klarlagt, men epidemiologiske data tyder på at det foreligger en interaksjon mellom genetisk sårbarhet og miljøfaktorer (7). Flere sårbarhetsgener har blitt identifisert. Dette inkluderer blant annet gener som koder for tyreoglobulin, tyreotropin (TSH)-reseptor, HLA-DR, protein tyrosine phosphatase, non-receptor type 22 (PTPN22), cytotoxic T-lymphocyte-associated protein 4 (CTLA4), CD25 og CD40 (7).
Sterkest er assosiasjonen til HLR-DR som forekommer hos 40-55% av pasienter med Graves sykdom og som gir en relativ risikoøkning på 3-4 (8,9). Hos monozygote tvillinger er det rundt 75% konkordans, noe som tyder på at epigenetiske faktorer også er av betydning (8). Beskrevne miljøtriggere er blant annet røyking, emosjonelt stress og infeksjon (10). Velkjent er også den økte forekomsten postpartum (8), og ved immunrekonstruksjon med alemtuzumab (Lemtrada),”highly active antiretroviral therapy” (HAART), checkpoint inhibitorer ved kreftbehandling og beinmargstransplantasjon (11).
Graves sykdom kan variere fra å være nærmest asymptomatisk, eventuelt med atrieflimmer som eneste manifestasjon hos eldre, til et stormende forløp med tyreotoksisk krise. Hvor symptomatisk pasienten blir, er avhengig av alder ved debut, nivå av stoffskifteforstyrrelsen og hvor lenge den har vedvart (12). De mest klassiske hypertyreote symptomene er varmefølelse, slapphet, vekttap, tremor og hjertebank. Andre og mindre spesifikke symptomer kan være tungpust, diare, menstruasjonsforstyrrelser, nedsatt libido og muskelsvakhet. Atrieflimmer som manifestasjon er som i andre tilfeller økende i sin forekomst med alder og vanligst hos pasienter over 60 år (13). Et diffust struma vil ofte foreligge.
Av ekstra-thyroidale manifestasjoner er orbitopati (bilde 1, s. 16) den viktigste og vanligst forekommende, hos om lag 20% av pasientene. Orbitopatien kan inntreffe før, ved eller etter debut av hypertyreose. Insidenstoppen ser ut til å ligge i aldersgruppen 40-60 år (14). Også her er det stort spenn i alvorlighetsgrad. Symptomene og funnene kan misoppfattes som allergi med rennende øyne, rødhet på konjunktiva og hovne øyelokk. Andre symptomer vil kunne være orbital hodepine, smerter ved øyebevegelse eller lysskyhet. I de alvorligste tilfellene foreligger uttalt øyelokksretraksjon, proptose og diplopi, evt nedsatt visus. Siden orbitopati ikke nødvendigvis er tilstede ved behandlingsoppstart, men vil kunne utvikle seg senere, vil det være nyttig å kunne si noe om hvilke pasienter som har risiko for å utvikle orbitopati. I en multisenter prospektiv cohortstudie fant man at tilstedeværelse av øyesymptom ved første vurdering (klinisk aktivitetsskår/ CAS>1), nivå av TRAS, hvor lenge pasienten hadde gått med ubehandlet hypertyreose og røykestatus, var av betydning for å utvikle orbitopati (PREDIGO score). I denne studien utviklet 15% av pasientene orbitopati i oppfølgingstiden (6-12 måneder) etter oppstart av medikamentell behandling (15).
En annen og langt sjeldnere ekstratyroidal manifestasjon er dermopati, også kalt pretibialt myxødem (bilde 2, s. 17). Denne tilstanden forekommer oftere hos pasienter med orbitopati og er forbundet med mer aggressiv sykdom. (16).
Graves sykdom kan i de aller fleste tilfeller behandles poliklinisk, men noen kliniske situasjoner krever raskere vurdering og dette må den generelle indremedisiner kjenne til.
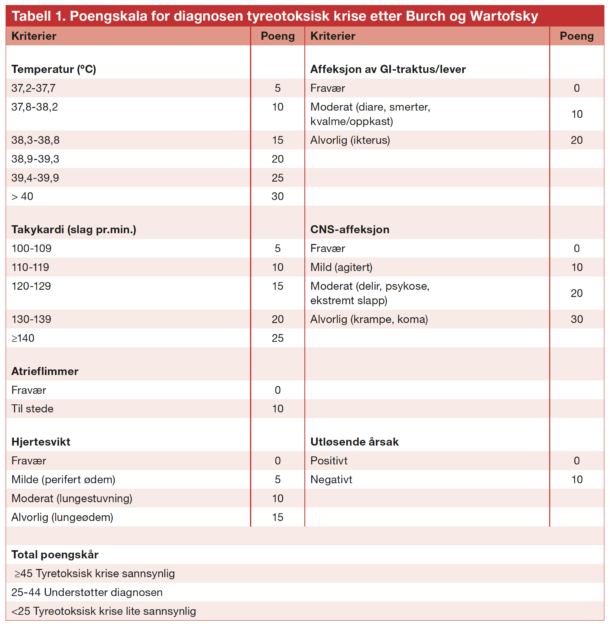
1. Tyreotoksisk krise: Dette er hypertyreose i sin ytterste konsekvens med dekompensering av en eller flere organsystemer. Klassiske hypertyreote symptomer foreligger som regel. Tilstanden karakteriseres av en eller flere av; feber, supraventrikulær takykardi med eller uten hjertesvikt, gastrointestinale symptomer og CNS-symptomer. Det er viktig å merke seg er at stoffskifteprøvene nødvendigvis ikke trenger å være høyere enn ved vanlig kompensert hypertyreose. Sannsynligvis foreligger det en rask stigning i andelen fritt hormon, endring i bindeprotein og økt cellulær respons på tyreoideahormon. Utløsende årsaker er blant annet infeksjon, traume, non-compliance, bruk av medikamenter (amiodrarone, ipilimumab) eller jodholdig kontrast og kirurgi uten adekvat forbehandling. Å stille diagnosen tyreotoksisk krise kan være krevende, spesielt grunnet overlapp med en rekke andre indremedisinske tilstander. Det finnes ingen definerte diagnostiske kriterier, men scoringsverktøy etter Bursch og Wartovsky anbefales brukt og sier noe om sannsynligheten for at krise foreligger (17, tabell 1). Tilstanden krever rask behandling i sykehus. Mortaliteten er høy, rundt 10% i de største studiene (18,19).
2. Alvorlig orbitopati: Økende utstående øyne, diplopi, redusert visus eller fargesyn er faktorer som tilsier rask vurdering hos øyelege.
3. Tyreotoksisk periodisk paralyse: Karakteriseres av akutte, muskellammelser ledsaget av hypokalemi hos en tyreotoksisk pasient. Dette er en sjelden tilstand hos kaukasere, men er vanligere hos asiatiske menn (19). Tilstanden krever akutt innleggelse i sykehus for arytmiovervåkning og korrigering av hypokalemi, som vil reversere paresene. God behandling av hypertyreosen vil forebygge nye anfall.
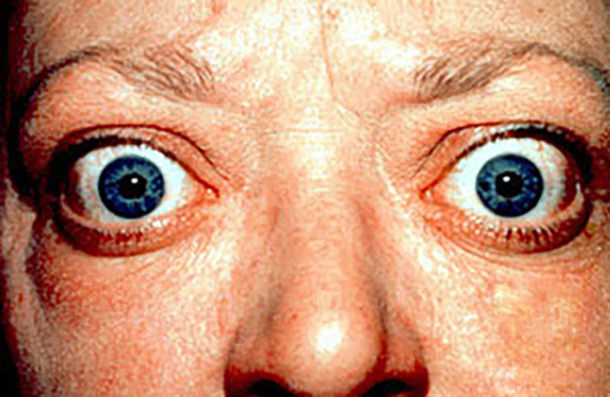
Bilde 1. Oftalmopati (bilde fra Wikipedia.org).
Diagnostikken av hypertyreose er enkel. Første steg er å bekrefte at hypertyreose foreligger gjennom måling av TSH, fritt-T4 (FT4) og evt fritt-T3 (FT3). Lav TSH og høy FT3/ FT4 gir diagnosen. Neste steg er å fastslå etiologi. Dersom TRAS er positiv, er dette nok for å stille diagnosen Graves sykdom og videre bildediagnostikk er ikke nødvendig. Ultralyd er indisert ved palpable knuter som tilsier indikasjon for FNAC, evt hvis kirurgisk behandling planlegges. TRAS er positiv hos omkring 95% av pasientene med Graves. Ved negativ TRAS er aktuelle differensial diagnoser knutestruma/ toksisk adenom, subakutt-, stilleeller medikamentuløst tyreoiditt og postpartum tyreodititt. Disse tilstandene vil man som regel kunne skille fra hverandre gjennom grundig anamnese, klinisk undersøkelse og vurdering av blodprøver inkludert SR og CRP. Ved fortsatt diagnostisk usikkerhet vil neste steg være tyreoideascintigrafi. Scintigrafi vil kunne skille mellom TRAS-negativ Graves, knutesykdom eller annen tyreoditt. Ved Graves sykdom vil man forvente homogent økt opptak. Scintigrafi er kontraindisert i svangerskap og ved amming.
I prinsippet foreligger tre behandlingsmuligheter; medikamentell behandling, radiojod eller kirurgi. I Norge, og Europa for øvrig, anses medikamentell behandling som første valg ved første episode med Graves i de fleste tilfeller (21,22). I USA er det fortsatt utstrakt brukt av radiojod som førstelinjebehandling (17,23). Det sterkeste argumentet for å velge medikamentell behandling er at rundt 50% av pasientene forventes å gå i varig remisjon (24), og at konsekvensene (hypotyreose) og eventuelle komplikasjoner av både radiojod og kirurgi kan være permanente.
1. Medikamentell behandling, tyreostatika:
To preparater er tilgjengelige i Norge; karbimazol (Neo-mercazol) og propylthiouracil (PTU). Karbimazol anses som førstevalg grunnet lavere bivirkningsprofil, unntatt i 1. trimester hvor PTU anbefales. Man kan enten gi karbimazol i monoterapi og dosere avhengig av stoffskifteprøver med mål om lavest mulig effektiv dose, såkalt titrerende regime. Alternativt kan man gi karbimazol i høyere dose i kombinasjon med tyroksin – blokkerende regime. Titrerende regime er å foretrekke grunnet lavere dosering og mindre risiko for bivirkninger (22, 25). Blokkerende regime gir mer stabile stoffskifteprøver og er best egnet hos pasienter med høy sykdomsaktivitet, aktiv orbitopati og som forbehandling til tyreoidektomi (21). Den medikamentelle behandlingen tolereres godt av de aller fleste, men mindre hudreaksjoner er ikke uvanlig. Ved lette tilfeller kan tillegg av antihistaminer forsøkes, i mer uttalte tilfeller kan man forsøke bytte fra kabimazol til PTU etter at den initiale reaksjonen har roet seg (17,21,22). Ved alvorlige urtikarielle reaksjoner må behandlingen seponeres helt uten overgang til alternativt regime da kryssreaksjoner ofte vil foreligge. Artralgier, feber og forbigående leukopeni er andre ikke sjeldne bivirkninger (22). En svært sjelden, men fryktet bivirkning, er agranulocytose som vanligvis vil inntreffe innen 3 måneder etter oppstart. Alle pasienter som starter behandling må informeres grundig om å oppsøke lege ved feber eller andre infeksjonstegn. Eksempler på andre alvorlige og sjeldne bivirkninger er PTU-indusert hepatitt med leversvikt, ANCA-assosiert vaskulitt og lupus-lignende syndrom (21). I 2019 gikk EMA (European Medicines Agency) ut med en advarsel om assosiasjon mellom karbimazol og akutt pancreatitt etter seks innmeldte tilfeller. I en nylig publisert dansk registerbasert kohortstudie ble assosiasjonen mellom karbimazol og akutt pancreatitt bekreftet med en odds ratio på 1,51 (26). Dette er fortsatt en svært sjelden bivirkning, men det er viktig at vi får økt bevissthet rundt dette da konsekvensene ved fortsatt bruk av medikamentet kan være fatale.
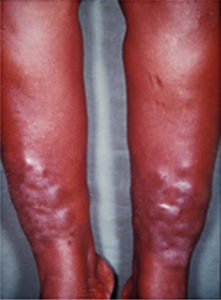
Bilde 2. Graves dermopati (bilde fra Wikipedia.org)
Anbefalt behandlingsvarighet ved Graves sykdom er 12-18 måneder (17,21,22). Ved vurdering av seponering måles TRAS først og behandlingen avsluttes dersom TRAS er blitt negativ. Etter seponering anbefales regelmessig kontroll av stoffskifteprøver for å plukke opp et eventuelt residiv. Dersom TRAS fortsatt er positiv etter 18 måneder, kan behandlingen kontinueres videre med ny vurdering etter 1 år, alternativt kan pasienten henvises til permanent behandling (22). Residivrisikoen etter seponering ligger på rundt 50% i vår populasjon (24). Det har lenge vært kjent at TRAS er en god prognostisk markør. Høy TRAS ved debut og/eller fortsatt positiv TRAS etter 12-18 måneders behandling er ansett som et negativt prognostisk tegn (24,27). Røyking gir både økt risiko for alvorligere forløp med orbitopati og lavere sannsynlighet for varig remisjon. Den økte risikoen ser ut til å være avhengig av røykemengden og vedvarer i flere år etter røykeslutt (28). En viktig del av behandlingen er derfor råd om røykestopp. En metaanalyse fra 2017 oppsummerte at tilstedeværelse av orbitopati, strumastørrelse og biokjemisk alvorlighetsgrad (nivå av FT3, FT4 og TRAS) var viktig for residivrisikoen. Faktorer som ikke kom signifikant ut, var kjønn og alder ved debut (29). Data vi har om Graves med debut i barne- og ungdomsår tilsier dog at alder er av prognostisk betydning (22). Erfaring fra en klinisk praktisk hverdag tilsier også at menn ofte får et mer alvorlig forløp. Scoringsverktøyet GREAT deler pasientene inn i tre kliniske grupper basert på alder, nivå av FT4 og TRAS og strumastørrelse ved debut. Residivrisiko varierte fra 16% til 68% mellom de tre gruppene. Dersom man supplerte med HLA-typing og testing for en genetisk polymorfisme i PNT22 kunne man differensiere pasientene ytterligere (30). GREATscore er senere validert og funnet nyttig av flere andre grupper (31-33). Denne type risikostratifisering kan være spesielt nyttig i valg av behandling hos fertile kvinner med svangerskapsønske.
Hva angår medikamentell strategi finner man lik remisjonsrate ved blokkerende vs titrerende behandling (25). Dette er en av argumentene for å kunne si at tyreostatika sannsynligvis ikke virker immunmodulerende. Andre argumenter er at vi ser remisjon uavhengig av type medikamentvalg (karbimazol, PTU og til og med perklorat) og at fallet i TRAS er sammenlignbart enten pasient blir behandlet med kirurgi eller medikasjon. Overnevnte argumentasjon tilsier at det er det å bli eutyreot som er avgjørende for immunmoduleringen (34).
Optimal behandlingsvarighet angis fortsatt til 12-18 måneder i nasjonale og internasjonale retningslinjer (17,21,22). Dokumentasjonen bak dette må ses på som begrenset (25). De siste 10 årene har vi fått flere, men små studier som tyder på at langtidsbehandling med karbimazol er trygt (35-39). I 2019 kom det flere studier som i tillegg kunne tyde på høyere remisjonsrate ved å forlenge behandlingen utover 18 måneder (40-42). I en av studiene med lang oppfølgingstid kunne man finne at TRAS kan forsvinne selv etter mange år på behandling (41). Vi må derfor kunne sette et spørsmålstegn bak optimal behandlingsvarighet. Langtidsbehandling med karbimazol fremstår etterhvert som et godt alternativ hos pasienter som ikke går i remisjon eller får residiv så lenge dosebehovet er lavt og det er fravær av bivirkninger.
2. Radiojod:
Radiojodbehandling er et alternativ hos pasienter som enten ikke går i remisjon, har bivirkninger av tyreostatika eller får residiverende episoder med Graves sykdom. Radiojodbehandling vil være best egnet for pasienter med lav sykdomsaktivitet og lite struma (21). Målet med behandlingen er å gi en stor nok dose til å hindre residiv, dermed blir det også behov for livslang tyroxinbehandling i etterkant. De første dagene til ukene etter behandlingen er det ikke uvanlig at pasienten får forbigående forverring av hypertyreose og ømhet over kjertelen (stråleindusert tyreoiditt). Tyreotoksisk krise er rapportert, men ekstremt sjeldent ettersom pasientene som regel er godt forbehandlet. Det er viktig at pasienten følges med regelmessige blodprøver i etterkant av behandlingen, og at tyroksin startes før TSH-stigning tilkommer. En velkjent komplikasjon av radiojodbehandling er nyoppstått eller forverring av kjent orbitopati, som har en rapportert forekomst på rundt 15-30 % (22, 43,44). Kjente risikofaktorer for orbitopati er røyking, høy FT3 og TRAS ved debut eller på behandlingstidspunkt, samt TSH-stigning i etterkant av behandling. Pasienter med moderat aktiv orbitopati er ikke kandidater for radiojodbehandling. Ved mild orbitopati kan man vurdere å gi radiojodbehandlingen under steroiddekke (22). Radiojodbehandling er forbundet med langvarig og uforutsigbar stigning av TRAS (45). Av samme årsak bør man nøye overveie behandlingen hos kvinner i fertil alder. Erfaringen med radiojodbehandling er etterhvert lang, fra 1940-årene. De første rapportene har ikke tydet på økt kreftforekomst (46), men i løpet av 2019 kom det en ny studie som viser en moderat risikoøkning for mortalitet av kreft i solide organer, inkludert brystkjertel (47). Sistnevnte studie har i etterkant blitt kritisert for ikke å korrigere for risikofaktorer som røyk, overvekt og alkohol, samt at det ikke forelå noen kontrollgruppe. Basert på dette har Society for Endocrinology og British Thyroid Association gått ut med at nåværende praksis ikke anbefales endret, men at større og bedre studier trengs for å kartlegge den potensielt økte risikoen (48). I januar 2020 ble det publisert en ny kohortstudie som ikke fant assosiasjon mellom radiojod og cancer, men denne studien hadde kortere oppfølgningstid (49).
3. Kirurgi:
Kirurgi er et godt behandlingsalternativ hos pasienter med høy sykdomsaktivitet og stort struma, ved aktiv orbitopati eller svangerskapsønske. Det anbefales total tyreoidektomi for å unngå residiv. I forkant av kirurgi må pasienten forbehandles medikamentelt og bør være eutyreot på operasjonsdagen. Blokkerende regime anbefales for potensielt å kunne krympe struma og redusere gjennomblødning i kjertelen (21). Noen steder gir man joddråper (Lugols dråper) rutinemessig preoperativt, men dette er det ikke tradisjon for i Norge unntatt ved bivirkninger av tyreostatika eller i situasjoner hvor rask normalisering av stoffskifteprøver er nødvendig. Potensielle komplikasjoner er permanent hypoparatyreoidisme (2-5 %) og skade på nervus reccurens (1-2%) (17,21). Forbigående hypokalsemi postoperativt er vanlig. Postoperativt faller TRAS relativt raskt de første tre månedene hos de fleste pasienter før den flater ut. TRAS sin halveringstid ser ut til å være langsommere hos pasienter med høye verdier preoperativt, tilstedeværelse av orbitopati, og hos røykere (50).
Ved nyoppståtte symptomer hos pasienter med Graves er det derfor viktig å tenke på muligheten for at annen autoimmun sykdom kan ha tilkommet.
Graviditet må planlegges godt i samråd med behandler hos pasienter med Graves sykdom. Innledning av svangerskap anbefales ikke ved aktiv sykdom og må utsettes til pasienten har gått i remisjon. Dette skyldes primært at tyreostatika kan gi føtale misdannelser og at TRAS passerer over til barnet og vil kunne gi hypertyreose. Dersom pasienten likevel velger å bli gravid før behandling er avsluttet, bør det ventes til sykdomsaktiviteten er lav og prøvene er stabile. I svangerskapet tilstrebes seponering av tyreostatika dersom mulig, spesielt i uke 5-10 hvor risikoen for misdannelser er størst. Ved fortsatt behandlingsindikasjon anbefales PTU i første trimester, evt bytte til neo-mercazol fra 2. trimester i lavest mulig dosering. Blokkerende behandling må ikke benyttes i svangerskapet. Stoffskifteprøver kontrolleres hyppig initialt og etterhvert med 2-4 ukers mellomrom. Målet er stoffskifteprøver (ev FT4) i øvre del av referanseområdet, eventuelt akseptere lett forhøyede verdier dersom dosebehovet er høyt. TRAS kontrolleres i uke 20, fostermedisinsk oppfølgning anbefales hvis verdien fortsatt er over tre ganger øvre referansegrense (21). TRAS anbefales kontrollert på ny før fødsel omkring uke 36. Ved hissig sykdom hos fertile kvinner med svangerskapsønske og liten sannsynlighet for varig remisjon bør tyreoidektomi anbefales. Etter kirurgi bør innledning av svangerskap avventes til stoffskifteprøver har vært stabile over noe tid og TRAS har kommet ned. TRAS skal kontrolleres tidlig i svangerskapet også hos pasienter som tidligere er behandlet for Graves, enten det er med radiojod eller kirurgi.
Hypertyreose er forbundet med nedsatt livskvalitet, økt kardiovaskulær morbiditet og sannsynligvis også mortalitet (51,52). Pasienter med Graves sykdom har i tillegg økt risiko for å utvikle andre autoimmune sykdommer, og inngår blant annet i autoimmunt polyendokrint syndrom type 2 (53). En kohort studie på 523 pasienter med Graves sykdom fant at 3,3% hadde positive 21-hydroksylase antistoffer og 1,1% hadde Addison sykdom, i samme kohort hadde 8,3% av pasientene B12-mangel/atrofisk gastritt. Det var lav forekomst av cøliaki. 9,2% hadde type 1 diabetes, og ytterligere 4,6% positiv anti-GAD uten diabetes (54). En nylig svensk studie med 278 nydiagnostiserte Graves pasienter fant man at 38 (13,7%) hadde positiv anti-GAD, anti- IA2 eller zink-transporter 8 antistoff. Bare 10 av disse hadde kjent diabetes før Graves ble diagnostisert, ytterligere 4 utviklet diabetes i oppfølgingstiden som gjennomsnittlig var på 9 år (55). En britisk kohort som inkluderte 2791 Graves pasienter fant at totalt 10 % av pasientene hadde annen autoimmun sykdom, hvor reumatoid artritt var vanligst etterfulgt av vitiligo, pernisøs anemi, type 1 diabetes, cøliaki, inflammatorisk tarmsykdom, systemisk lupus erytematosus, multippel sklerose og Addison sykdom (56). Ved nyoppståtte symptomer hos pasienter med Graves er det derfor viktig å tenke på muligheten for at annen autoimmun sykdom kan ha tilkommet. I en nylig svensk studie med lang oppfølgningstid av 975 pasienter behandlet for Graves sykdom fant man nedsatt livskvalitet hos pasientene 6-10 år etter behandling sammenlignet med normalpopulasjon. Ved avslutning av oppfølgingstiden rapporterte 25% at de fortsatt ikke følte seg bra. Vanligst rapporterte årsaker var trøtthet, øyerelaterte symptomer og problemer rundt tyroksindosering. I samme materiale så man at 23% av pasientene som var i varig remisjon etter medikamentell behandling, brukte tyroksin av en eller annen årsak, kun 40% av de som ble behandlet medikamentelt hadde bevart tyreoideafunksjon uten behov for tyroksin (57). Pasientene som var behandlet med radiojod ble funnet å ha signifikant dårligere livskvalitet sammenlignet med de som var behandlet medikamentelt eller med kirurgi (58). Det skal nevnes at pasientene som var radiojodbehandlet både hadde signifikant høyere alder og mer komorbiditet, noe forfatterne mener de har korrigert for i analysen. Dette er uansett interessante funn og vi trenger flere studier for å konkludere sikkert.
Oppsummering:
Graves sykdom er den vanligste årsaken til hypertyreose. Symptomene og manifestasjonene varierer fra å være tilfeldig oppdaget til en livstruende tilstand. Vi har tre behandlingsalternativer ved Graves. I Europa anses medikamentell behandling som førstevalg. Faktorer som er av betydning for behandlingsvalg er sykdomsaktivitet, strumastørrelse, alder, tilstedeværelse av orbitopati og svangerskapsønske. Graves sykdom er forbundet med langvarig redusert livskvalitet og det er økt forekomst av annen autoimmun sykdom.
1) Abraham-Nordling, Insidence of hyperthyroidism in Sweden, Eur J Endocrinol, 2011
2) Carle et al, Epidemiology of subtypes of hyperthyroidism in Denmark – a population-based study. European Journal of Endocrinology 2011
3) Laurberg et al, The Danish investigation on idodine intake and thyroid disease, DanThyr: Status and perspectives, EJE 2006
4) Bjøro et al, Prevalens av hypotyreose og hypertyreose i Nord-Trøndeland, Tidsskr Nor Lægeforen 2002;
5) Abraham-Nordling et al, Insidence of hyperthyreoidism in Stockholm, Sweden, 2003-2005, Eur J Endocrinol, 2011
6) Nyström et al, Incidence rate and clinical features of hyperthyroidism in a long-term iodine sufficient area of Sweden (Gothenburg) 2003-2005, Clin endocrinol 2013
7) Tomer Y. Mechanisms of autoimmune thyroid diseases: from genetics to epigenetics. Annu Rev Pathol 2014
8) Sturja et al, Is Graves’ disease a primary immunodeficiency? New immunological perspectives on an endocrine disease, BMC medicine, 2017
9) Jacobsen et al, THE HLA GENE COMPLEX IN THYROID AUTOIMMUNITY: FROM EPIDEMIOLOGY TO ETIOLOGY, Journal of autoimmunity, 2008
10) Vestergaard et al, Smoking and thyroid disorders–a meta-analysis. Eur J Endocrinol. 2002
11) Muller et al, 2019 European Thyroid Association Guidelines on the Management of Thyroid Dysfunction following Immune Reconstitution Therapy
12) Smith et al, Graves` disease, NJEM, 2016
13) Frost et al, Hyperthyroidism and Risk of Atrial Fibrillation or FlutterA Population-Based Study, JAMA internal medicine, 2004
14) Laurberg et al, Incidence and Clinical Presentation of Moderate to Severe Graves’ Orbitopathy in a Danish Population before and after Iodine Fortification of Salt, JCEM 2012 15) Wiersinga et al, Predictive score for the development or progression of Graves’ orbitopathy in patients with newly diagnosed Graves’ hyperthyroidism, Eur J Endocrinol. 2018
16) Fatourechi et al, Thyroid dermopathy and acropachy. Best Pract Res Clin Endocrinol Metab2012;
17) Ross et al.2016 American Thyroid Association Guidelines for Diagnoses and Management og Hyperthyroidism and other causes of Thyrotoxicosis. Thyroid. American Thyroid Association. Thyroid 2016
18) Akamisu et al, Diagnostic criteria, Clinical Features, and Incidence of thyroid storm based on nationwide surveys, Thyroid 2012
19) Ono et al, Factors Associated with Mortality of Thyroid Storm, Medicine 2016
20) Vijayakumar et al, Thyrotoxic Periodic Paralysis: Clinical J Thyroid Res. 2014;
21) Nasjonal veileder i Endokrinologi, Graves hypertyreose
22) 2018 European Thyroid Association Guideline for the Management of Graves’ Hyperthyroidism, European Thyroid Journal
23) A 2015 Italian Survey of Clinical Practice Patterns in the Management of Graves’ Disease: Comparison with European and North American Surveys, Eur Thyr J 2016
24) Nedrebo et al, Predictors of outcome and comparison of different drug regimens for the prevention of relapse in patients with Graves’ disease. Eur J Endocrinol, 2002
25) Abraham et al, Antithyroid drug regimen for treating Graves’ hyperthyroidism, Cochrane 2010
26) Blix et al, Acute pancreatitis is significantly increased among methimazole, but not propylthiouracil users. Evidence from a nationwide, case-crossover, and case- control study, 2019
27) Shyamasunder et al, Measuring TSH recptor antibody to influence treatment choice in Graves` disease, Clin Endocrinol (Oxf), 2017
28) Holm et al, Smoking and other lifestyle factors and the risk of Graves´ hyperthyroidism, Arch intern med 2005
29) Sturja et al, Can we predict relapse in Graves` disease? Results from a systematic review and meta-analysis, Eur J Endocrinol 2017
30) Vos et al, Predicting the Risk of Recurrence Before the Start of Antithyroid Drug Therapy in Patients With Graves’ Hyperthyroidism, J Clin Endocrinol Metab. 2016
31) Struja T et al, External validation of the GREAT score to predict relapse risk in Graves’ disease: results from a multicenter, retrospective study with 741 patients. Eur J Endocrinol. 2017
32) Zuhur et al, External Validation of the GREAT Score in Turkish Patients with Graves’ Hyperthyroidism Treated with the Titration Regimen Method of Antithyroid Drugs: A Multicenter Study., Horm Metab Res. 2019
33) Masiello et al, Antithyroid drug treatment for Graves’ disease: baseline predictive models of relapse after treatment for a patient-tailored management, J Endocrinol Invest. 2018
34) Laurberg et al, Remission of Graves´ disease during anti-thyroid drug therapy. Time to reconsider the mechanism? Eur J Endocrinol, 2006
35) Laurberg et al,Sustained Control of Graves’ Hyperthyroidism During Long-Term Low-Dose Antithyroid Drug Therapy of Patients with Severe Graves’ Orbitopathy, Thyroid, 2011
36) Elbers et al, Outcome of very long-term treatment with antithyroid drugs in Graves’ hyperthyroidism associated with Graves’ orbitopathy, Thyroid, 2011
37) Azizi et al, Effect of long-term continuous methimazole treatment of hyperthyroidism: comparison with radioiodine, Eur J Endocrinol. 2005
38) Azizi et al, Long-term continuous methimazole or radioiodine treatment for hyperthyroidism, Arch Iran Med. 2012
39) Villagelin et al, Outcomes in Relapsed Graves’ Disease Patients Following Radioiodine or Prolonged Low Dose of Methimazole Treatment, Thyroid 2015
40) Azizi el al, Increased Remission Rates After Long- Term Methimazole Therapy in Patients with Graves Disease: Results of a Randomized Clinical Trial, Thyroid 2019
41) Bandai et al, The long-term follow-up of patients with thionamide-treated Graves’ hyperthyroidism, Endocr J. 2019
42) Karmisholt et al, Predictors of Initial and Sustained Remission in Patients Treated with Antithyroid Drugs for Graves’ Hyperthyroidism: The RISG Study, Journal of Thyroid Research 2019
43) Ponto et al, The tale of radioiodine and Graves’ orbitopathy, Thyroid 2010
44) Bartalena et al, Use of corticosteroids to prevent progression of Graves’ ophthalmopathy after radioiodine therapy for hyperthyroidism. N Engl J Med 1989
45) Laurberg et al, TSH-receptor autoimmunity in Graves’ disease after therapy with anti-thyroid drugs, surgery, or radioiodine: a 5-year prospective randomized study, Eur J Endocrinol. 2008
46) Ron et al, Cancer mortality following treatment for adult hyperthyroidism. Cooperative Thyrotoxicosis Therapy Follow-up Study Group. JAMA 1998
47) Kitahara et al, Association of Radioactive Iodine Treatment With Cancer Mortality in Patients With Hyperthyroidism, JAMA 2019
48) Taylor et al, Joint statement from the Society for Endocrinology and the British Thyroid Association regarding ‘Association of Radioactive Iodine Treatment with cancer mortality in patients with hyperthyroidism, Clinical Endocrinology 2019
49) Gronich el al, Cancer Risk After Radioactive Iodine Treatment for Hyperthyroidism: A Cohort Study, Thyroid 2020
50) Yoshioka et al, Kinetic analyses of changes in serum TSH recptor antibody values after total thyroidectomy in patients with Graves` disease, Endocr J. 2016
51) Bano et al, Thyroid Function and the Risk of Atherosclerotic Cardiovascular Morbidity and Mortality: The Rotterdam Study, Circ Res. 2017
52) Giesecke eal,Increased Cardiovascular Mortality and Morbidity in Patients Treated for Toxic Nodular Goiter Compared to Graves’ Disease and Nontoxic Goiter, Thyroid. 2017
53) Husebye et al, Autoimmune Polyendocrine Syndromes, NJEM 2018
54) Wiebolt et al, Clustering of additional autoimmunity behaves differently in Hashimoto’s patients compared with Graves’ patients, EJE 2011
55) Jonsdottir et al, Prevalence of diabetes and presence of autoantibodies against zinc transporter 8 and glutamic decarboxylase at diagnosis and at follow up of Graves` disease, Endocrine 2019
56) Boelaert et al, Prevalence and relative risk of other autoimmune diseases in subjects with autoimmune thyroid disease. Am J Med 201057) Sjölin et al, The Long-Term Outcome of Treatment for Graves’ Hyperthyroidism, Thyroid 2019
58) Törring et al, Impaired Quality of Life After Radioiodine Therapy Compared to Antithyroid Drugs or Surgical Treatment for Graves’ Hyperthyroidism: A Long-Term Follow-Up with the Thyroid-Related Patient-Reported Outcome Questionnaire and 36- Item Short Form Health Status Survey, Thyroid 2019