
Trine Finnes
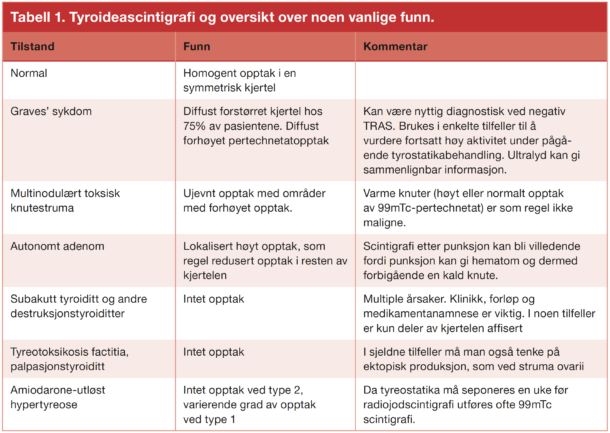
Hypertyreose er en vanlig sykdom blant voksne. Diagnosen stilles som regel ved gjentatte målinger av tyroideastimulerende hormon (TSH), fritt tyroxin (fT4), eventuelt fritt trijodtyronin (fT3). I de tilfellene anti-TSH reseptor antistoff (TRAS) er negativ kan det være nødvendig med tyroideascintigrafi for å finne årsaken.
De vanligste årsakene til vedvarende hypertyreose er Graves sykdom, toksisk knutestruma og autonomt adenom (1). I tillegg kan man se forbigående hypertyreose som ledd i en subakutt tyroiditt, post-partum tyroiditt eller stille tyroiditt. Jod og amiodarone er også kjent for å kunne utløse tyrotoksikose.
Graves‘sykdom utgjør 70-80 % av årsakene til hypertyreose og er dermed den hyppigste årsaken til hypertyreose. Tilstanden er karakterisert ved infiltrasjon av spesifikke T-celler i vev som uttrykker tyroideastimulerende hormonreseptor (TSH-reseptor). Stimulerende autoantistoffer aktiverer TSH-reseptoren og fører til skjoldbruskkjertelhyperplasi og overproduksjon og sekresjon av skjoldbruskkjertelhormon. Antistoffet måles enten som anti-TSH reseptor antistoff (TRAS) som kan virke både stimulerende og inhiberende og som tyroideastimulerende immunglobuliner (TSI) som kun måler de stimulerende antistoffer. Diagnosen Graves’ sykdom stilles på bakgrunn av kliniske funn, bekreftet tyrotoksikose i gjentatte blodprøver og positiv TRAS i serum. Graves’ hypertyreose behandles ved å redusere syntese av skjoldbruskhormon ved bruk av tyrostatika, eller ved å redusere mengden skjoldbruskkjertelvev med radiojodbehandling eller tyroidektomi (1). De fleste behandles medikamentelt i 12-18 måneder ved første gangs tilfelle. Ved Graves’ sykdom med positiv TRAS stilles diagnosen uten billedundersøkelse. Ved negativ TRAS bør pasienten utredes med tanke på andre årsaker til tyrotoksikose. Stille («silent» / painless) tyroiditt og subakutt tyroiditt medfører frigjøring av ferdig dannet tyroxin i sirkulasjonen (1). Man bruker også begrepet destruksjonstyroiditt om disse tilstandene som ikke innebærer øket produksjon av skjoldbruskkjertelhormon. Stille tyroiditt kan opptre postpartum og under behandling med litium, interferoner og tyrosinkinaseinhibitorer (2,3). En stille destruktiv tyroiditt forekommer hos så mange som 5% –10% av de som behandles med amiodarone. Subakutt tyroiditt er preget av feber og smerter i skjoldbruskkjertelen (1). Det er antatt at subakutt tyroiditt er forårsaket av en virusinfeksjon.
Eksakt diagnose er viktig for å kunne velge riktig behandling. Ved autonome adenomer og multinodulært toksisk knutestruma er radiojodbehandling foretrukket terapi hos de fleste, mens noen med fordel kan behandles kirurgisk (1). Destruksjonstyroiditter og andre tilstander med lavt opptak på scintigrafi representerer en heterogen gruppe som skal ha annen behandling.
Scintigrafi er foretrukket billedmodalitet for videre diagnostikk av TRAS-negativ hypertyreose da undersøkelsen både gir informasjon om anatomiske forhold og funksjon (1, 4) (Figur 1). Traceren som brukes, 99mTc-pertechnetat er et monovalent anion som blir tatt opp i tyroidea ved samme mekanisme som jodid, men i motsetning til jodid lekker pertechnetat ut igjen (4). Konsentrasjonen vil etter en initial økning ligge seg på et platå 10 – 30 min. etter injeksjonen, for så å falle (4). 20 minutter etter injeksjon tas de første bildene med gammakamera. Skrå eller sideprojeksjon kan være nødvendig for anatomisk avklaring, da 99mTc-pertechnetat konsentreres i spyttkjertler. Opptak av pertechnetat og størrelsen på tyroidea bestemmes automatisert av tilpasset programvare. Gjennomsnittlig kjertelvekt hos normale voksne er ca. 15 gram med øvre normalgrense på 25 gram (feilmarginen ligger rundt +/- 5 gram).
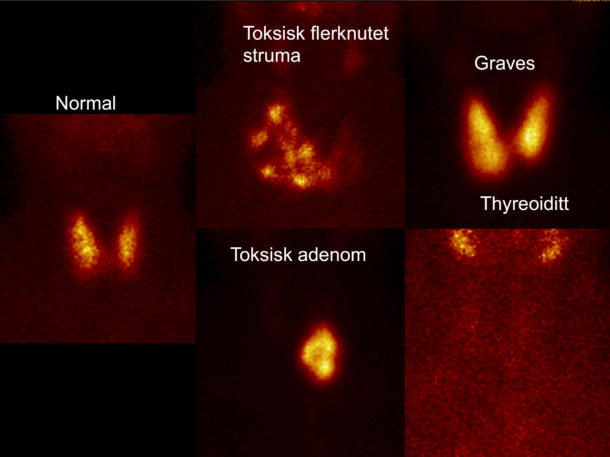
Figur 1: Typiske scintigrafiske funn ved normal tyreoideafunksjon og ulike former for hypertyreose
Før henvisning til scintigrafi bør det være klarert at pasienten ikke ha fått jodholdig røntgenkontrast siste to (tre) måneder, da undersøkelsen da kan være vanskelig å tolke. Tyroxin bør ha vært seponert i fire uker før og trijodtyronin i en uke før undersøkelsen. Karbimazole og andre tyrostatika trenger ikke å seponeres.
Strålebelastningen utgjøre en effektiv dose på 2,3 mSv/180 MBq. Strålingen vi blir utsatt for i løpet av et år i Norge ligger på rundt 3,2 mSv, en mammografi 0,5 mSv. Tykktarm og skjoldbruskkjertel får høyest ekvivalent dose. Pumpet melk kan benyttes etter 48 timers oppbevaring i fryser. Barnet skal ikke ammes de første 24 timene etter mor har vært til scintigrafi. Tyroideascintigrafi er kontraindisert ved graviditet.
Selv om strålebelastningen i praksis sjelden utgjør noen risiko, har det i noen miljøer utviklet seg en tradisjon for å henvise til ultralyd ved påvist tyroideafunksjonsforstyrrelser. Ultralyd ansees imidlertid ikke som noe godt alternativ til scintigrafi på grunn av en rekke begrensninger. De fleste med TRAS-negativ hypertyreose har toksiske adenomer eller destruksjonstyroiditt. Ultralyd har liten verdi, da man ikke kan konkludere angående funksjonen til kjertelen eller eventuelle påviste knuter. Den inflammasjonen man kan identifisere ved ultralyd gir kun en helt begrenset tilleggsinformasjon i forhold til anamnese, klinisk undersøkelse og laboratoriefunn (1). De ikke-palpable knutene som avdekkes ved ultralyd har liten klinisk betydning. Prevalensen av palpable thyroideaknuter i den voksne befolkning er 5–10 % (1,5). Prevalens av tyroideaknuter ved ultralydundersøkelse av halsen, eller ved autopsi, er så høy som 40 til 50 % hos voksne (5). Tyroideacarcinomer er sjeldne i forhold til forekomst av knute i skjoldbruskkjertelen. I 2015 var insidensraten 10 per 100.000 kvinner og 3,9 per 100.000 menn (www.kreftregisteret.no). Leveutsiktene etter behandling for tyroideacarcinom er generelt gode. I 2015 levde 5.421 personer i Norge som tidligere har vært behandlet for tyroideacarcinom, derav ca. 3.000 som har levd mer enn 10 år etter at diagnosen ble stilt (5). 10-års-overlevelsen etter differensiert tyroideacarcinom er 85-90 %. Overdiagnostisering av tyroideacarcinom som følge av lett tilgang til ultralydundersøkelser diskuteres både nasjonalt og internasjonalt (6). Nasjonalt handlingsprogram med retningslinjer for utredning, behandling og oppfølgning av kreft i skjoldbruskkjertelen anbefaler generelt ikke videre utredning av en eller flere små tyroideaknuter (≤10 mm) påvist tilfeldig ved annen undersøkelse (ultralyd, CT eller MR). Dersom det er indikasjon for operasjon ved hypertyreose kan preoperativt ultralyd være aktuelt; ved intrathorakalt struma benyttes CT for å kartlegge de anatomiske forholdene. Ved behov for jodholdig kontrast må pasienten følges tett i etterkant med tanke på utvikling av tyroideasykdommen (7). En eventuell planlagt scintigrafi bør gjøres før undersøkelse som krever jodholdig kontrast.
Norsk endokrinologisk forening (NEF) støtter opp under den internasjonale Gjør kloke valg-kampanjen som i Norge er initiert av Den norske legeforening. Hensikten er å redusere overbehandling og overdiagnostikk i helsevesenet. Mange undersøkelser og behandlinger er ikke bare unødvendige, men kan også være skadelige for pasientene. Vi også tatt initiativ til anbefalingen «Unngå rutinemessig ultralyd av tyroidea hos pasienter med patologiske tyroidea-funksjons tester og normale palpasjonsfunn», som nå er til gjennomgang hos tilgrensende fagområder. Vi har prioritert denne anbefalingen, da vi ser at unødvendig bruk av ultralyd medfører mye engstelse hos pasienter og unødvendig ressursbruk i helsevesenet. Anbefalingene tar utgangspunkt i at tilfeldige oppdagede knuter i tyroidea er veldig vanlig. Ultralyd vil ofte identifisere knuter som ikke er relatert til tyroideafunksjoneen. NEF har også samarbeidet med Norsk gynekologisk forening og Norsk forening for medisinsk biokjemi om flere av deres anbefalinger.
Ved hypertyreose og positiv TRAS er ultralyd og scintigrafi ikke indisert. Ved TRAS-negativ hypertyreose er scintigrafi et nyttig verktøy for å finne årsak og rett behandling.
1 Ross D.S. et al.,2016 American Thyroid Association Guidelines for Diagnoses and Management og Hyperthyroidism and other causes of Thyrotoxicosis. Thyroid. American Thyroid Association. DOI: 10.1089/ thy.2016.0229
2 Roti E, Minelli R, Giuberti T, Marchelli S, Schianchi C, Gardini E, Salvi M, Fiaccadori F, Ugolotti G, Neri TM, Braverman LE 1996 Multiple changes in thyroid function in patients with chronic active HCV hepatitis treated with recombinant interferon-alpha. Am J Med 101:482–487.
3 Illouz F, Braun D, Briet C, Schweizer U, Rodien P 2014 Endocrine side-effects of anti-cancer drugs: thyroid effects of tyrosine kinase inhibitors. Eur J Endocrinol 171: R91–9.
4 Rootwelt K. Nukleærmedisin, 2. utgave. Oslo: Gyldendal Akademisk 2005; 225 s. ISBN 82-05-31118-8.
5 https://www.helsedirektoratet.no/retningslinjer/thyroideakreft-skjoldbruskkjertelkreft-handlingsprogram/
6 Lee SY, Rhee CM, Leung AM, Braverman LE, Brent GA, Pearce EN. A review: Radiographic iodinated contrast media-induced thyroid dysfunction. J Clin Endocrinol Metab. 2015 Feb;100(2):376-83. doi: 10.1210/jc.2014-3292. Epub 2014 Nov 6. PMID: 25375985; PMCID: PMC4318903.
7 Roman BR, Morris LG, Davies L. The thyroid cancer epidemic, 2017 perspective. Curr Opin Endocrinol Diabetes Obes. 2017 Oct;24(5):. doi: 10.1097/ PMID: 28692457; PMCID: PMC5864110.