Åse Bjorvatn Sævik, lege, Ph.d.-stipendiat; 1,2,3 Eystein Sverre Husebye, professor, overlege; 1,2,3 Marianne Øksnes overlege, førsteamanuensis. 1 Klinisk institutt 2 og 2 K.G. Jebsen-senter for autoimmune sykdommer, Universitetet i Bergen, Seksjon for hormonsjukdommar, 3Medisinsk klinikk, Haukeland Universitetssjukehus.
Autoimmun Addisons sykdom er en alvorlig hormonsykdom. Vi undersøkte grad av restproduksjon av binyrebarkhormon ved sykdommen. Restproduksjon kan påvirke prognose og behandlingsmuligheter.
Primær binyrebarksvikt (Addisons sykdom) er en sjelden, men potensielt livstruende hormonsykdom, noe vanligere hos kvinner enn hos menn (60/40)1. I vår del av verden er autoimmunitet den vanligste årsaken, og 86 % av norske Addison-pasienter er positive for 21-hydroksylase autoantistoff 1,2. Sykdommen utvikler seg gradvis, og etter hvert som den immunmedierte destruksjonen progredierer, tapes stadig mer av binyrebarkens hormonproduserende celler (figur 1). Når om lag 90 % av det funksjonelle vevet er destruert, utvikler pasienten symptomer og tegn relatert til mangel på kortisol og aldosteron3. Klinikken er gjerne uspesifikk med uttalt slapphet, vekttap, svimmelhet/ortostatisme, kvalme og oppkast, men lavt blodtrykk, salthunger og hyperpigmentering – spesielt i bøyefurer og på slimhinner gir viktige hint om diagnosen. Mistanken kan som regel enkelt bekreftes ved måling av (lav) kortisol og (høy) ACTH i en blodprøve tatt om morgenen4. Dersom blodprøvesvarene er tvetydige kan en stimuleringstest med 250 μg synacthen (syntetisk ACTH-peptid) i.v. avklare diagnosen. En mangelfull respons, definert som serum kortisol under 485 nmol/L etter 60 minutter, tyder på binyrebarksvikt5.
Pasienter med Addisons sykdom trenger daglig erstatning av binyrebarkhormonene kortisol (et glukokortikoid) og aldosteron4 (et mineralkortikoid). I Norge brukes vanligvis 25 mg cortisonacetat (Cortison®), gjerne fordelt på 2-3 doser, hvor mesteparten tas tidlig på dagen for å erstatte kortisol. Noen pasienter har bedre effekt av hydrokortison med forsinket frigjøring i form av Plenadren ®. I tillegg gis fludrokortison (Florinef ®), oftest gis 0,1 mg (0,05-0,2 mg) om morgenen, for å erstatte aldosteron. For å unngå potensielt dødelige binyrekriser er det viktig å øke kortisondosen ved interkurrent sykdom eller annen større påkjenning4. Videre må pasientene utrustes med Solu-Cortef (kortisol) og gis trening i hvordan sette injeksjonen selv4. Pasientene utstyres også med et diagnosekort til bruk ved akutt sykdom, og diagnosen skal registreres i pasientens kjernejournal.
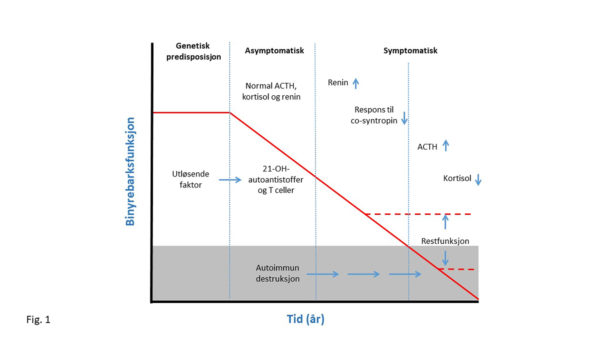
Figur 1. Den naturlige utviklingen av autoimmun Addisons sykdom. Genetisk disposisjon: Ingen sykdom. Asymptomatisk fase: Begynnende tap av funksjonelt binyrebarkvev, men fremdeles bevart produksjon av binyrebarkhormon. Mulig å detektere antistoff mot 21-hydroksylase (21-OH-autoantistoff). Symptomatisk fase: Sykdommen manifesterer seg biokjemisk, først med økt renin og mangelfull respons på synacthen-test, deretter med økt adrenokortikotropt hormon (ACTH) og kortisol i morgenprøve. Det skraverte området markerer antatt resterende binyrebarkfunksjon når sykdommen manifesterer seg klinisk.
Den hormonerstattende behandlingen bedrer symptomene og redder liv, men hindrer ikke sykdommen i å progrediere. Den rådende oppfatningen er derfor at pasienten før eller siden mister all egenproduksjon av binyrebarkhormon. Vi og flere andre hadde imidlertid funnet individer med noe restproduksjon selv etter mange års sykdom6-9 (Figur 1). Spørsmålet er likevel hvor utbredt fenomenet var og om det har klinisk betydning.
På jakt etter svar tok vi initiativ til en klinisk multisenterstudie for å kartlegge forekomsten av bevart restproduksjon ved autoimmun Addisons sykdom. Videre ønsket vi å undersøke om pasienter med restproduksjon skiller seg fra dem uten når det gjelder livskvalitet, arbeidsevne, medikamentbehov og forekomst av binyrekriser.
Vi inviterte pasienter med autoimmun Addisons sykdom ved 17 sykehus i Norge, Sverige og Tyskland. Vi sikret autoimmun etiologi ved kun å inkludere pasienter positive for 21-hydroksylase autoantistoff og med fast bruk av hormonerstattende behandling med glukokortikoid og mineralkortikoid. Pasienter som brukte Plenadren byttet over til Cortison eller hydrokortison minst 1 uke før prøvetagningen.
Blodprøvene ble tatt kl. 8-9 på morgenen etter minst 18 timer uten Cortison/ hydrokortison og 24 timer uten Florinef og analysert for binyrebarkhormoner, inkludert forløpere og metabolitter, med væskekromatografi tandem-massespektrometri (LC-MS/ MS) analyse.
Per i dag finnes ingen etablert definisjon av restproduksjon ved autoimmun Addisons sykdom. Det finnes heller ingen kjente markører for å skille endogene og eksokogene binyrebarkhormon. Her definerte vi glukokortikoid restproduksjon som kvantifiserbar nivåer av både serum kortisol (>0,914 nmol/L) og forløperen 11-deoksykortisol (> 0,114 nmol/L) målt ved LC-MS/MS10. Mineralkortikoid restproduksjon ble definert som kvantifiserbart serum aldosteron (> 8 pmol/L) i tillegg til forløperen kortikosteron (>0,114 nmol/L).
Pasienter som møtte kriteriene for restproduksjon samt en kontrollgruppe uten restproduksjon ble invitert tilbake til medikamentfastende synacthen-test. Her samlet vi blodprøver for å kartlegge nivåene av binyrebarkhormonene før og 30 og 60 minutter etter intravenøs injeksjon av 250 μg synacthen.
Vi inkluderte 192 pasienter (116 kvinner, 76 menn) mellom 18 og 75 år (gjennomsnitt 48 ± 13 år) og fant glukokortikoid restproduksjon hos 58 av 192 (30,2 %) pasienter (Figur 2 a og b). I alt 26 pasienter (13,5 %) hadde mineralkortikoid restproduksjon (Figur 2 c og d). Kombinert glukokortikoid og mineralkortikoid restproduksjon var til stede hos 24 pasienter (12,5 %).
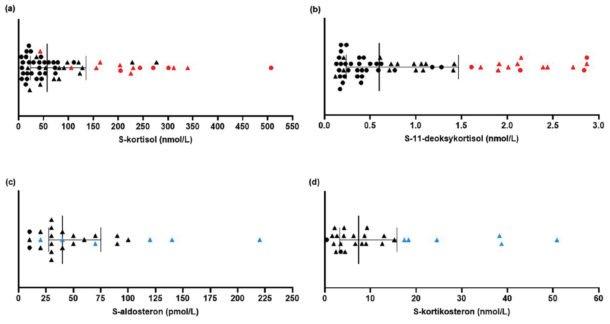
Figur 2. Hormonverdier hos pasienter med restproduksjon av glukokortikoid og/ eller mineralkortikoid. Linjen markerer medianverdien og halene interkvartilbredden (de “midterste 50%”-verdiene). Trekantene markerer pasientene med både glukokortikoid og mineralkortikoid restproduksjon. Pasienter med de 25% høyeste verdiene for forløperhormonene 11-deoksykortisol og kortikosteron er merket hhv. i rødt og blått. a) Serum kortisol (n=58). b) Serum 11-deoksykortisol (n=58). c) Serum aldosteron (n=26). d) Serum kortikosteron (n=26). Fra Sævik et al, JCEM 2020.
Ingen av pasientene med restproduksjon hadde normal respons på synacthen definert som kortisol > 485 nmol/, men mange viste noe stigning. Blant kontrollgruppen uten glukokortikoid restproduksjon forble forløperhormonet 11-deoksykortisol ukvantifiserbar gjennom hele testen.
Glukokortikoid restproduksjon var vanligere blant menn (33 av 76, 43%) enn kvinner (25 av 116, 22%). Videre hadde pasienter med glukokortikoid restproduksjon signifikant kortere sykdomsvarighet (tid fra diagnosetidspunktet) enn pasienter uten restproduksjon (median 6 [0-44] vs. 13 [0-53] år, p<0,001). Kortere sykdomsvarighet var også assosiert med mineralkortikoid restproduksjon (median 5,5 [0,5-26,0] vs. 13 [0-53] år, p<0,004).
Hverken pasienter med glukokortikoid eller mineralkortikoid restproduksjon skilte seg signifikant fra pasienter uten restproduksjon når det gjaldt forekomst av binyrekrise, glukokortikoid substitusjonsdoser, Addison-relaterte symptomer, alder ved diagnosetidspunktet, fysisk helse (BMI, blodtrykk) eller skår på livskvalitetskjemaene AddiQoL og RAND-36.
Vi fant resterende produksjon av glukokortikoid hos nær en tredjedel av pasienter med etablert autoimmun Addisons sykdom. Selv om ingen hadde normal respons på synacthentesten, steg kortisol mer blant pasienter med høyere kortisol og lavere ACTH før testen.
Interessant nok var det klart flere menn blant pasientene med restproduksjon. Man kan spekulere i om dette skyldes kjønnsrelaterte forskjeller i immunforsvarets funksjon i tillegg til ulik sårbarhet for autoimmun sykdom generelt11.
I strid med hypotesen vår fant vi ingen statistisk signifikant sammenheng mellom restproduksjon og (lavere) forekomst av binyrekrise, (lavere) medikamentdoser, (færre) Addison- relaterte symptom eller (bedre) helse-relatert livskvalitet. En mulig forklaring er at slike sammenhenger ikke finnes. Samtidig må vi erkjenne at vår definisjon av restproduksjon, som kvantifiserbare verdier av binyrebarkhormon målt ved hjelp av ultrasensitiv LC-MS/MS-teknologi, ikke nødvendigvis representerer klinisk signifikante verdier.
Den høye forekomsten av restproduksjon reiser grunnleggende, men foreløpig ubesvarte spørsmål om den naturlige utviklingen av binyrebarksvikt og mulig(e) kilde(r) til restproduksjon av binyrebarkhormon. Restproduksjon er også beskrevet ved etablert diabetes mellitus type 112. Framtidige studier bør undersøke hvorvidt enkelte pasientgrupper med Addisons sykdom er mer beskyttet mot immun-mediert vevsdestruksjon, om intensiteten i det autoimmune angrepet varierer over tid eller om restproduksjon av binyrebarkhormon kan stamme fra ektopisk binyrebarkvev.
Et annet presserende spørsmål er om bevart restproduksjon kan utnyttes terapeutisk. Selv om vi her ikke kunne påvise klinisk betydning av slik restproduksjon, er det mulig at disse pasientene kan egne seg for såkalt regenerativ behandling. I foreløpige forsøk på å gjenopprette binyrebarkfunksjonen ser det ut til at bevart restproduksjon er en forutsetning for å lykkes. Nylig ble 13 pasienter med nydiagnostisert autoimmun Addisons sykdom behandlet med rituximab og tetracosactid i 12 uker9. Målet var å gjenopprette kortisolproduksjonen, definert som stimulert serum kortisol > 550 nmol/L på synacthen-test. Ingen av studiepasientene nådde behandlingsmålet etter 12 uker. Ved slutten av oppfølgingsperioden på 72 uker var det fire pasienter som utmerket seg med høyere kortisolverdi (> 100 nmol/L). Ved studiestart hadde disse pasientene høyrere stimulert kortisol, men skilte seg ellers ikke klinisk fra de andre studiedeltakerne. Det kan tyde på at noen grad av restproduksjon er en forutsetning for å lykkes med regenerativ behandling.
Vi fant bevart restproduksjon av glukokortikoid hos en tredjedel av pasienter med autoimmun Addisons sykdom. En slik høy forekomst utfordrer den rådende forståelsen at sykdommen fører til fullstendig tap av binyrebarkfunksjon hos alle pasientene. Fremtidige studier er nødvendig for å belyse årsaken til bevart restproduksjon og vurdere mulig klinisk betydning. Vi mener at pasienter med restproduksjon kan være potensielle kandidater for behandling som tar sikte på å gjenvinne binyrebarkfunksjonen.
Studien som mottok støtte fra Norsk Indremedisinsk forening i 2018 og er publisert i Journal of Endocrinology and Metabolism i 202013.