Kim V. Ånonsen, overlege ved Gastromedisinsk avdeling, Oslo universitetssykehus.
Akutt pankreatitt er den tredje vanligste gastroenterologiske innleggelsesårsaken i sykehus. Majoriteten av pasientene får en mild akutt pankreatitt og blir utskrevet etter et kortvarig sykehusopphold. Pasientene som utvikler alvorlig, nekrotiserende pankreatitt, risikerer et langtrukket og komplisert sykehusopphold. For noen av pasientene er akutt pankreatitt starten på en kronisk pankreatitt.
Insidensen av kronisk pankreatitt er anslått til ca. 30/100 000 og er trolig økende. Etter GIblødning og gallesteinssykdom er det den tredje hyppigste årsaken til sykehusinnleggelser. Håndteringen av akutt pankreatitt har gitt bedre prognose de siste tiårene, men slike tall er belemret med usikkerhet. Mortaliteten er i underkant av 2 %, men varierer betydelig avhengig av alvorlighetsgraden.
Når akutt pankreatitt er tema, er det viktig med enhetlig terminologi. Begrepene vi vanligvis benytter ved akutt pankreatitt er i dag definert i Atlanta-klassifikasjonen fra 2012. Først og fremst må man være enige når man diagnostiserer akutt pankreatitt (Figur 1). Det er således nok å ha typiske symptomer (epigastralgi med utstråling til rygg) og tilstrekkelig forhøyede pancreasenzymer for å stille diagnosen. I tidlig fase er bildediagnostikk ofte indisert for å avdekke gallesteinsykdom, og da er UL/MRCP foretrukket. I praksis blir nok mange undersøkt med CT i tillegg, i differensialdiagnostisk øyemed, men CT er ikke egnet for alvorlighetsgradering før det har gått omtrent tre døgn; altså tre dager etter symptomdebut og ikke tre dager etter innleggelsen. Men akutt pankreatitt gjør gjerne så vondt at pasientene innlegges tidlig i forløpet.
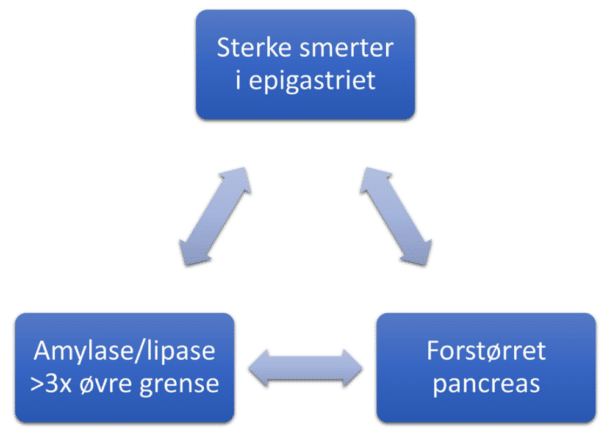
Figur 1. Diagnosen akutt pankreatitt kan stilles på bakgrunn av symptomer, bildediagnostikk og blodprøver. Minst to av tre kriterier må være oppfylt.
Patogenesen ved akutt pankreatitt kan oppsummeres som følger: En utløsende årsak gir intrapankreatisk trypsinogenaktivering. Trypsin aktiverer fordøyelsesenzymer i kjertelen og gir varierende grad av skade på pancreas og omliggende vev. Kaskaden av reaksjoner gir frigjøring av inflammatoriske cytokiner og fordøyelsesenzymer som kan medføre SIRS (Figur 2). Årsakene til akutt pankreatitt er mange, men man har ikke årsaksspesifikk behandling. På den annen side, hvis man kjenner årsaken, kan man forebygge nye episoder.
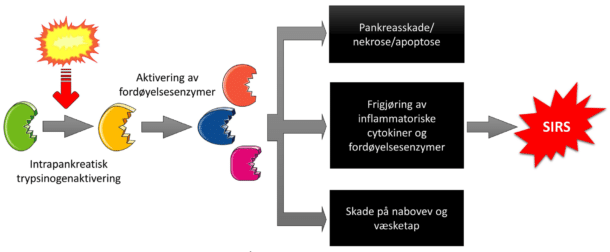
Figur 2. Kaskadereaksjonen ved akutt pankreatitt. Kim V. Ånonsen og Servier Medical Art (Creative Common Attribution 3.0 Generic Licence. http://smart.servier.com).
Den vanligste årsaken til akutt pankreatitt er gallestein, fulgt av alkohol (Figur 3). Andre utløsende årsaker kan være ERCP, hypertriglyseridemi, hyperkalsemi, malignitet, mutasjoner, sirkulasjonsforstyrrelser, virus og medikamenter. Røyking er en stigende stjerne på den etiologiske himmelen.
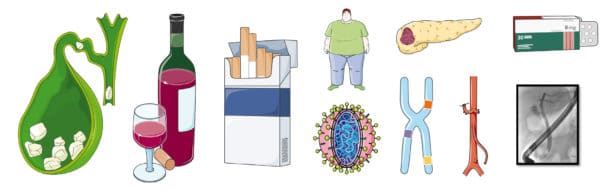
Figur 3. En rekke tilstander kan gi akutt pankreatitt. Kim V. Ånonsen og Servier Medical Art (Creative Common Attribution 3.0 Generic Licence. http://smart.servier.com).
Vi skiller mellom to typer akutt pankreatitt: interstitiell og nekrotiserende (Bilde 1). De fleste akutte pankreatittene er heldigvis interstitielle og milde. Atlantaklassifikasjonen deler komplikasjoner i lokale og systemiske. Både komplikasjoner og organsvikt er definerende for alvorlighetsgraden, og foreligger det noen av disse, er det ikke en mild pankreatitt. Moderat og alvorlig pankreatitt skilles med varigheten av organsvikt (Tabell 1). Organsvikt er definert som modifisert Marshall-skår på 2 eller mer (Tabell 2). Kriteriene for respirasjonssvikt vil være oppfylt hvis PaO2/FiO2 <40, ratioen er omtrent 40 hvis PaO2 er 10 kPa når pasienten får oksygentilførsel på 2 L O2/min. Systemiske komplikasjoner er definert som forverring av komorbiditet som forelå før pankreatitten, eksempelvis KOLS og koronarsykdom.

Tabell 1. Definisjonen på mild, moderat og alvorlig akutt pankreatitt.
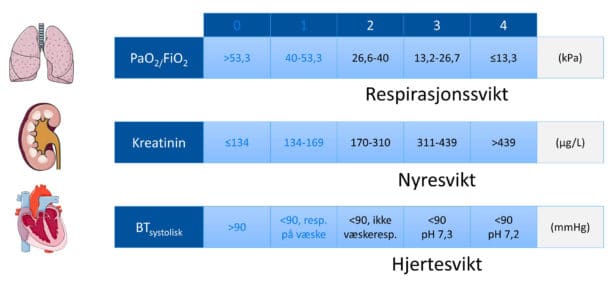
Tabell 2. Marshalls modifiserte skåringssystem for organsvikt. Servier Medical Art (Creative Common Attribution 3.0 Generic Licence. http:// smart.servier.com).
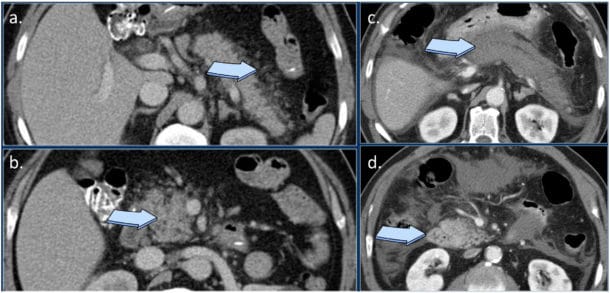
Bilde 1. CT av en interstitiell pankreatitt som viser en forstørret, ødematøs pancreas (b) med peripankreatisk fettvevsreaksjon (a), og en nekrotiserende pankreatitt med ikke-kontrastladende corpus og cauda pancreatis (c), og kontrast både i aorta og et sirkulert caput pancreatis(d). Radiologyassistant.nl.
Pasienter som utvikler nekrotiserende pankreatitt er betydelig mer krevende enn de som får mild pankreatitt. Triage for optimal monitorering og behandling har fått stor oppmerksomhet i pankreatologien, og det er utviklet omfattende skåringssystemer for tidlig prognostisering (f.eks. Acute Physiology and Chronic Health Evaluation II (APACHE II) og Japanese Severity Score (JSS)). Det de har til felles er at de krever svært mange parametre for å gi en ganske upålitelig prognose. Eller som S. S. Vege ved Mayo-klinikken sier: «On day One, they all look the same.»
Noen risikofaktorer for alvorlig pankreatitt er imidlertid allerede kjent når pasientene innlegges, som alder og overvekt. Pasienter med tidlig SIRS vil oftere utvikle en alvorlig pankreatitt, og noe så enkelt som å få en CRP-stigning til >150 innen to døgn, kan predikere nekrotiserende, alvorlig pankreatitt.
Alvorlig pankreatitt medfører et betydelig tap av væske fra sirkulasjonen, både til interstitiet og spesielt som tredjeromsvæske (ascites/pleuravæske). Identifikasjon og kompensasjon av væsketapet er det viktigste tidlige tiltaket ved akutt pankreatitt. Vår evne til å kompensere intravaskulært væsketap kan måles med f.eks. hematokrit og karbamid, og det foreligger god dokumentasjon på at utilstrekkelig substitusjon gir et mer alvorlig forløp og dårligere prognose.
Identifikasjon og kompensasjon av væsketapet er det viktigste tidlige tiltaket ved akutt pankreatitt.
Det finnes intet spesifikt farmakologisk virkestoff som hjelper mot akutt pankreatitt. Retningslinjer foreskriver imidlertid rask og liberal væskebehandling. Retningslinjene fra IAP/APA (International Association of Pancreatology/American Pancreatic Association) anbefaler målrettet væsketerapi med en infusjonshastighet på 5-10 mL/ kg/t, og behandlingsmålene er bl.a. hjertefrekvens <120/min, MAP 65-85 mmHg, diurese >0,5 mL/kg/t og hematokrit 35-44 %. Ringeracetat er anbefalt væskeløsning. Det er nærmest ironisk at mange pasienter møter dehydrerte til ERCP, delvis grunnet kravet om faste før undersøkelsen. Vi gir derfor rikelig intravenøs væske både før, under og etter prosedyren som post-ERCPpankreatitt- profylakse. Dessuten har vi de siste årene gitt diklofenak 100 mg supp. til de fleste ERCPpasientene.
Akutt pankreatitt er ikke en bakterieinfeksjon, og profylaktisk antibiotika er frarådet fordi det bare er forbundet med ugunstige effekter. Bakterier og sopp kan gi alvorlige komplikasjoner i sen fase (dvs. 1 – 3 uker etter symptomdebut), og da stiller det seg annerledes.
Enteral ernæring står sentralt i behandlingsretningslinjene. I motsetning til tidligere praksis, står pasientene fritt til å spise om de ønsker og klarer – uavhengig av om pancreasenzymene fortsatt er forhøyet. Smerter, kvalme/oppkast og gastrointestinal obstruksjon er begrensende faktorer som regelmessig medfører sondeernæring eller total parenteral ernæring (TPN), men en tredjedel av pasientene med nekrotiserende pankreatitt klarer å spise allerede den første dagen. TPN gir økt mortalitet, og det samme er tilfelle for probiotika. Oppsummert kan man si at tarmen trenger næring, men ikke bakterietilskudd.
Noen behandlingsråd er årsaksspesifikke. Timing og indikasjon for ERCP ved gallesteinsutløst pankreatitt har vært ivrig debattert. Vi vet godt at gallesteiner i ductus choledochus som generell hovedregel, bør fjernes, men det er ingen hasteprosedyre. Gallesteinspankreatitt komplisert av kolangitt, derimot, bør behandles innen 72 timer, og mye tyder på at <24 timer kan være enda litt bedre, altså ERCP samme dag, eller påfølgende dag dersom pasienten legges inn om natten. Selv ved obstruerende konkrement og ikterus, men uten kolangitt, er det ingen hast.
Pasienter med mild akutt gallesteinspankreatitt bør få fjernet galleblæren før utreise. PONCHOstudien fra 2015 dokumenterer at reinnleggelsesraten for gallesteinsrelaterte komplikasjoner, ofte en ny pankreatitt, er signifikant økt hvis pasientene utskrives med sin steinfylte galleblære. Det er ikke sikkert at den neste pankreatitten er mild.
Pasienter med mild akutt gallesteinspankreatitt bør få fjernet galleblæren før utreise
Hos pasientene med alvorlig pankreatitt observerer man at sykdommen har to faser. De to fasene bidrar til hver sin halvpart av mortaliteten, som er på ca. 10 %. Mortaliteten i den første fasen er typisk en følge av SIRS og organsvikt. I den andre fasen overtar sepsis med komplikasjoner og blødninger. Alle sykdomsforløp er forskjellige, men overgangen mellom tidlig og sen fase ligger 1-3 uker ut i forløpet.
Tilsvarende er de lokale komplikasjonene delt i tidlige og sene. Forløpet av en interstitiell pankreatitt kan kompliseres av akutte peripanTabell kreatiske væskeansamlinger. Disse resorberes som regel, men hvis de organiseres til hulrom med en falsk vegg, kalles de pseudocyster. Pseudocyster er relativt uvanlige. Nekrotisk pankreatitt kan i tidlig fase kompliseres av akutt nekrotisk ansamling og senere organiseres til en innkapslet nekrose («walled-off necrosis»; WON). Dagligtalen i klinikken er ikke alltid helt stringent, og det er ikke umulig at også undertegnede feilaktig har omtalt en WON med det langt mer bekvemme begrepet ‘pseudocyste’ – også etter at Atlanta-klassifikasjonen ble publisert i 2013. Modningen til pseudocyste eller WON tar vanligvis minst 4 uker, og det har betydning for tidspunktet for en eventuell intervensjon.
Vi anslår at omtrent 60 % av nekrosene resorberes spontant, og at omtrent 70 % forblir sterile. Indikasjon for intervensjon utløses oftest av en infeksjon, men hvis en steril nekrose blir stor og gir gastrointestinal obstruksjon, kan det være aktuelt med drenasje. Omtrent 30 % av nekrosene blir imidlertid infisert, og dette er den viktigste enkeltårsaken til mortaliteten ved akutt nekrotisk pankreatitt. Den kliniske utfordringen er å avdekke infeksjonsdebut hos en allerede alvorlig syk pasient. Som forventet, er klinisk forverring, økt leukocyttall, feber, bakteriemi og en vedvarende, utilpass pasient blant observasjonene som støtter infeksjonsmistanken. Blant 20-40 % av de infiserte nekrosene ser man gassbobler, noe som anses patognomonisk for infeksjon. Prøvetaking fra nekroser er ikke indisert på grunn av risiko for falsk negativ prøve og forsinket behandling, samt grunnet risikoen for å kontaminere en steril nekrose.
Behandlingen kan oppsummeres kort: Antibiotika først. Vent på WON.
Noen ganger er antibiotika alene nok, men ofte er drenasje nødvendig. Hvis man skal drenere, er det langt færre komplikasjoner forbundet med å drenere en moden nekrose. Så, hvordan skal man drenere? For det første: For alle praktiske formål: Åpen kirurgi med nekrosektomi, er utdatert. Husets vin bør være minimalt invasiv: perkutan eller endoskopisk (Bilde 2), eventuelt som en kombinasjon med kirurgi (hybridløsninger). Man foretrekker å anlegge perkutan tilgang retroperitonealt, det vil si foran nyre og bak colon. Kanalen kan utvides slik at man eventuelt kan gjøre nekrosektomi med stivt skop (videoassisted retroperitoneal debridement; VARD). Endoskopisk drenasje gjøres EUS-veiledet med anleggelse av enten dobbel grisehale-stenter eller metallstenter (lumen-apposing metal stent; LAMS).
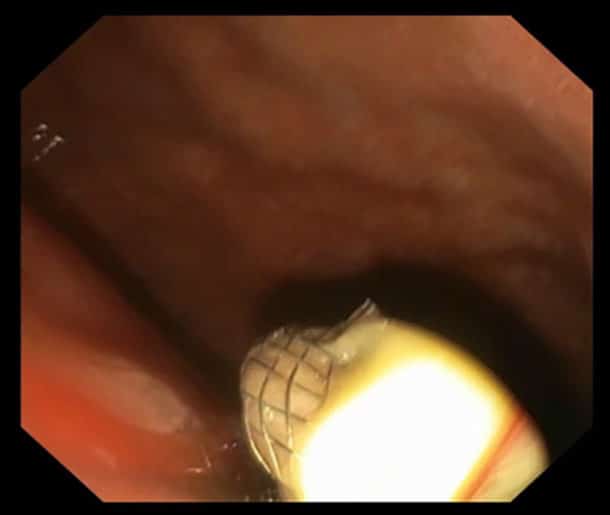
Bilde 2. Endoskopisk bilde fra magesekken som nettopp har fått lagt en LAMS (lumen-apposing metal stent) for å drenere en infisert, innkapslet nekrose (walled-off necrosis). Det tømte seg betydelige mengder illeluktende puss. Kim V. Ånonsen, Oslo universitetssykehus.
Tilnærmingen er trinnvis (step-up) der man starter enkelt og avanserer til mer kompliserte teknikker ved behov. I PANTER-studien forble enkel, perkutan drenasje tilstrekkelig behandling hos 35 % av pasientene. En utfordring med perkutan tilgang er fistler. I TENSION-studien sammenlignet man step-up med endoskopisk eller perkutan tilgang først, og pancreasfistelraten var henholdsvis 5 % og 32 % (p=0,0011). Dessuten ble pasientene som ble behandlet perkutant, værende nesten dobbelt så mange dager på sykehus i løpet av halvåret etter intervensjonen (65 mot 35 dager, p=0,014).
Akutt pankreatitt er forbundet med en rekke vaskulære komplikasjoner, som arterielle pseudoaneurysmer og venøs tromboembolisk sykdom. Intern fistulering og fistulering til hud forekommer, og hos noen pasienter er pankreatitten og dens komplikasjoner så plasskrevende at de utvikler abdominalt kompartmentsyndrom.
Hos pasienter som har en alkoholutløst akutt pankreatitt, er effekten av rusbehandling, under sykehusoppholdet og med oppfølging etter utskrivelse, blant annet dokumentert i en finsk studie. Røykestopp har ikke dokumentert effekt, men her mangler man data. Hvis man ikke finner en årsak til pankreatitten hos en pasient eldre enn ca. 50 år, bør man vurdere CT etter 2-3 måneder med tanke på malignitet. Blant yngre pasienter kan det foreligge en genetisk mutasjon. Hereditær pankreatitt forårsaket av PRSS1-mutasjon vil ofte være påvist før voksen alder. PRSS1 er en autosomal dominant mutasjon i serinprotease 1-genet som koder trypsin 1. Mutasjonen gir intrapankreatisk enzymaktivering. Penetransen er 80-90 %. SPINK1- og CFTR-mutasjoner m.fl. bidrar med en «sårbarhet» for pankreatitt av andre årsaker og kan oppfattes som mediatorer for betennelsen. SPINK1-genet koder serinproteaseinhibitor Kazal type 1, som er en trypsinhemmer. CFTR-mutasjoner kan gi cystisk fibrose. Det er mindre kjent at homoog heterozygositet for kombinasjoner av de over mer enn 2000 påviste CFTR-mutasjonene, kan gi akutt og kronisk pankreatitt som en del av fenotypen. Selv om genfeilen ikke kan repareres, er vår erfaring at kunnskapen om mutasjonen er til god støtte når pasienten skal motiveres for en livsstilsendring for å unngå nye pankreatitter.
En annen utfordring er at akutt pankreatitt kan skyldes gallestein selv om man ikke har påvist konkrementer verken ved transabdominal ultralyd eller MR. Selv om disse er gode verktøy i gallesteinsdiagnostikken, kan steinene være så små at sensitiviteten allikevel er utilstrekkelig. Vi bruker av og til endoskopisk ultralyd for å påvise microlithiasis (Bilde 3) i oppfølgingen av idiopatiske akutte pankreatitter. Behandlingen er ERCP med papillotomi og steinekstraksjon, gjerne i samme seanse.
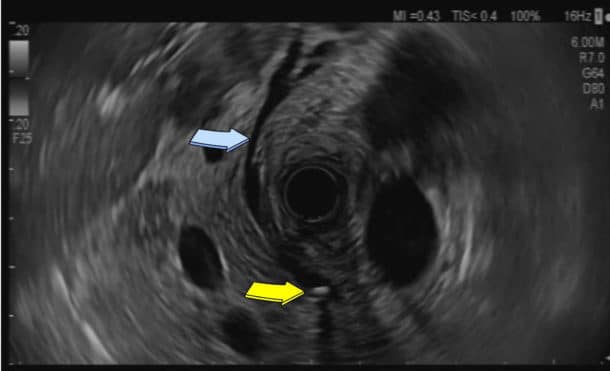
Bilde 3. Endoskopisk ultralyd med radialt skop som viser ductus choledochus (blå pil) og et papillenært, skyggegivende konkrement (gul pil). Kim V. Ånonsen, Oslo universitetssykehus.
Hva med risikoen for kronisk pankreatitt? Epidemiologiske data tyder på at risikoen for å utvikle kronisk pankreatitt på sikt, etter én omgang med akutt pankreatitt, er ca. 10 %, men ved gjentatte episoder øker den til drøyt 30 %. I tillegg utvikler en rekke pasienter eksokrin og endokrin insuffisiens. Eksokrin svikt er relativt enkelt å håndtere, så lenge man oppdager den og gir høye nok enzymsubstitusjonsdoser. Den pankreatogene diabetes mellitus (type 3c) er mer utfordrende å behandle.
De fleste akutte pankreatittene er milde. For å redusere sykdommens morbiditet og mortalitet må man identifisere og optimalisere behandlingen av de pasientene som utvikler alvorlig, nekrotiserende pankreatitt. Utfordringen ligger i at tidlig prognostisering er upresis. Tidlig og liberal væskebehandling er helt avgjørende for pasienten – uansett årsak og antatt alvorlighetsgrad. Enteral ernæring er gunstig. Profylaktisk antibiotika anbefales ikke. Pasienter med mild akutt gallesteinspankreatitt, bør kolecystektomeres under oppholdet. Intervensjon for lokale komplikasjoner bør gjøres step-up, og hvis man har ekspertisen tilgjengelig i eget sykehus, bør den starte med endoskopi. God oppfølging kan forebygge langtidskomplikasjoner. Behandlingen av akutt pankreatitt er i høyeste grad multidisiplinær.
Grafikk og bilder: Kim V. Ånonsen, Servier Medical Art (Creative Common Attribution 3.0 Generic Licence. http://smart.servier.com/) og Radiologyassistant.nl.
Akutt pankreatitt er ikke en bakterieinfeksjon, og profylaktisk antibiotika er frarådet fordi det bare er forbundet med ugunstige effekter.