Vikas K. Sarna, lege PhD, gastromedisinsk avdeling, OUS, Ullevål
Truls Hauge, seksjonsoverlege dr.med., gastromedisinsk avdeling, OUS, Ullevål
Barretts øsofagus er en premalign tilstand knyttet til refluks. Diagnosen stilles ved gastroskopi og pasienten bør deretter følges endoskopisk for å kunne fange opp og behandle dysplasi og kreft i tidlig stadium. Dette for å kunne unngå videre utvikling av kreft med operasjon og onkologisk behandling. Et nylig utarbeidet nasjonalt handlingsprogram skisserer klare og proaktive anbefalinger for oppfølging og behandling.
Barretts øsofagus (BØ) er en premalign tilstand med en årlig risiko på omlag 0,5% for å utvikle seg til adenokarsinom i spiserøret.1 Tall fra Kreftregisteret viser at adenokarsinom utgjør omtrent 80% av de omlag 400 årlige tilfellene med kreft i spiserør i Norge og at forekomsten av adenokarsinom er økende hos menn.2 Alvorligheten av diagnosen understrekes av at kun 1 av 4 med påvist spiserørskreft lever etter 5 år.2 De fleste, om ikke alle adenokarsinomer i spiserøret, vil utvikle seg fra BØ.3 Prevalensen av BØ (> 2 cm utbredelse) ble angitt til 1,6 % i en svensk studie der 1000 tilfeldig utvalgte ble gastroskopert.4 Gastroøsofagal reflukssykdom har blitt vist å være en klar risikofaktor for BØ (6 – 8 ganger øket risiko i kasus-kontrollstudier) og antas å være sentral i patofysiologien,5 men reflukssymptom i seg selv er en dårlig prediktor for BØ med positiv prediktiv verdi på kun 2,3% i den nevnte svenske studien. Andre risikofaktorer er røyking, overvekt, mannlig kjønn og alder. Øsofago- gastroskopi er den eneste måten for påvisning og oppfølging av BØ. Den siste utgaven (2020) av nasjonalt handlingsprogram for spiserørskreft som er å finne på helsedirektoratets nettsider skisserer et standardisert opplegg for overvåking av dysplasi og neoplasi ved påvist BØ, med dertil egnede behandlingsstrategier.6
Barretts øsofagus er oppkalt etter den australske legen Norman Barrett (1903-79) som interesserte seg for tilstanden med funn av sylinderepitel i nedre del av spiserøret. Slimhinnen i gastrointestinaltraktus, også
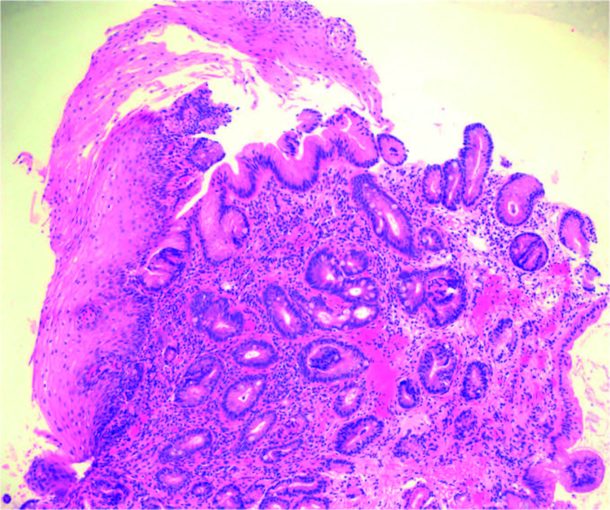
kalt mukosa, består av lagene; epitel, lamina propria og muskularis mukosa. Slimhinnen i spiserøret er normalt kledd av plateepitel, mens den lenger distalt i gastrointestinal- traktus er kledd av sylinderepitel. BØ er et uttrykk for metaplasi, som betyr at slimhinnen regenererer til en annen type slimhinne enn den opprinnelige, altså fra plateepitel til sylinderepitel (figur 1). Det man tror setter i gang denne endringen er en reflukbetinget slimhinneskade. Forandringene ses karakteristisk i spiserørets nedre
del. Metaplasien kan enten være av gastrisk type sylinderepitel med parietalceller, eller intestinal type med begerceller. BØ betegner den intestinale metaplasien som er den type metaplasi som anses å være utsatt for malign transformasjon (neoplasi). Dette skjer som følge av en sekvens med mutasjoner som over tid kan føre til dysplasi, gjennomvekst og spredning.
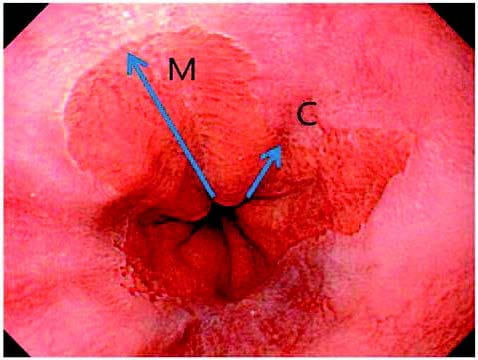
Endoskopisk gjenkjennes forandrin- gene enkelt, siden sylinderepitel har en mer rosa-rød farge sammenliknet med hvitlig plateepitel (figur 2). Sees sylinderepitel i øsofagus, det vil si proksimalt for der ventrikke- foldene starter, kalles det BØ; gitt at utbredelsen er på minst 1 cm i spiserørets lengde og biopsi bekrefter intestinal metaplasi. En endoskopibeskrivelse bør angi utbredelsen av de sammenhengende sirkumferensielle forandringene fra øvre ventrikkelfold, samt den maksimale utbredelsen inkludert eventuelle ikke-sirkumferensielle utløpere. Dette er den såkalte Praha-klassifikasjonen (figur 2), der eksempelvis forandringer på 4 cm i sirkumferens med et tillegg av en utløper på 2 cm vil bli angitt som C4M6, der C angir sirkumferens og M angir maksimum. Slimhinne inspiseres deretter nøye etter fokale lesjoner. Slike lesjoner kommer tydeligere frem ved applikasjon av 2% mateddik på slimhinnen og/ eller ved bruk av innebygde lysfilter- funksjoner i gastroskopet (“Narrow Band Imaging”), slik at man da kan gjøre en fokusert biopsering.
I tillegg til en fokusert biopsering av suspekt lesjon i utbredelsen av BØ, gjøres kvadrantbiopsier hver andre centimeter. Oppdages ingen dysplasi planlegges kontrollundersøkelsen med utgangspunkt i utbredelsen av BØ:
1 – 3 cm kontrolleres etter fem år
3 – 10 cm kontrolleres etter tre år
> 10 cm kontrolleres ved regions- avdeling.
Ved påvist ekte dysplasi i BØ er det indikasjon for behandling. Dysplasi betegner neoplastiske forandringer i epitel uten gjennombrudd av basalmembranen og karakteriseres som lavgradig og høygradig.7 I en nederlandsk studie så man en progresjon fra lavgradig dysplasi (til høygradig dysplasi eller tidlig adenokarsinom) hos omlag 20% over en 2-års periode.8 Samme studie viste en viss interrater-variabilitet i bedømmelsen av lavgradig dysplasi siden man da er ute etter beskjedne forandringer som kan være vanskelig å skille fra betennelse, men en gjen-» «tatt biopsi som bekreftet funnet, økte risiko for progresjon med en faktor på nesten 10. Ved lavgradig dysplasi anbefales derfor ny gastroskopi med prøvetaking etter 6 måneder under behandling med protonpumpe- hemmer. Gjentas funnet, anbefales behandling om dette kan bekreftes av referansepatolog. Behandlingen er primært endoskopisk. Også pasienter med adenokarsinom begrenset til mukosa (stadium T1a, jfr. TNM-klassifikasjonen), skal tilbys endoskopisk behandling.
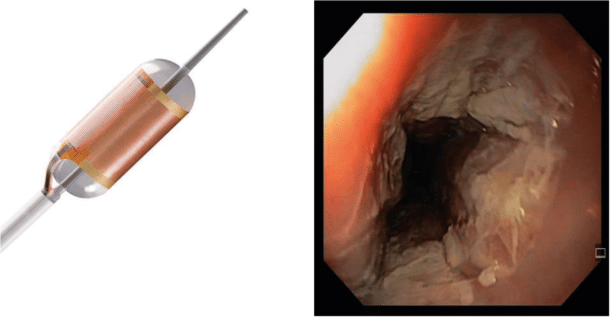
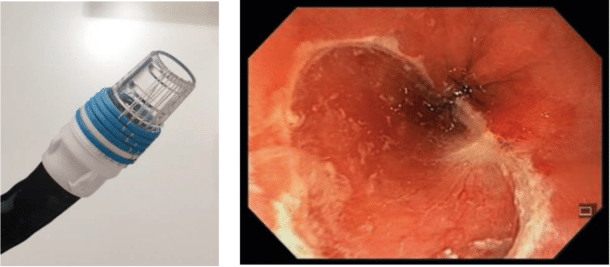
Endoskopisk behandling inkluderer reseksjon og varmebehandling (radiofrekvensablasjon forkortet RFA figur 3). Ved endoskopisk mukosal reseksjon (EMR – figur 4), som er den mest brukte teknikken, brukes et varicestrikkesystem der slimhinnen man ønsker å fjerne suges inn i en» «hette som er satt på gastroskopet. Det lages således en kunstig polypp som så kan slyngereseseres. Etter eventuell lokal reseksjon behandles hele Barretts-området med RFA for å fjerne Barretts-slimhinnen. Dette kan gjøres med en sirkulær probe (figur 3) som blåses opp med en ballong
slik at den dekker godt rundt hele omkretsen av spiserøret, og deretter gjennomføres varmebehandlingen i hele utbredelsen av forandringene. Det må ofte gjennomføres flere behandlinger før BØ blir fullstendig borte. For å forsikre seg om at behandlingen er vellykket gjennom- føres endoskopiske kontroller hver 3. måned det første året, deretter årlig
inntil 5 år.
Fra og med adenokarsinom stadium T1b anbefales primært operasjon, eventuelt med neoadjuvant kjemoterapi. Ved utbredt sykdom, der operativ behandling ikke er aktuelt, tilbys onkologisk behandling, eventuelt også stent i øsofagus.
Alle pasienter med BØ anbefales livs- lang behandling med protonpumpe- hemmere for å forhindre ytterligere syrebetinget skade av slimhinnen og redusere risiko for malign trans-» «formasjon.9, 10 Reflukskirurgi hos pasienter med gastroøsofagal refluks og BØ har ikke vist seg å være overlegen medisinsk behandling på forekomst av adenokarsinom.11
Sist, men ikke minst, bør livsstilstiltak som vektreduksjon og røykestopp
foreslås til de pasientene som kan ha nytte av det.
Barretts øsofagus er en refluks- relatert intestinal metaplasi som utgår fra nedre del av spiserøret. Det er en premalign tilstand som bør behandles med protonpumpehemmere og overvåkes med jevnlige endoskopiske kontroller for tegn på dysplasi. Ved påvist dysplasi eller kreft i tidlig stadium (T1a), anbefales endoskopisk behandling med reseksjon av fokale forandringer kombinert med radiofrekvens- ablasjon av resterende forandringer. Ved å diagnostisere BØ med dysplasi og tilby endoskopisk behandling og oppfølging, vil en videre utvikling av sykdom som krever operativ og/eller onkologisk behandling ofte kunne unngås.