Karin Persson, PhD, LIS i indremedisin og geriatri OUS. Postdoc ved Nasjonal kompetansetjeneste for aldring og helse SiV, og geriatrisk avdeling OUS
Helt ferske forekomsttall viser at drøyt 100.000 personer lever med demens i Norge. Ikke alle har fått en spesifikk diagnose. Det finnes foreløpig ingen kurativ behandling for noen former for demens, men en korrekt etiologisk diagnose er viktig for å kunne gi pasienter og pårørende god informasjon, symptomatisk behandling og oppfølging. MR og CT er viktige verktøy i utredningen for å komme nærmere en etiologisk diagnose, men fremdeles beskrives mange bilder som «alderstilsvarende normal» hvis ikke vi stiller de riktige spørsmålene i henvisningen.
Med et økende antall eldre vil forekomsten av demens øke raskt i hele verden (1). Helt ferske forekomsttall fra 2020 viser at det i dag finnes 101 000 personer med demens i Norge, et antall som vil fordobles de neste 30 årene (2). Demens er en funksjonsdiagnose og sier ingenting om hvilken hjerneorganisk sykdom som ligger til grunn. Alzheimers sykdom (AD) er den klart vanligste årsaken i alle aldersgrupper. Det finnes ingen kurativ behandling. Behandlingen som gis er symptomatisk, men det finnes økende evidens for at livsstilsintervensjoner midt i livet kan forsinke debut av demens (3). For å kunne gi god symptomatisk behandling er det viktig å stille en korrekt etiologisk diagnose. Til dette er anamnese fra pasient og pårørende, somatisk undersøkelse og kognitive tester avgjørende. I tillegg brukes forskjellige supplerende undersøkelser for å støtte den kliniske vurderingen, primært strukturell avbildning av hjernen med CT eller MR. I mer avansert utredning gjøres også andre undersøkelser som spinalvæskeundersøkelse og andre bildeundersøkelser som f. eks FDG-PET. Tidligere ble MR og CT hovedsakelig anvendt for å utelukke andre sykdommer i hjernen som f. eks normaltrykkshydrocephalus, blødning, tumor og hjerneinfarkt som årsak til demenssymptomene. I dag fokuseres det mer på å beskrive strukturelle endringer i ulike områder i hjernen som er typiske for de ulike demenssykdommene. Disse endringene inngår nå også i forskningsmessige diagnostiske kriterier. I 2017 kom Helsedirektoratets nasjonal faglig retningslinje for demens (4). Her anbefales CT eller MR av hjernen også i den kliniske utredningen av demens, ikke kun for å utelukke annen sykdom.
Alle som henvises for utredning av kognitiv svikt bør få gjennomført en CT eller MR som ledd i utredningen. Men også for pasienter innlagt i en indremedisinsk avdeling kan det være aktuelt å henvise til en kartleggende undersøkelse med spørsmål om forandringer forenlig med demensutvikling, eller å be om revurdering av allerede gjennomførte undersøkelser med fokus på forandringer som ved demenssykdom. Det bør da gjøres en vurdering av både nevrodegenerative og cerebrovaskulære forandringer, men også potensielt reversible tilstander som subdurale hematomer, tumores og normaltrykkshydrocephalus, som kan behandles, er relevante differensialdiagnoser når en pasient utvikler symptomer på kognitiv svikt av akutt, subakutt eller kronisk natur. Jo mer nøyaktig vi spør radiologen om ulike patologiske endringer, desto bedre undersøkelse og svar får vi. Ved henvisning bør man derfor være nøye med å spesifisere at undersøkelsen blir gjort med tanke på kognitiv svikt/demens slik at de riktige projeksjonene og sekvensene ved bilderegistrering blir tatt. Ofte er bildene allerede tatt når spørsmålet om kognitiv svikt/demens reises. Den radiologiske besvarelsen kan da være gjort på bakgrunn av spørsmål om f. eks akutt cerebral iskemi. I slike tilfeller kan det ofte lønne seg å kontakte nevroradiologen og be om en ny vurdering med fokus på nevrodegenerative og cerebrovaskulære forandringer.
Basert på et nordisk samarbeide ble det i 2013 publisert en artikkel i svenske Läkartidningen med formål å harmonisere den radiologiske vurderingen av hjerneforandringer ved de vanligste demenssykdommene. Artikkelen ble videreutviklet til ytterligere en nyttig artikkel publisert i 2017 med nøyaktige beskrivelser av hvordan CT og MR bilder bør vurderes ved mistanke om demens (5, 6). Her anbefales det at demensutredninger bør inneholde en strukturert rapport basert på CT eller MR hvor følgende validerte visuelle skalaer skal brukes (Figur 1-3).: – Scheltens skala for vurdering av medial temporallappsatrofi (MTA), som er en skala gradert fra 0-4 og hvor økende verdi betyr mer atrofi (7) – Skala for vurdering av frontal global kortikal atrofi (GCA-f), som er en skala gradert fra 0-3 og hvor økende verdi betyr mer atrofi (8) – Skala for vurdering av posterior global kortikal atrofi som er en skala gradert fra 0-3 og hvor økende verdi betyr mer atrofi (Koedam skala) (9) – Skala for vurdering av hvitsubstans hyperintensiteter som er en skala gradert fra 0-3 og hvor økende verdi betyr mer uttalte hvitsubstansforandringer (Fazekas skala) (10)
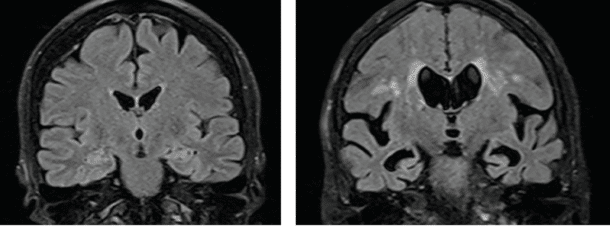
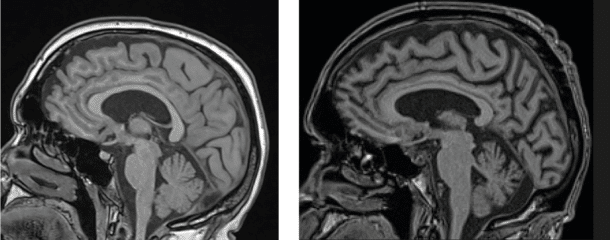
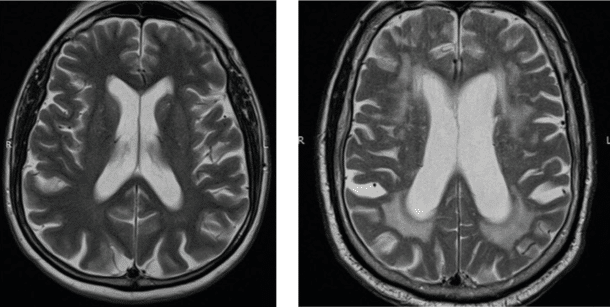
I tillegg til vurderingen av atrofi og hvitsubstansforandringer bør ventriklenes størrelse vurderes, strategiske infarkter beskrives om det foreligger noen, og man bør se etter subkortikale og kortikale mikroblødninger ved SWI sekvens (susceptibilitetsvektet bildedannelse) hvis mulig. I tillegg bør radiologen se etter romoppfyllende prosesser som blødninger eller tumores. Ved kontraindikasjon mot eller begrenset tilgang på MR, er det også mulig å bruke CT. De strukturelle skalaene kan brukes ved begge modaliteter, så lenge det finnes sekvenser i alle tre plan (sagitalt, aksialt og koronalt). Da MR har flere sekvenser og bedre oppløsning, gir den mulighet for en mer detaljert vurdering av subkortikale hvitsubstansforandringer og vurdering av for eksempel subkortikale og kortikale mikroblødninger. MR er totalt sett å foretrekke framfor CT hvis mulig.
Ved manglende spørsmål i henvisningen om forandringer forenlig med kognitiv svikt eller demens vil radiologen mange ganger ikke vektlegge beskrivelse av atrofi og hvitsubtansforandringer, og svaret kan bli nokså uspesifikt. Det er i slike tilfeller spesielt nyttig å be radiologen bruke visuelle skalaer for å gradere forandringene. Når dette er gjort, er det nyttig å vite hva som egentlig er «normalt», selv om dette ikke er en absolutt sannhet. Hjernen endrer seg med alderen, og det er gjort flere studier hvor man har kommet frem til grenseverdier for hva som anses som normalt for forskjellige aldersgrupper, se tabell 1.
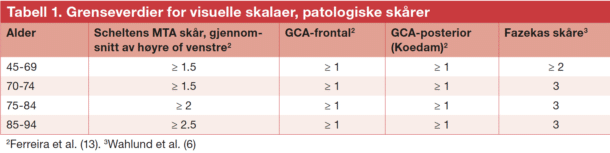
Graden av atrofi og hvitsubstansforandringer må altså ses i relasjon til pasientens alder og symptomer. Mange ganger vil det være naturlig å henvise pasienten for en grundigere vurdering av kognitive symptomer basert på en nøyaktig anamnese med pasient og pårørende, kognitive tester og ytterligere undersøkelser enten i regi av primærhelsetjenesten eller ved en poliklinikk som utreder pasienter med kognitiv svikt, for eksempel en geriatrisk, nevrologisk eller alderspsykiatrisk poliklinikk, eller en hukommelsesklinikk.
Ved Alzheimers sykdom (AD) starter hjerneforandringene oftest i den mediale temporallappen, og etter hvert vil en se atrofi på CT eller MR, spesielt atrofi av hippocampus. Når sykdommen progredierer ses etter hvert også forandringer frontalt og parietalt. Det er også påvist atypiske varianter av AD hvor de nevrodegenerative forandringer ikke fremkommer primært i den mediale temporallappen (11), men frontalt og/eller parietalt. Ved demens med Lewylegemer (DLB) finnes forandringene primært i basale ganglier og parieto-occipitalt med mer bevarte temporallapper, mens det ved frontotemporal demens tilkommer forandringer primært frontalt og i fremre temporallapper. Ved vaskulær demens er vaskulære forandringer det mest fremtredende, men blandingstilstander med AD er ikke uvanlig, spesielt hos de over 80 år.
Det er som nevnt viktig å være klar over at atrofiske forandringer ikke må være til stede og at de kan være tilstede uten at det foreligger demenssykdom. Har man eldre bilder å sammenligne med kan dette hjelpe i å vurdere om atrofiutviklingen har vært raskere enn det som er å forvente ved aldring (normalt rundt 1 % årlig) (12). I tillegg til alder som en potensiell årsak til falsk positive funn har man de siste årene også blitt bevisst på at det finnes subtyper av AD som ikke er kjennetegnet av atrofi i den mediale temporallappen, eller hvor atrofien er mer uttalt i andre hjerneområder. Dette kan lede til falsk negative funn. Det er også vist at utdannelsesnivå kan ha en konfunderende effekt, i det at personer med lavere utdanning kan ha symptomer forenlig med demens, til tross for at det ikke er synlig atrofi ved billedundersøkelse av hjernen. Man ser her for seg at personer med lavere utdanning har mindre kognitiv reserve, noe som kan bety at hjernen tåler mindre nevrodegenerative endringer før symptomer oppstår (11). Av disse grunner kan strukturell avbildning av hjernen ikke gi et 100% nøyaktig svar, men skal alltid ses i sammenheng med kliniske opplysninger og symptomer.
Strukturell avbildning av hjernen ble tidligere kun brukt for å utelukke andre tilstander enn de typiske demenssykdommene ved utredning av kognitiv svikt. MR og CT anbefales nå også brukt for å se etter forandringer som støtter en klinisk mistanke om en spesifikk demenssykdom. Bruk av validerte visuelle skalaer er nyttig for å på en konkret og systematisk måte vurdere CT og MR bilder, og det finnes grenseverdier som tar høyde for pasientens alder i vurderingen av hva som er «normalt» og «patologisk». Å be om en konkret vurdering av nevrodegenerative og cerebrovaskulære forandringer med «demensprotokoll» er viktig ved ny henvisning av pasienter, og ved revurdering av allerede utførte billedundersøkelse.