Høyt differensierte nevroendokrine svulster (neoplasmer) er den krefttypen som har størst økning i insidens. De flest subspesialiteter innen indremedisin vil komme i kontakt med pasienter med krefttypen. Forløpet av sykdommen varierer svært fra pasient til pasient, og håndteringen av den enkelte er svært individuell.
Espen Thiis-Evensen, overlege dr.med., Senter for nevroendokrine svulster, Avdeling for transplantasjonsmedisin, Kreft, kirurgi og transplantasjonsklinikken. OUS Rikshospitalet.
Nevroendokrine neoplasmer (NEN) er samlebetegnelsen på høyt differensierte nevroendokrine svulster (NET) og lavt differensierte nevroendokrine karsinomer (NEC) som oppstår fra hormonproduserende celler eller forstadier til disse. De kan oppstå i alle kroppens organer. NET oppstår oftest i gastrointestinaltraktus og lunger, NEC oftest i lunger, dernest gastrointetinaltraktus.
Malignitetspotensialet varier fra tilnærmet benigne svulster med så vidt målbar vekst over ti-år til hurtigvoksende karsinomer hvor pasienten har en forventet overlevelse på få måneder. De høyest differensierte neoplasmene kan, men pleier ikke, produsere symptomgivende hormoner. Behandlingen er som for annen kreft. Kun kirurgi kan kurere. For de høyest differensierte neoplasmene brukes oftest molekylært rettede og nukleærmedisinske behandlinger, sjelden kjemoterapi.
Over de siste 30 år har forekomsten av de høyt differensierte svulstene økt cirka 300 %, mens forekomsten av de lavt differensierte karsinomene er ganske uendret. I perioden 2015-2019 var insidensen i Norge for de høyt differensierte svulstene 9.9/100.000 per år, det samme som for de lavt differensierte karsinomene. NET er vanligst i tynntarm (21 %), lunge (18 %), bukspyttkjertel (12 %), appendix (12 %), tykktarm (6 %), endetarm (7 %) og magesekk (4 %) men kan også oppstå i thymus, binyre, testikkel, eggstokk, bryst, skjoldbruskkjertel og en sjelden gang i andre organer (Kreftregisteret). Nevroendokrine karsinomer (NEC) utgår oftest fra lunge (90%) eller gastrointestinaltraktus.
I 2019 ble det registrert ca. 1100 nevroendokrine neoplasmer i Norge, like mange høyt som lavt differensierte, så vidt noen flere tilfeller hos kvinner enn menn. Hos pasienter med høyt differensiert svulster påvises det ved diagnosetidspunktet fjernmetastaser hos 42 % og lokale metastaser hos 18 % (1). De tilsvarende tallene for dem med lavt differensierte karsinomer er 62.4 % og 23.3 %.
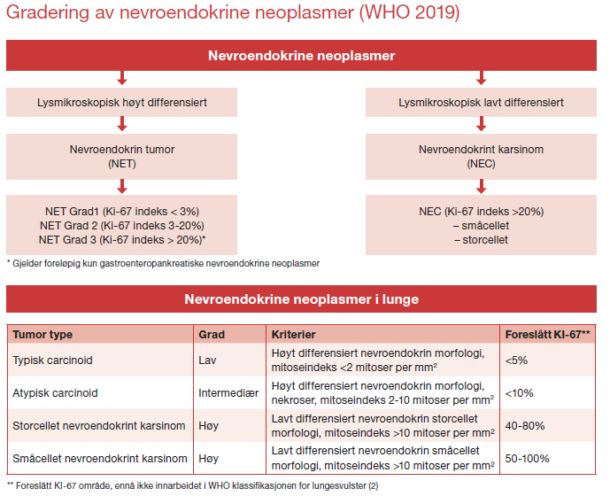
Eksakt klassifikasjon er helt avgjørende for valg av behandling. Terminologien har endret seg de siste år. Tidligere ble neoplasmene kalt «carcinoider». Dette brukes fremdeles om høyt differensierte svulster utgått fra lungene og appendix, ellers ikke. Basert på WHO klassifiseringen av 2019 inndeles de nevroendokrine neoplasmene etter differensieringsgrad og hvor mange av kreftcellene som er i delingsfase (proliferasjonsindeks) (2). Ved immunhistokjemisk metode farges cellene som er i delingsfase og patologen angir prosentvis andel av kreftceller i delingsfase. Dette uttrykkes som Ki-67%, dvs. en Ki-67 på 13% betyr at 13% av kreftcellene er i delingsfase. Høyt differensierte neoplasmer kalles nevroendokrine svulster og graderes etter KI-67%, lavt differensierte neoplasmer kalles nevroendokrine karsinomer (NEC) (figur 1). Som grunnlag for graderingen av svulster utgått fra lunge og thymus har man tradisjonelt brukt mitoseindeks; antall mitoser pr. 10 synsfelt med 40x forstørrelse (10 HPF, tilsvarer 2 mm²). Grensene blir tilnærmet lik grensene for Ki-67%. Det anbefales at også Ki-67 angis for nevroendokrine neoplasmer med andre utgangspunkter enn de gastroenteropancreatiske, dette er foreløpig ikke innarbeidet i WHO klassifiseringen.
Det er ingen symptomer som er patognomoniske for pasienter med nevroendokrin kreft. Symptomene fra nevroendokrine neoplasmer avhenger av hvor svulsten(-e) er lokalisert og hvorvidt de produserer symptomgivende hormoner. De vanligste symptomene er smerter fra området svulsten(-e) sitter, vekttap og slapphet. Symptomer ved lungesvulster er som for andre lungesvulster. Ca. 20% av pasientene med høyt og middels differensierte svulster (NET grad 1-3) har symptomer fra hormoner produsert av sin kreft (tabell 1). Disse hormonsymptomene er uspesifikke og finnes ofte også hos pasienter uten nevroendokrine svulster. Hormonsymptomer ser man oftest hos pasienter med metastaser fra NET utgått fra tynntarm/colon ascendens/cøkum i form av diaré og flushing. Flushing arter seg som episodevis rødme, vanligst i ansikt/ overkropp, meget sjelden med samtidig varmefølelse og svette, så godt som aldri med samtidig hjertebank. Fenomenet sees hos tynntarms-NET pasienter (en sjelden gang ved lungecarcinoider) som har spredning (det vil si levermetastaser, thorakale metastaser, skjelettmetastaser eller glandler på bakre bukvegg) som skiller ut hormoner som passerer utenom leveren der disse hormonene ellers brytes ned i en uttalt første-passasje effekt. Hormoner utskilt fra svulster i tynntarm, kan indusere fibrose på de høyresidige hjerteklaffene og på sikt gi hjertesvikt (carcinoid hjertesykdom). Karsinomene produserer uhyre sjelden hormoner.

Symptomene hos NET-pasienter er som regel ukarakteristiske og kan utvikle seg over år og påkaller ofte lite entusiasme hos helsevesenet for grundig utredning. Å skille en pasient med tynntarms-NET med metastaser med kun lette symptomer, som litt magesmerter til og fra og moderat diare, fra alle pasientene med irritabel tarm er opplagt en utfordring. Det er ikke uvanlig at pasienter med NET har massivt med tumorvev på diagnosetidspunktet, gjerne med forbausende få symptomer. Et økende antall NET-pasienter får påvist sin nevroendokrine kreft tilfeldig, ofte ved lite indiserte radiologiske undersøkelser for andre helseplager.
Laboratorieprøver: Tumormarkøren chromogranin A (CgA), et glykoprotein utskilt fra endokrint aktive celler og påvisbart i serum er forhøyet hos mer enn 70% av NET-pasientene, sjelden hos NECpasienter. Spesifisiteten er imidlertid svært lav. CgA er forhøyet ved bruk av protonpumpehemmer, atrofisk gastritt og redusert nyrefunksjon, men også ved en rekke andre «benigne» lidelser som leversvikt, hjertesvikt, inflammatorisk tarmsykdom foruten andre krefttyper som prostatatkreft, brystkreft og leverkreft. Sannsynligheten for at man skal påvise en forhøyet CgA-verdi hos en pasient er følgelig høy, helt uavhengig av om pasienten har nevroendokrin kreft eller ikke. Konklusjon og vennlig råd: Aldri, aldri mål CgA dersom du ikke sterkt mistenker at pasienten kan ha en NET. Du risikerer å påvise forhøyet CgA hos en pasient uten nevreondokrin kreft som du da uansett må utrede, kanskje nærmest i det uendelige.
Spesifikke hormonanalyser (urin-5HIAA, gastrin, glukagon, insulin/c-peptid, vasointestinalt polypeptid (VIP) m.fl.) kan gjøres dersom pasienten har symptomer som gir mistanke om spesifikk hormonproduksjon.
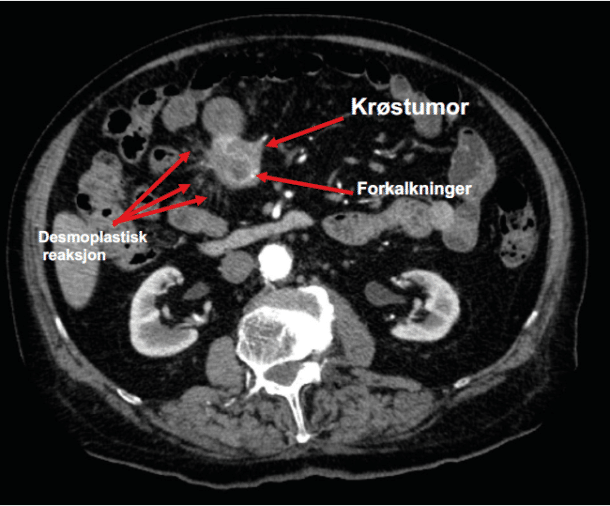
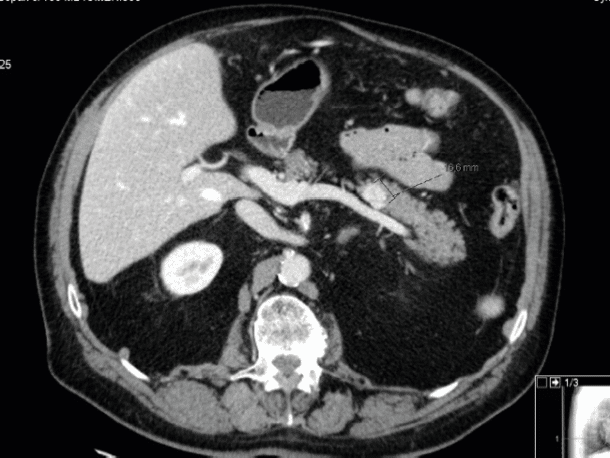
Bildediagnostikk: Ved mistanke om NET bør det gjøres CT-undersøkelser med arteriell og portovenøs fase. Svulstene er ofte kun synlige i arteriell fase. CT undersøkelser gjort med bred snittføring, lite kontrast og kun portovenøs fase, kan være tilnærmet bortkastet og har forsinket diagnosen hos en rekke pasienter. MR gir bedre oversikt over lever enn CT, men ofte dårligere visualisering av ekstrahepatiske neoplasmer. Nevroendokrine svulster, som svulster fra en rekke andre kreftformer, er oftest hypervaskulære. En hypervaskulær krøstumor med forkalkninger gir sterk mistanke om at det foreligger en nevroendokrin tynntarmstumor (figur 2). Videre er hypervaskulære velavgrensede pankreassvulster ofte nevroendokrine (figur 3). Ellers er det radiologiske utseende lite spesifikt for nevroendokrine svulster.
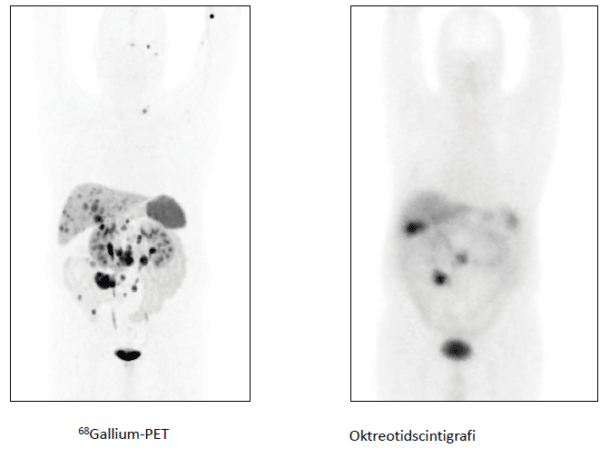
Over 80% av NET har somatostatinreseptorer og er påvisbare på nukleærmedisinske somatostatinreseptor avbildninger. Tidligere ble hovedsakelig oktreotid- og tektrotydscintigrafi brukt. Disse metodene avløses nå av 68Gallium-DOTATATEPET/ CT som per i dag er den mest sensitive bildeundersøkelsesmetoden for NET og kan påvise svulster på mindre enn 0.5 cm (figur 4). En rekke andre krefttyper, og inflammasjon, kan også være positive på 68Gallium-PET. NEC har sjelden disse reseptorene og påvises sjelden på 68Gallium-DOTATATE-PET/CT. 18FFDG- PET er meget sensitiv for NEC, men lite sensitiv for NET som har en lav glukosemetabolisme.
Endoskopier, inkludert endoskopisk ultralyd med vevsprøver har sin plass ved mistanke om utgangspunkt i gastrointestinaltraktus, pancreas og lunge.
Histopatologi: Endelig diagnose baserer seg på histopatologiske undersøkelser hvor de immunhistokjemiske markørene cromograning og synaptofysin påvises. Nøyaktig Ki-67%, og ved lunge og thymus neoplasmer også antall mitoser /10 HPF, skal nøyaktig angis i patologirapporten.
Nevroendokrine neoplasmer er en heterogen gruppe hvor pasientens prognose varierer fra svært dårlig til meget god, avhengig av neoplasmens differensieringsgrad og utbredelse på diagnosetidspunktet
Det er få store intervensjonsstudier på nevroendokrine neoplasmer. Mange av behandlingsvalgene er basert på små, heterogene ikkerandomiserter/ kontrollerte studier med uklare effektmål.
Behandling av NET: Kun kirurgi kan kurere pasienter med NET. Det er ofte indikasjon for reseksjon av primærtumor og enkelte metastaser selv om det står igjen tumorvev (debulking). Dette synes å bedre prognosen og redusere morbiditet. Kjemoterapi har liten effekt på de høyest differensierte svulstene som kan ha en Ki-67 på mindre enn 2%. Dersom behandling er indisert er førstevalg ved grad 1 og 2 svulster somatostatinanaloger, med effekt (svulstvekst stoppet eller tumormengde redusert) hos ca. 70 % med median tid til progresjon 12-18 måneder. Tyrosinkinasehemmere (sunitinib) og mTOR-hemmere (everolimus) har vist overbevisende effekt (svulstvekst stoppet eller tumormengde redusert) ved behandling av NET (sunitinib kun vist for NET utgått fra pankreas) hos 60-70 % av pasientene med median tid til progresjon 11 måneder. Kjemoterapi i form av temozolomid+kapecitabin eller streptozotocin+ 5-FU har vist effekt på grad 2 og grad 3 svulster, særlig utgått fra pankreas, med effekt (svulstvekst stoppet eller tumormengde redusert) hos 60-70 % av pasientene, median tid til progresjon er 5-11 måneder.
Den mest lovende behandlingsformen er peptid reseptor radionukleid terapi (PRRT), hvor radiomerkede somatostatinanaloger (177Lutetium-DOTATATE) gis til pasienter med svulster med sterkt opptak på somatostatinreseptor avbildning. Ca. 80% har effekt (svulstvekst stoppet eller tumormengde redusert), median tid til radiologisk påvisbar vekst er 30-40 måneder. Lokal destruksjon i form av leverarterieembolisering eller radiofrekvensablasjon kan hos utvalgte pasienter ha effekt. Ekstern strålebehandling har ofte god symptomatisk effekt ved skjelettmetastaser.
Behandling av NEC: Som ved NET er kirurgi den eneste behandlingen som kan helbrede. Palliativ behandling består av kjemoterapi, tradisjonelt cisplatin/carboplatin+etoposid, samt i utvalgte tilfeller PRRT. Karsinomene progredierer ofte svært raskt slik at det er viktig å komme kjapt i gang med behandling.
Prognosen for pasienter med NEC er dårlig, eksempelvis er median overlevelse for pasienter med NEC utgått fra gastrointestinaltrakus som har fått kjemoterapi 11 måneder. Dersom de ikke har mottatt kjemoterapi er median overlevelsen 3 måneder (3). Grad 1 og grad 2 svulstene vokser langsommere, og leveutsiktene er oftest bedre enn for de fleste andre krefttyper. Det er ikke uvanlig at pasienter med lever- og skjelettmetastaser lever mer enn 10 år etter diagnose. Hos oss er 5 års overlevelse for pasienter med NET utgått fra tynntarm og pankreas uten fjernmetastaser på diagnosetidspunktet henholdsvis 94% og 75%, ved fjernmetastaser 63% og 35% (4,5). Prognosen er såpass god at disse pasientene også kan få andre sykdommer, inkludert andre kreftsykdommer. Det er derfor viktig å vurdere/utrede nyoppståtte symptomer hos gruppen. Det kan faktisk være indikasjon for behandling av andre nyoppståtte lidelser, inkludert kreftsykdommer, selv om disse pasientene allerede har nevroendokrin kreft med spredning.
Nevroendokrine neoplasmer er en heterogen gruppe hvor pasientens prognose varierer fra svært dårlig til meget god, avhengig av neoplasmens differensieringsgrad og utbredelse på diagnosetidspunktet. Enkelte av svulstene kan produsere hormoner som kan dominere symptombildet. Mange med de høyest differensierte svulstene kan ha symptomer i årevis før diagnose. Endelig diagnose, utbredelse og gradering er helt avgjørende for valg av terapi og avhenger av en grundig histopatologisk vurdering med eksakt angivelse av proliferasjonsmarkøren Ki-67%. Kun kirurgi kan kurere, men det finnes en rekke palliative, sannsynlig livsforlengende behandlinger.
Når skal du mistenke at pasienten har en nevroendokrin neoplasme? - Klassisk utseende på radiologiske undersøkelser (se figur 1 og 2). - Hormonsymptomer. - Pasienten har mye tumorvev men lite symptomer. - Pasienten lever lenger enn man ville forvente med sine svulster.
Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av nevroendokrine svulster i fordøyelsessystemet: https://helsedirektoratet.no/retningslinjer/nasjonalthandlingsprogram- med-retningslinjer-for-diagnostikkbehandling- og-oppfolging-av-nevroendokrine-svulster- i-fordoyelsessystemet
Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av lungekreft, mesoteliom og thymom (2020), Helsedirektoratet. https://helsedirektoratet.no/retningslinjer/nasjonalthandlingsprogram- med-retningslinjer-for-diagnostikkbehandling- og-oppfolging-av-lungekreft-mesoteliomog-thymom
Janson ET, Knigge U, Dam G, et al. Nordic guidelines 2021 for diagnosis and treatment of gastroenteropancreatic neuroendocrine neoplasms. Acta Oncol. 2021 Jul;60(7):931-941.