Ny teknologi gjør det mulig å avlese den samtidige dynamiske aktivitet i flere hormonsystemet over ett døgn. Dette har potensiale til å gi sikrere, raskere og enklere diagnostikk av hormonsykdommer. I forskningsprosjektet Ultradian Hormone Diagnostics har en utviklet metodikken og demonstrert at metoden er praktisk gjennomførbar med lovende preliminære kliniske resultater.
Paal Methlie(1), overlege Ph.D.; Marianne Øksnes, overlege førsteammenuensis(1,2); Marianne Grytaas, overlege Ph.D1; Grethe Ueland, overlege Ph.D.; Marianne Astor, overlege og Ph.d. stipendiat(1,2); Kristian Løvås, overlege professor(1,2); Eystein Husebye, overlege professor(1,2). (1) – Haukeland Universitetssykehus, medisinsk klinikk. (2) – Klinisk institutt 2, Universitetet i Bergen
Hvert eneste sekund foregår det et komplekst samspill mellom celler og organer. De snakker sammen gjennom hormonsystemet og nervesystemet, men har du noen ganger undret på hva de snakker om? Meningen med livet, selvfølgelig! Meningen med livet er i strengeste biologiske forstand å 1) forsvare homeostasen og 2) reprodusere seg. Ny teknologi åpner for en helt ny innsikt i denne kommunikasjonen som kan bane vei for bedre diagnostiske metoder og behandling.
Utredning av hormonsykdommer bygger i stor grad på biokjemisk testing. Tradisjonelt gjøres dette ved blod- eller spyttprøver som tas på tilfeldige tidspunkt, eller bestemte tidspunkt i relasjon til forventede biologiske rytmer. Mer sofistikerte dynamiske funksjonstester som suppresjon eller stimulasjonstester brukes også hyppig, og måling av hormoner i døgnurin anvendes til å estimere total hormonproduksjon. Selv om slike tester utvilsomt er nyttige, møter klinikeren på diagnostiske utfordringer hvor dagens testbatteri ikke gir sikker avklaring.
Flere forhold begrenser de tradisjonelle hormonprøvene. En enkelt blod- eller spyttprøve gir kun et øyeblikksbilde uten å fange hormonsvingningene som pågår hele tiden. For eksempel er det vist at kortisolnivået i serum oscillerer med pulser omtrent hvert 90 minutt. Denne hurtigere (ultradiane) rytmen er overlagt kortisols diurnale svingninger (1,2). Hormonnivået i en enkeltprøve reflekter derfor dårlig denne dynamiske hormonaktiviteten. En mangler kunnskap om betydningen, men det er interessant at pasienter med primær binyrebarksvikt (Addisons sykdom) har dårligere livskvalitet til tross for at behandling gjenoppretter diurnal, men ikke ultradian, kortisol rytme.(3)
Et annet moment er at et hormonnivå målt i serum ikke nødvendigvis representerer situasjonen i vevet hvor hormonet utøver sin effekt. For mange hormoner rapporteres total serum hormonkonsentrasjon, som inkluderer både protein-bundet og fritt hormon. Det er imidlertid kun den frie, ikke-proteinbundne fraksjonen en regner som viktig for biologisk effekt. Mengden av og genetiske variasjoner i serum bindeproteiner, for eksempel albumin, pre-albumin, sexhormon- bindende globulin (SHBG), kortisol-bindende globulin (CBG) og tyrosin-bindende globulin (TBG), vil påvirke prøveresultatet uten at det nødvendigvis har betydning for fritt biotilgjengelig nivå i vev. Videre fungerer bindeproteiner ikke bare som passive hormontransportere, men kan styres av lokalt vev til å gjøre en målrettet levering. Det er vist at ved vevsskader og sepsis vil lokale proteaser aktiveres som spesifikt endrer CBG og TBG sin konformasjon slik at kortisol og tyroksin slippes fri og leveres til lokalt vev (4–7).
Blod- og spyttprøver tar heller ikke høyde for at hormoner metaboliseres i målvevet. Et eksempel på dette er at kortisols effekter kan forsterkes ved lokal konvertering av inaktivt kortison til aktivt kortisol ved 11β-Hydroxysteroid dehydrogenase (11βHSD) type 1, og hemmes av 11βHSD type 2 som tilbakedanner kortisol til kortison (8,9). En blodprøve vil således ikke avspeile nøyaktig hvor mye hormon som faktisk når målreseptoren.
Til sist er det neppe ideelt å avlese hormonaktiviteten i et – for pasienten – stressende miljø som på et sykehus eller legekontor. Både lokaler, utstyr og helsepersonell kan tenkes å påvirke pasienten og forstyrre diagnostikken. “Hvit frakk hypertensjon” er et uttrykk for dette (10), og mange indremedisinere vil nok gjenkjenne situasjonen med stadig gjentatte blodprøver grunnet uklare prøvesvar for TSH og metanefriner.
Ultradian Hormone Diagnostics er et prosjekt hvor vi tar sikte på å løse problemene ved tradisjonell biokjemisk diagnostikk. Ideen er å bedre diagnostikk og behandling ved å bruke informasjon samlet ved 24-timers avlesning av den dynamiske aktiviteten i flere hormonnettverk målt i interstitiell vevsvæske. Prøvetakning gjøres ved en portabel sampler som pasienten har på seg i sitt vanlige miljø.
Prosjektet er finansiert gjennom EUs Horizon 2020 forsknings og innovasjonsprogram (grant 633515) og ledet av Professor Eystein Husebye ved Universitet i Bergen. Partnere som deltar er Universitet i Bristol (England), Karolinska Institutet (Sverige), Evangelismos Hospital (Hellas) og de kommersielle aktørene OLINK AB (Sverige) og Designworks (England).
Prosjektet har medført banebrytende nyvinning på flere områder med innovasjon av ny prøvetaknings apparatur, utvikling av nye analysemetoder og applikasjon av maskinlæringsmetoder for tolkning av data.
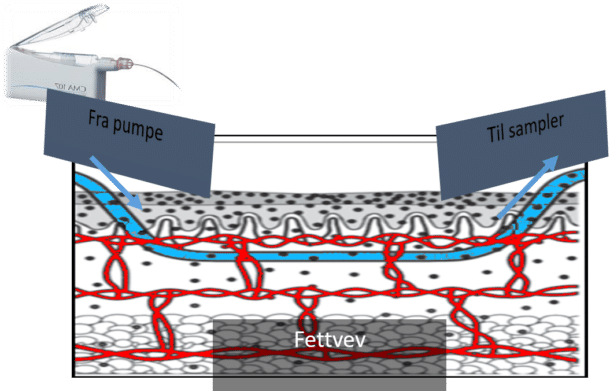


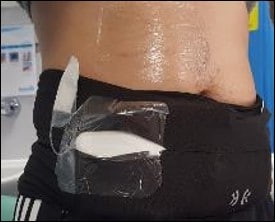
For å kunne måle hormoner gjennom et helt døgn mens pasienten er i sitt vanlige miljø har Ultradian prosjektet utviklet en portabel sampler kalt U-Rhythm (Fig. 1, 2 og 3). Sampleren høster hormoner fra interstitiell vevsvæske i subkutant fettvev, og omgår de omtalte problemene med bindeproteiner. Prinsippet for høsting bygger på mikrodialyse over en semipermeabel membran som fritt slipper igjennom små-molekylære stoffer som steroidhormoner (Fig. 1).
U-Rhythm er endestasjonen for den langsomt strømmende mikrodialysevæsken med hormoner. Apparatet samler prøvene på en spoleslange. Prøvene har et volum på 7-15 μL og er adskilt ved luftbobler som settes inn hvert 20 minutt. I løpet av ett døgn vil U-Rhythm samle 72 prøver, hvilket gir tidsoppløsning til å avdekke den dynamiske hormon aktiviteten. Til forskjell fra enkeltblodprøver oppnår man en hel døgnserie av målinger.
Sampleren er godt egnet til å fange hormoner som binder seg lite til spoleslangen, slik som kortisol, kortison, aldosteron, 18OH-kortisol, 11-deoxykortisol, kortikosteron, tetrahydrokortisol og tetrahydrokortison. Vi har forsøkt å måle androgener, progesteron og proteinhormoner, men disse molekylene binder seg for mye til overflater til at pålitelige resultater kan oppnås. Videreutvikling av sampleren kan trolig løse dette.
Mikrodialysekateter og pumpe er kommersielt tilgjengelig, og også U- Rhythm forventes å bli dette snarlig.


Steroidhormonene i interstitiell vevsvæske er i langt lavere nivå enn i serum. For eksempel er konsentrasjonen av kortisol i vev omtrent 1-5% av nivået i serum, og tilsvarende for aldosteron 30%. Dette skyldes i hovedsak at kun den frie, ikke-proteinbundne hormonfraksjonen i serum kan nå målvevet, men også lokal vevsmetabolisme har betydning. For å kunne bestemme hormonkonsentrasjoner i mikrodialyseprøver med svært små prøvevolum (7-15 μL) var det nødvendig å utvikle nye analysemetoder.
Analysemetodene i Ultradian Hormone Diagnostics baserer seg på liquid chromatography tandem mass spectrometry (LC-MS/MS). Massespektrometri regnes i dag som gullstandarden for måling av steroidhormoner fordi den tilbyr meget høy analytisk spesifisitet og samtidig muliggjør svært høy analytisk sensitivitet (11,12).
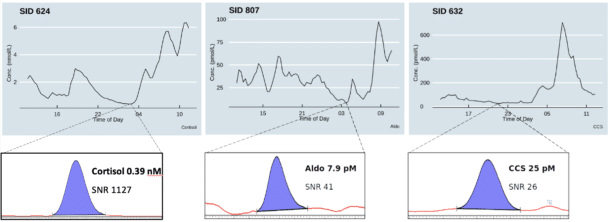
I Ultradian Hormone Diagnostics har en presset grensene for hva som er analytisk mulig med dagens teknologi. Metoden bygger på tidligere publiserte arbeider fra forskningsgruppen (13), men er betydelig videreutviklet og har nådd tredje generasjon. Gjennom siste del av prosjektet har analyseplattformen vært i kontinuerlig drift og analysert over 100 000 prøver (Fig. 4). Analyseplattformen gjør automatisert væske-væske ekstraksjon, invers kromatografisk separasjon på «solid-core» C18 kolonne med liten indre diameter (2.0 mm) og liten partikkelstørrelse (1.6 μM). Totalt kan metoden måle 21 steroidhormoner, men de nevnte begrensingene i U-Rhythm tillater per i dag ikke å høste de mer hydrofobe hormonene. Analysepresisjonen er i området relativt standardavik 3-7 % og nøyaktigheten 90-109 % (alle steroidhormoner). Metoden er ekstremt følsom selv om prøvevolumene er små. Kortisol i mikrodialysevæske kan bestemmes helt ned til 200 pmol/L og aldosteron ned til 2 pmol/L. Analyseplattformen har en kapasitet på 1050 prøver per uke. Fig. 5 viser døgnprofiler og kromatogrammer fra friske kontrollpersoner.
Tradisjonell biokjemisk diagnostikk tar utgangspunkt i grensenivåer som skiller mellom syk og frisk tilstand. Et eksempel er at serum-kortisol målt over 50 nmol/L ved en kort deksametason-test tolkes som positiv test for hyperkortisolisme. En slik tilnærming er mindre egnet for å utnytte den komplekse informasjonen som ligger i døgnprofiler av multiple hormoner.
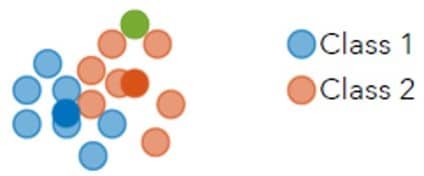
For å tolke de store datasettene en innhenter ved en 24-timers sampling av mange hormoner benytter Ultradian Hormone Diagnostics statistiske metoder basert på maskinlæring. Enkelt sagt innebærer dette en form for kunstig intelligens hvor dataprogrammet skal lære selv, ikke bli fortalt (programmert til) hvordan det skal forstå informasjonen. Prototype-baserte statistiske modeller «trenes» med store datasett hvor en kjenner klassifisering av hver profil som frisk/syk (Fig. 6). Programmet vil identifisere (lærer seg) mønstre som skiller friske fra syke. Nye hormonprofiler kan senere testes mot prototypene for å bestemme mest sannsynlige diagnose.
Utvikling av metodene for datatolkning er et arbeid som pågår fremdeles. For tiden undersøkes både «generalized matrix relevance learning vector quantization» (14), «random forest»(15) og andre.
I Ultradian prosjektet inngår en større multisenter studie. Formålet er å samle inn prøver fra både friske og syke slik at en kan trene de statistiske modellene til å bli nyttige diagnostiske verktøy, og endelig undersøke metodens diagnostiske sensitivitet og spesifisitet. Studiene ser på Cushings syndrom, primær/ sekundær binyrebarksvikt og primær hyperaldosteronisme.
Så langt har over 400 personer fra Norge, Sverige, England og Hellas deltatt i studien. Disse utgjøres av menn og kvinner og har et aldersspenn som dekker den voksne befolkningen. Vi inkluderer fremdeles enkelte pasienter i noen subgrupper, men rekrutteringen er nær avsluttet. Så langt har vi inkludert mer enn 220 friske personer, over 50 personer med hyperkortisolisme (Cushings syndrom), over 40 pasienter med primær hyperaldosteronisme og over 30 pasienter med primær binyrebarksvikt. En del av pasientene har gjennomført målinger flere ganger, og vi har i dag over 700 hormonprofiler i databasen.
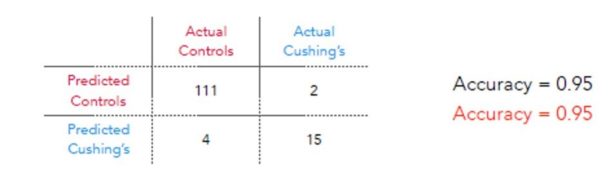
Ultradian Hormone Diagnostics er i en avsluttende fase, men tidlige preliminære data er lovende. Selv med et lite treningsdatasett har Ultradian Hormone Diagnostics en diagnostisk nøyaktighet på 95% for Cushings syndrom (Tabell 1).
Ultradian Hormone Diagnostics har allerede vist at metoden er praktisk gjennomførbar i kliniske studier på et stort antall deltagere i flere land. Resultatene kan gi en unik innsikt i hvordan hormonene er i stadig bevegelse gjennom døgnet samtidig som en unngår begrensinger som ligger i tradisjonell biokjemisk utredning av hormonsykdommer. Dette åpner muligheten for å påvise også subtile forandringer som i dag er vanskelig å avdekke. Håpet er at Ultradian Hormone Diagnostics skal gi sikrere, raskere og enklere diagnostikk av hormonsykdommer.
Prinsippet med avlesning av dynamikken til flere hormoner gjennom et helt døgn gir ett innblikk i biologiske reaksjoner og motreaksjoner som kontinuerlig foregår for å opprettholde homeostasen. En mer integrert forståelse av de hormonelle nettverkene har potensiale også utenfor den klassiske endokrinologen, og kan i fremtiden være nyttig til forskning og behandling av andre tilstander. For eksempel kan en se på sepsis som en tilstand hvor homeostasen er truet og møtes med en eksplosjon av hormoner.
Prosjektet satser på ferdigstilling med publisering av resultater i løpet av 2022, og har også som mål å gjøre Ultradian Hormone Diagnostics tilgjengelig for interesserte i løpet av de neste årene.