Et viktig gjennombrudd innen medikamentell behandling av cøliaki ble sommeren 2021 publisert i New England Journal of Medicine. Det ble der vist at ZED1227, en hemmer av enzymet transglutaminase 2, effektiv forhindret totteforandringer som oppstår når pasienter med behandlet cøliaki spiser gluten i 6 uker. Dette er et viktig skritt på veien mot en «cøliakipille». Tre norske miljøer var sterkt inne i denne fase 2a studien.
Knut E. A. Lundin, KG Jebsen Senter for Cøliakiforskning, Institutt for Klinisk Medisin, Det medisinske fakultet, Universitetet i Oslo og Seksjon for gastromedisin, Avdeling for transplantasjonsmedisin, Oslo Universitetssykehus Rikshospitalet
Siv Kristianne Berg Furholm, Oslo Universitetssykehus
Siv Hauglann Isaksen, Oslo Universitetssykehus
Jørgen Jahnsen, Gastromedisinsk avdeling, Akershus universitetssykehus og Institutt for Klinisk Medisin, Det medisinske fakultet, Universitetet i Oslo
Synnøve Aure, Gastromedisinsk avdeling, Akershus universitetssykehus
Øystein Hovde, Medisinsk avdeling, Sykehuset Innlandet, Gjøvik og Universitetet i Oslo og NTNU
Anja Byfuglien, Medisinsk avdeling, Sykehuset Innlandet, Gjøvik
Cøliaki er en meget vanlig sykdom som rammer minst 1 % og sannsynlig oppunder 2 % av den norske befolkning (1). De aller fleste får diagnosen i voksen alder, selv om det er en del som tyder på sykdommen debuterer før 10-12 års alder. Typiske tegn er jernmangel, følelse av alltid å være trett, metabolsk beinsykdom og «noe med magen», dvs diare, forstoppelse, reflux og/eller rumling. Alvorlige former med uttalt avmagring og mangeltilstander er sjeldnere nå enn før. Diagnosen stilles hos voksne etter klinisk mistanke, påvisning av antistoffer mot enzymet transglutaminase 2 og/eller mot deamiderte gliadin peptider fulgt av gastroskopi med biopsi der man påviser såkalt totteatrofi (klassifisert som Marsh 3). Tvilstilfeller er ikke uvanlig. European Society for study of Coeliac Disease har gjennom UEG utviklet en meget nyttig app som kan anbefales.
I alle tilfeller der cøliaki påvises, skal kliniker anbefale livslang glutenfri kost. Opplæring hos klinisk ernæringsfysiolog anbefales sterkt. Med glutenfri kost menes kost uten hvete, rug og bygg. Den glutenfrie maten skal inneholde maksimalt 20 ppm (parts pr million) gluten, det gir en daglig glutenmengde godt under 50 mg gluten sammenlignet med ca 15- 20 000 mg gluten i et vanlig kosthold. Konsekvent gjennomført er dette god behandling, men mange pasienter oppnår ikke målet med normalisering av tarmslimhinnen. Dette kan skyldes manglende motivasjon eller informasjon, men også at gluten er omtrent «overalt» i vårt samfunn. Behandlingen oppleves som svært krevende og sosialt begrensende, og i spørreundersøkelser sier ca. halvparten av cøliakere at de ønsker en ikke-diett behandling.
Transglutaminase 2 (TG2) er et enzym som har som sin hovedoppgave i tarmveggen å stabilisere matrix ved å kryssbinde peptider. Fravær av TG2 i knockout-mus har imidlertid ikke vist noen skade. TG2 er målet for den såkalte endomysium-testen, en immunfluorescens-undersøkelse på serum (2). I patogenesen ved cøliaki er TG2 viktig siden den gir deamidering av visse glutaminresiduer i gluten peptider, de omdannes da til glutaminsyre (Q til E) (3). Dermed binder peptidene seg mye bedre til HLA-DQ2 og -DQ8, dvs de HLAvariantene som er sterkt assosiert med cøliaki. Dette har vært fokus for mangeårig forskning i forskningsmiljøet i Oslo under ledelse av professor Ludvig M. Sollid (4).
TG2s sentrale rolle i immunpatogenesen for cøliaki gjør at hemming av dette enzymet peker seg ut som et attraktivt angrepspunkt. Hemmeren ZED1227 ble utviklet av firmaet Zedira, og tatt videre til klinisk utprøvning av Dr. Falk Pharma GmbH, begge i Tyskland. ZED1227 er et peptidomimetikum som binder seg irreversibelt til TG2. I fase 1 studie med 106 frivillige ble det ikke sette bivirkninger av daglige doser opp til 500 mg. I fase 2b studien CEC-3 rekrutterte vi vel-behandlete cøliakere gjennom våre poliklinikker og sosiale medier, studien ble gjort i 7 europeiske land og med 20 studiesteder (EudraCT 2017-002241- 30) 5. Fra Norge bidro vi med 48 pasienter til screening og 29 som ble randomisert – det er meget bra! 163 pasienter ble randomisert til enten placebo, 10 mg, 50 mg eller 100 mg ZED1227 tatt som en enkel dose om morgenen i 6 uker. En halv time etter inntak av medikament spiste cøliakerne så en kjeks med 3 g gluten. Det primære endepunktet for studien var attenuering av gluten-induserte totteforandringer i biopsier tatt etter 6 uker. Adekvat histologi forelå hos 144 pasienter og det primære endepunktet ble nådd for alle tre doser av ZED1227. Den høyeste dosen forhindret økning av intraepiteliale lymfocytter (IEL). Symptomer ble scoret ved hjelp av Celiac Symptom Index, denne økte i alle grupper men mindre hos de som fikk aktivt stoff. Et cøliakispesifikt QoL skjema Celiac Disease Questionnaire viste lavere verdi etter 6 uker hos placebogruppen, men høyere i de tre aktive gruppene. Ved uke 6 anga 26 % av deltagerne i placebogruppen at effekten av pillen var dårlig, sammenlignet med 7-10 % i de aktive gruppene. På Rikshospitalet hadde vi en pasient i aktiv gruppe som sluttet før 6 uker på grunn av symptomer, men uten tegn til totteforandringer. Både denne og andre pasienter anga symptomer på gluteneksponering. Andre pasienter rapporterte at de «aldri hadde følt seg bedre». Konklusjonen er at ZED1227 beskytter godt mot gluteninduserte totteforandringer, men i noe mindre grad mot kliniske symptomer på gluteneksponering.
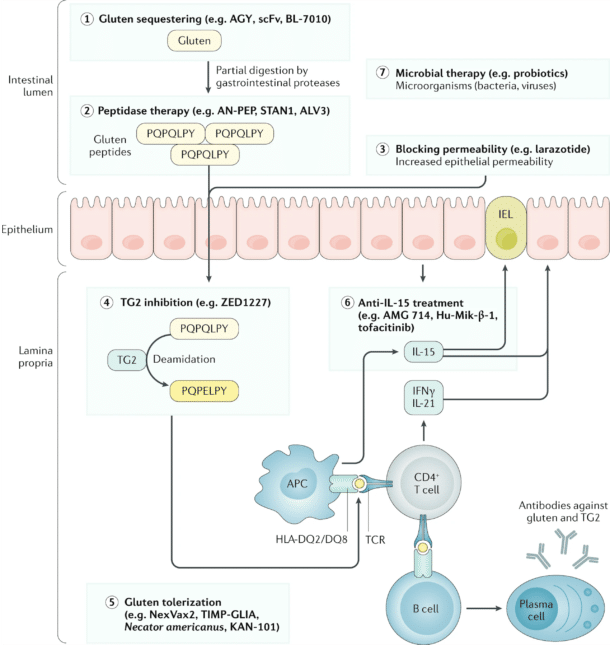
I fase 2a studien CEC-3 ble pasientene provosert med gluten 3 gram daglig. Teoretisk sett vil ZED1227 beskytte også mot høyere doser. I studieledelsen har vi imidlertid valgt å ikke gå videre med høyere doser gluteninntak, men heller studere cøliakere som ikke er blitt bra selv om de er satt på glutenfri kost. Det er klinisk et betydelig problem i mange land og ikke minst i USA der glutenkontaminering ser ut til å være hyppigere enn hos oss. I fase 2b studien CEC-4 vil vi inkludere 400 pasienter, selvsagt også denne som en multisenterstudie (EudraCT 2020-004612-97). Inklusjonskriteriene vil kort summert være 1) sikker cøliakidiagnose tidligere, 2) symptomer på cøliaki med blant annet mageplager, og 3) vedvarende totteatrofi i duodenalbiopsier (Marsh 3). Positiv serologi tillates. Cøliakerne skal leve som vanlig med sitt «glutenfrie kosthold», men randomiseres til enten ZED1227 eller placebo. Det primære endepunktet er attenuering av totteforandringer etter behandlingsperioden. Vi trenger pasienter og vi vil gjerne ha med studiesteder. REK søknad sendes inn i disse dager (red. anm. april 2022). Send gjerne mail til knut.lundin@medisin.uio.no.
Som nevnt er det en rekke firmaer og mange pågående studier på medikamentell behandling av cøliaki (6). Et preparat er kommet til fase 3 (7), men det reises spørsmål ved om dette overhodet kan virke (8). Et søk på Clinical Trials (clinicaltrials.gov) på «celiac disease» gir nå 275 treff, det viser den økende interessen for dette terapiområdet. I tillegg er det studier på EudraCT siden (eudract.ema. europa.eu).
I KG Jebsen senteret for cøliakiforskning kjører vi denne høsten en spennende studie innen immunterapi for cøliaki (ClinicalTrials ID NCT04806737, https://oslo-universitetssykehus.no/kliniske-studier/ immunterapi-med-teriflunomidefor-coliaki) som en utprøver-initiert, single-senter studie på 15 pasienter. Vi tester her ut teriflunomid, en hemmer av enzymet di-hydro orotat dehydrogenase. Medikamentet brukes hos pasienter med multippel sklerose og mekanismen gjør den til en attraktiv kandidat for immunterapi under glutenprovokasjon (9). Resultater forventes til våren. Det primære endepunktet er attenuering av uttrykk av CD38 på HLA-DQ:gluten tetramer positive T celler etter glutenprovokasjon (10).
Andre kommende studier innen immunterapi involverer blant annet infusjon av gluten koblet til nanopartikler i regi av firmaet Topas i Tyskland. Rasjonalet vil være at disse kan føre til nedregulering av immunreaksjonen mot gluten. En annen studie vil teste ut monoklonalt antistoff mot IL-15, et sentralt cytokin innen patogenesen for cøliaki. Sponsor for denne studien er firmaet Calypso Biotech i Holland. Det er økende aktivitet og cøliakerne stiller opp til denne type studier! En fordel med å kjøre kliniske studier med medikamentutprøvning på cøliakere er at de oftest ikke har andre sykdommer og sjeldent bruker andre medikamenter. Det gjør hverdagen til studiesykepleiere og -leger langt enklere. Den avtroppende regjering var klar på sin bestilling til helsevesenet for å øke andelen kliniske studier i Norge, og har tilrettelagt for dette på måter man ikke hadde forventet. Blant annet når det gjelder reiserefusjon for studier gjennom HELFO og takstsetting på undersøkelser i kliniske studier.
Det er stor og økende interesse for medikamentell behandling av cøliaki. Enten som erstatning for et glutenfritt kosthold eller som et tillegg til dette. Et gjennombrudd ble publisert denne sommeren i New England Journal of Medicine der vi beskrev at en hemmer av transglutaminase 2 attenuerer totteforandringene indusert av gluten. Innen overskuelig fremtid antar vi at dette eller andre medikamenter kan bli godkjent behandling for cøliaki.
Denne artikkelen ble første gang publisert i NGF-nytt nr. 3 – 2021. Omtrykk med tillatelse.
1. Al-Toma A, Volta U, Auricchio R, et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. United European gastroenterology journal 2019;7(5):583-613. doi: 10.1177/2050640619844125 [published Online First: 2019/06/19]
2. Dieterich W, Ehnis T, Bauer M, et al. Identification of tissue transglutaminase as the autoantigen of celiac disease. Nature medicine 1997;3(7):797-801.
3. Molberg O, McAdam SN, Korner R, et al. Tissue transglutaminase selectively modifies gliadin peptides that are recognized by gut-derived T cells in celiac disease. Nature medicine 1998;4(6):713-7.
4. Lundin KE, Qiao SW, Snir O, et al. Coeliac disease – from genetic and immunological studies to clinical applications. Scandinavian journal of gastroenterology 2015;50(6):708-17. doi: 10.3109/00365521.2015.1030766 [published Online First: 2015/04/08]
5. Schuppan D, Maki M, Lundin KEA, et al. A Randomized Trial of a Transglutaminase 2 Inhibitor for Celiac Disease. The New England journal of medicine 2021;385(1):35-45. doi: 10.1056/NEJMoa2032441 [published Online First: 2021/07/01]
6. Kivela L, Caminero A, Leffler DA, et al. Current and emerging therapies for coeliac disease. Nature reviews Gastroenterology & hepatology 2021;18(3):181-95. doi: 10.1038/s41575-020-00378-1 [published Online First: 2020/11/22]
7. Leffler DA, Kelly CP, Green PH, et al. Larazotide acetate for persistent symptoms of celiac disease despite a gluten-free diet: a randomized controlled trial. Gastroenterology 2015;148(7):1311-9 e6. doi: 10.1053/j.gastro.2015.02.008 [published Online First: 2015/02/17]
8. Sollid LM, Koning F. Lack of relationship of AT1001 to zonulin and prehaptoglobin-2: clinical implications. Gut 2020 doi: 10.1136/gutjnl-2020-323829 [published Online First: 2021/01/15]
9. Klotz L, Eschborn M, Lindner M, et al. Teriflunomide treatment for multiple sclerosis modulates T cell mitochondrial respiration with affinity-dependent effects. Sci Transl Med 2019;11(490) doi: 10.1126/scitranslmed.aao5563 [published Online First: 2019/05/03]
10. Zuhlke S, Risnes LF, Dahal-Koirala S, et al. CD38 expression on gluten-specific T cells is a robust marker of gluten re-exposure in coeliac disease. United European gastroenterology journal 2019;7(10):1337-44. doi: 10.1177/2050640619874183 [published Online First: 2019/12/17]