NAFLD eller non-alkoholisk fettleversykdom er den vanligste årsaken til forhøyede leverprøver og leversykdom i vestlige land. Tilstanden kan ses på som leverens manifestasjon av det metabolske syndrom, og er en kompleks tilstand som krever en tverrfaglig tilnærming til både diagnostikk og behandling.
Håvard Midgard, Gastromedisinsk avdeling, Oslo universitetssykehus Ullevål
Svein Oskar Frigstad, Medisinsk avdeling, Vestre Viken Bærum Sykehus
John Willy Haukeland, Gastromedisinsk avdeling, Oslo universitetssykehus Ullevål
Begrepet non-alcoholic steatohepatitis (NASH) ble første gang brukt i 1980 da man erkjente at de samme histologiske forandringer med steatose, inflammasjon og fibrose som ses ved alkoholisk fettleversykdom også kunne inntreffe hos pasienter som ikke drakk alkohol (1). Noe senere ble begrepet non-alcoholic fatty liver disease (NAFLD) introdusert, et begrep som både omfatter NASH og ren fettlever uten inflammasjon eller fibrose. Tilstanden har fått svært mye oppmerksomhet med mer enn 15 000 publikasjoner på PubMed bare i løpet av de siste 5 år.
NAFLD er assosiert med abdominal fedme, dyslipidemi, hypertensjon og diabetes type 2, og etter hvert er det blitt klart at pasienter med NAFLD i stor grad overlapper med pasienter som har metabolsk syndrom. Patofysiologisk står både insulinresistens og lavgradig systemisk inflammasjon sentralt ved begge disse tilstandene (2). NAFLD kan derfor oppfattes som leverens manifestasjon ved metabolsk syndrom. Stadig flere har tatt til orde for å endre sykdomsbetegnelsen til metabolic associated fatty liver disease (MAFLD) (3). En fordel ved et navneskifte er at man går bort fra å bruke en eksklusjonsdiagnose, noe som er uheldig siden tilstanden kan inntreffe samtidig med andre leversykdommer, ikke minst alkoholrelatert leversykdom.
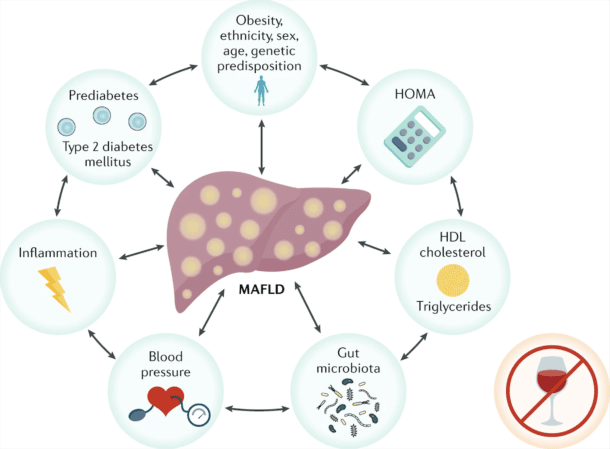
Forenklet kan vi si at NAFLD inntreffer når kroppen har et energioverskudd som lagres i form av fett i leveren, noe som så utløser en hepatisk lipotoksisitet med inflammasjon og fibrose hos et mindretall. Bak disse forandringene ligger det komplekse patofysiologiske prosesser som bare delvis er forstått.
NAFLD innebærer endringer i leverens metabolske apparat med blant annet økt de novo fettsyntese, samtidig som leveren utsettes for oksidativt stress, økt turnover av hepatocytter og eventuelt rekruttering og aktivering av immunceller og fibroseproduserende celler. En rekke cytokiner, inklusive adipocytokiner fra fettvev, er med på å drive frem disse endringene. Bak dette igjen finnes en rekke drivere og sårbarhetsfaktorer som til dels påvirker hverandre gjensidig (Figur 1). Dette forklarer hvorfor sykdomsbildet er så heterogent og at langt fra alle progredierer til cirrhose. Sannsynligvis er denne kompleksiteten årsaken til at det har vist seg vanskelig å finne effektiv medikamentell behandling som passer for alle.
Økt forekomst og økt alvorlighetsgrad av NAFLD ses ved økende alder, og både redusert muskelmasse og økt andel ektopisk fett kan bidra til dette. Kvinner ser ut til å ha mildere sykdomsforløp, og generelt sees mindre uttalt sykdom hos premenopausale kvinner og hos postmenopausale kvinner med østrogensubstitusjon (4).
Tarmens mikrobiota har betydning for vår helse. Embryologisk er leveren utviklet som en utposning fra fordøyelseskanalen og er dermed nært knyttet til tarmen både anatomisk og fysiologisk. Det er derfor ikke overraskende at mikrobiomet kan ha betydning ved kroniske leversykdommer. Spesielt gjelder dette ved metabolsk syndrom og NAFLD, hvor det er påvist dysbiose med uheldige konsekvenser som økt intestinal permeabilitet, økt endotoksinemi og endret gallesyremetabolisme (6).
Både genetiske og epigenetiske faktorer er med på å modifisere sykdomsutviklingen. Faktisk regner man med at om lag halvparten av innholdet av leverfett kan forklares genetisk (7). Genomvide assosiasjonsstudier har bidratt til å identifisere aktuelle gener. De mest robuste assosiasjonene knyttes til mutasjoner i gener relatert til hepatisk lipidmetabolisme, men også mutasjoner relatert til mitokondriefunksjon, insulinresistens og det medfødte immunsystem er assosiert med NASH, fibrose og hepatocellulært karsinom (HCC).
NAFLD er den vanligste årsaken til forhøyete leverprøver og leversykdom i vestlige land. Prevalensen av NAFLD er i ulike studier rapportert fra 14-32 % (8). Den høyeste forekomsten er rapportert i Sør-Amerika og Midtøsten, mens den laveste forekomsten er rapportert i Afrika. Hos pasienter med diabetes type 2 foreligger NAFLD hos nesten 60%. Prevalensen av NASH er derimot mye lavere, og varierer i vestlige land fra 2-6% (8, 9).
Prevalensen av NAFLD øker parallelt med forekomsten av overvekt i befolkningen. Globalt anslås at 39% av befolkningen er overvektige (BMI ≥ 25) og at 13% har fedme (BMI ≥ 30) (8). I Norge har nyere befolkningsundersøkelser vist en sterk økning i forekomst av både overvekt og diabetes type 2, og mye tyder på at flertallet av den voksne befolkningen nå er overvektige eller har fedme (10). Både i USA og i deler av Europa har fedmeepidemien medført at NASH nå er en ledende årsak til levertransplantasjon (11).
Selv om de fleste pasienter med NAFLD har metabolsk syndrom (12), ser man i vestlige land at om lag 7% av NAFLD-pasienter normalvektige (lean NAFLD) (8, 13, 14). De fleste i denne kategorien har imidlertid en eller flere metabolske risikofaktorer eller hereditet for dette.
Omtrent halvparten av NAFLD-pasienter med vedvarende forhøyede transaminaser har NASH med tilhørende histologiske forandringer i leverbiopsi (12). De fleste pasienter med NAFLD har stabil eller langsomt progredierende sykdom dominert av enkel steatose, men hos om lag 20% oppstår inflammasjon med aktivering av immunsystemet og påfølgende celleskade med eller uten fibrose (NASH). Av disse progredierer 10-30% til signifikant leverfibrose, og 10-15% progredierer videre til cirrhose (8).
Disse prosessene påvirkes av faktorer som så langt ikke er fullt ut forstått. En undergruppe av pasienter kan ha en raskere progresjon til avansert leversykdom med cirrhoseutvikling, og et fåtall kan utvikle cirrhose på få år etter et relativt kortvarig stadium med fibroseutvikling (8). Spontan regresjon av fibrose uten progresjon til mer avanserte stadier kan også forekomme. Tilstedeværelse av diabetes type 2 er den viktigste risikofaktor for utvikling av avansert leversykdom ved NASH (14).
En av flere faktorer som kan påvirke sykdomsutviklingen ved NAFLD er samtidig bruk av alkohol. Mange pasienter har komponenter fra både alkoholisk og metabolsk betinget fettlever, og dermed et overlappssyndrom. Det er ingen tvil om at dette innebærer synergistiske effekter med betydelig økt risiko for levercirrhose og død. Hvorvidt mildt eller moderat alkoholforbruk ved NAFLD gir økt sykdomsprogresjon har imidlertid vært mer omdiskutert (5).
Personer med NAFLD har økt risiko for hjerte- og karsykdom. Denne risikoen øker ytterligere ved utvikling av leverfibrose, uavhengig av risikoen knyttet til overvekt, diabetes og hypertensjon (15,16). Den økte leverrelaterte mortaliteten ved NASH kan tilskrives leversvikt, portal hypertensjon og HCC (17,18). De siste 15-20 årene er det observert at en økende andel av HCC i vestlige land skyldes NASH (19).
NAFLD er en kompleks tilstand som krever en systematisk diagnostisk tilnærming hvor etablering av etiologisk diagnose, avklaring av stadium av leversykdom og identifikasjon av metabolsk/ kardiovaskulær risiko utgjør de tre hovedkomponentene. I tillegg til proaktivt å identifisere diabetes type 2, hypertensjon og dyslipidemi, er det viktig å avdekke og kartlegge samtidig skadelig alkoholkonsum.
NAFLD har tradisjonelt vært en eksklusjonsdiagnose basert på påvisning av leversteatose i fravær av andre årsaker til steatose som alkoholoverforbruk, viral hepatitt (spesielt hepatitt C) og legemiddelindusert steatose (f.eks. sekundært til prednisolonbruk). Som omtalt innledningsvis, er trenden nå i ferd med skifte fra negativ til positiv diagnostikk, hvor diagnosen stilles basert påvisning av steatose i nærvær av metabolske risikofaktorer (MAFLD).
Inngangsporten til diagnosen er ofte et tilfeldig funn av steatose ved ultralyd eller CT. Ved målrettet ultralyd av leveren kan signifikant steatose påvises med 85% sensitivitet og 94% spesifisitet med brukbar interobservatør variabilitet (20). Graden av steatose kan enkelt anslås ved hjelp av FibroScan, hvor kvantifisering av ekkobølgens attenuasjon eller CAP (Controlled Attenuation Parameter) er integrert. Det er foreløpig ingen konsensus om optimale terskelverdier for CAP, men verdier over 275 dB/m påviser signifikant steatose med >90% positiv prediktiv verdi (21). MR-basert kvantifisering av steatose har vist svært gode testegenskaper, men bruken begrenses naturligvis av kostnad og tilgjengelighet.
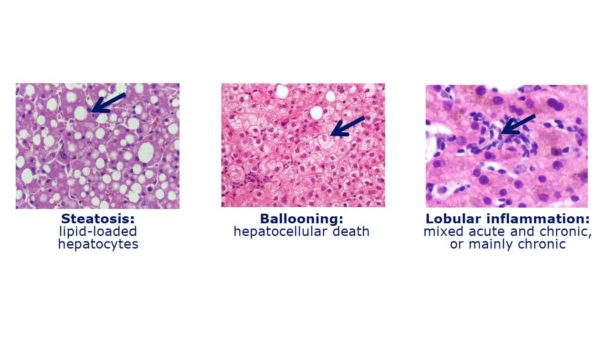
Gullstandard for diagnosen NASH er histologisk undersøkelse av leverbiopsi. Det best validerte histologiske scoringssystemet er NAFLD Activity Score (NAS) som summerer graden av steatose (0-3), lobulær inflammasjon (0-3) og hepatocytt-ballonering (0-2) til en totalscore fra 0-8 (Figur 2). Det kreves gjerne en NAS-score på 4 for å stille definitiv histologisk diagnose (22). I klinisk praksis kan dette oppleves for strengt, og ofte stilles nok diagnosen NASH pragmatisk uten leverbiopsi, understøttet av typiske biokjemiske funn med lette til moderate utfall i ALAT, ASAT og ferritin. En klinisk NASH-diagnose er imidlertid beheftet med stor usikkerhet.
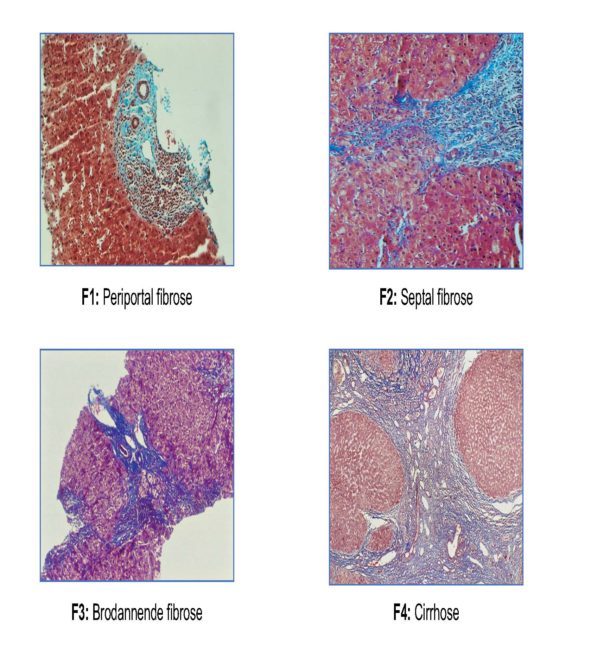
God stadiediagnostikk ved NASH er av avgjørende betydning for å avklare prognose og behov for oppfølging. Histologisk undersøkelse av leverbiopsi gir en separat vurdering av stadium av leverfibrose på en skala fra F0-F4 hvor F0 er fravær av fibrose, F3 er brodannende fibrose, og F4 er cirrhose (Figur 3). Leverbiopsi er ressurskrevende og invasivt, og begrenses av en viss risiko for komplikasjoner og av at biopsien ikke er representativ. Det er derfor et stort behov for gode non-invasive tester og biomarkører for prognostisering og monitorering ved NASH.
NAFLD fibrosis score (NFS) og FIB-4 er enkle og godt validerte fibroseindekser som er lett tilgjengelige og bør brukes til initial risikostratifisering (23). NFS er basert på alder, BMI, ASAT, ALAT, albumin, trombocytter og nærvær av diabetes type 2, mens FIB-4 er basert på alder, ASAT, ALAT, trombocytter. NFS <-1.455 eller FIB-4 <1.3 kan utelukke avansert fibrose med >90% negativ prediktiv verdi. Enklere indekser som APRI-score eller ASAT/ALAT-ratio er også nyttige. Patenterte tester som ELF og Fibro- Test er endel brukt internasjonalt.
Elastografi av leveren (måling av leverstivhet) er et godt etablert noninvasivt verktøy for stadiediagnostikk ved kroniske leversykdommer. Transient elastografi (FibroScan) er den best studerte modaliteten ved NAFLD, men de diagnostiske egenskapene er dessverre dårligere enn ved virale hepatitter (23). Bruken av FibroScan ved NASH begrenses av hyppig forekomst av falskt forhøyede verdier, noe som sannsynligvis skyldes kjente feilkilder som pågående nekroinflammasjon, høy BMI og steatose (24). Det finnes ingen godt etablerte terskelverdier, men verdier <8 kPa kan utelukke avansert fibrose med >90% negativ prediktiv verdi og verdier >12-15 kPa kan detektere avansert fibrose med svakere positiv prediktiv verdi, avhengig av pre-test sannsynligheten (25). En fordel med FibroScan er at man i samme prosedyre automatisk måler CAP.
Det finnes flere andre elastografimodaliteter som gradvis har fått økende utbredelse (23). MR elastografi regnes for å ha de beste diagnostiske egenskapene, men er ressurskrevende og relativt lite utbredt. Ultralyd-basert shear wave elastografi som pSWE (Siemens) og 2D-SWE (GE, Aixplorer, Canon) er lovende metoder med stadig økende datagrunnlag ved NAFLD.
Ved NASH er risikoen for HCCutvikling til stede allerede på pre-cirrhotisk stadium, og mer enn halvparten av NASH-assosiert HCC oppstår faktisk hos pasienter uten etablert cirrhose (11). Det mangler gode verktøy for risikostratifisering, men kjente risikofaktorer er mannlig kjønn, høy alder, høy leverstivhet, diabetes type 2, og samtidig alkoholoverforbruk (26). På bakgrunn av dette bør i utgangspunktet alle pasienter med cirrhose og utvalgte pasienter med brodannende fibrose inkluderes i HCC-overvåkning med ultralyd og måling av alfa-fetoprotein (AFP) hver 6. måned.
Pasienter med mistanke om portal hypertensjon bør screenes for gastroøsofageale varicer. I henhold til Baveno guidelines kan gastroskopi utelates hos pasienter med leverstivhet <20 kPa og trombocytter >150 fordi risikoen for behandlingstrengende varicer da er svært lav (27). Portal hypertensjon kan også vurderes non-invasivt på bakgrunn av elastografi av milten og ultralydfunn som miltstørrelse og portveneflow. Pasienter med dekompensert leversykdom skal vurderes for levertransplantasjon.
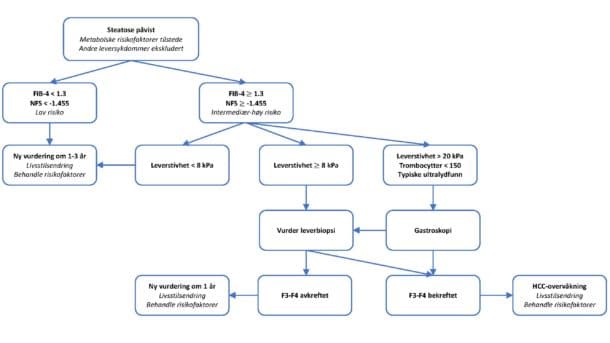
Figur 4 viser en algoritme med forslag til diagnostikk og oppfølging av NAFLD. I utgangspunktet bør de fleste pasienter med NAFLD og forhøyede transaminaser henvises til spesialist for risikostratifisering. Oppfølgingen av pasienter med lav risiko kan imidlertid ofte gjennomføres i allmennpraksis. Det er viktig å understreke at en cirrhose-diagnose ikke bare kan stilles histologisk eller ved elastografi, men også på bakgrunn av radiologiske og kliniske funn eller basert på summen av tilgjengelige data.
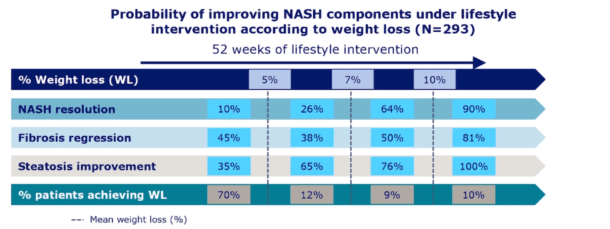
Rasjonalet for behandling av NAFLD er både å redusere mortalitet (leverrelatert og totalt) og å redusere risiko for utvikling av cirrhose og HCC. Til tross for enorm innsats gjennom flere tiår med basalforskning og legemiddelutprøvinger, finnes det foreløpig ingen godkjent effektiv medikamentell behandling. Grunnpilaren i håndteringen av NAFLD er derfor fortsatt livsstilsendring (Figur 5). Den gunstige effekten av vektreduksjon gjennom kalorirestriksjon og fysisk aktivitet er grundig demonstrert i observasjonelle studier (28), men det finnes få randomiserte studier med histologiske endepunkter. Prinsippene for kostendring er reduksjon av raffinert sukker, fruktose og mettet fett, med preferanse for «middelhavskosthold». Det er sannsynligvis et dose-respons forhold mellom vektreduksjon og reversering av histologiske forandringer, og det er vist at selv lett til moderat (7-10%) vektreduksjon kan føre til resolusjon av både steatose, NASH og fibrose (29).
Å oppnå livsstilsendring forutsetter god pasientmotivasjon, og ofte kan det være nyttig med en tverrfaglig tilnærming med ernæringsfysiolog, allmennlege, hepatolog, diabetolog og gjerne preventiv kardiolog. Behandling av eventuell diabetes type 2, hypertensjon og dyslipidemi kan oftest håndteres i allmennpraksis.
Siden overvektskirurgi effektivt kan promotere vektreduksjon, er dette en mulig behandlingsstrategi hos pasienter med fedme (BMI >35). Observasjonelle data tyder på at det oppnås forbedring av histologiske endepunkter 5 år etter bariatrisk kirurgi (30), men det finnes ikke randomiserte studier. Gastrisk bypass og gastrisk sleeve regnes som foretrukne metoder og er sannsynligvis kostnadseffektive hos pasienter med høy risiko for avansert fibroseutvikling. Etablert cirrhose er ingen absolutt kontraindikasjon, men det kreves grundig seleksjon av pasienter med kompensert leverfunksjon uten portal hypertensjon.
Antidiabetisk behandling med metformin er utbredt i NAFLDpopulasjonen, men til tross for data som antyder reduksjon i HCC-risiko foreligger svært lite data som støtter effekt på NASH (9). Til tross for manglende godkjenning, er det internasjonalt en viss tradisjon for å bruke pioglitazon og vitamin E, basert på positive funn i randomiserte studier med histologiske endepunkter (31). Den antidiabetiske PPAR-y-agonisten pioglitazon er foreslått å motvirke insulinresistens ved NAFLD, og er sannsynligvis mest effektiv for resolusjon av NASH og reversering av fibrose hos pasienter med diabetes type 2. Vitamin E har kjent anti-apoptotisk og antioksidativ effekt, og har vist lovende resultater i kombinasjon med pioglitazon. Vi har i Norge begrenset klinisk erfaring med disse medikamentene ved NASH.
Et stort antall medikamenter er nå i utprøving i fase 2- eller fase 3-studier, og for øyeblikket er nesten 100 legemiddelfirmaer involvert i utviklingen. Angrepspunktene for disse molekylene reflekterer den komplekse patofysiologien ved NASH, og medikamentene kan grovt klassifiseres som antiinflammatoriske/antifibrotiske, gallesyre-modulerende eller metabolisme-modulerende. I de siste to tiårene har vi vært vitne til mange utviklingsprogrammer som dessverre har mislyktes i å vise klinisk effekt til tross for et bredt spekter av virkningsmekanismer. Fellesnevneren for de fleste pågående fase 3-studier er internasjonale placebokontrollerte randomiserte studier med kombinasjonen av histologiske (resolusjon av NASH og fibrose) og kliniske (død og leverrelaterte hendelser) endepunkter etter flere års oppfølging.
Obetikolsyre er en selektiv farnesoid X reseptoragonist som allerede er godkjent mot PBC på bakgrunn sine antikolestatiske og antiinflammatoriske egenskaper. Til tross for at obetikolsyre viste lovende resultater i interim-analyse av en stor pågående fase 3-studie (32), ble legemiddelet i første omgang ikke godkjent av FDA pga bekymringer rundt toksisitet og manglende langtidsdata. Endelige data forventes høsten 2022. Cencriviroc er en kombinert kjemokin CCR2/ CCR5-reseptoragonist som hemmer makrofagrekruttering i leveren og som har vist antiinflammatoriske og antifibrotiske egenskaper i dyremodeller. Etter lovende fase 2-data (33) ble dessverre fase 3-studien nylig avbrutt grunnet manglende effekt. Elafibranor er en PPAR-reseptoragonist hvor fase 3-studien også ble avsluttet pga manglende effekt, men en ny PPAR-agonist lanifibranor har vist svært lovende resultater i fase 2. Thyroidhormonreseptoragonisten resmetirom (regulerer flere metabolske signalveier i leveren) og lipid-modulatoren aramchol (hemmer fettsyresyntesen i leveren) er andre kandidater under utprøvning i fase 3-studier.
Det er knyttet stor forventing til GLP-1-agonisten semaglutid, som allerede er godkjent for behandling av diabetes type 2 og som har vist svært gode resultater på både glykemisk kontroll, vektreduksjon og kardiovaskulære endepunkter. GLP-1 er et intestinalt hormon som frigjøres postprandialt i tynntarm og som har multiple metabolske effekter, inkludert stimulering av insulinsekresjon og hemming av glukagonsekresjon, økning av energiomsetningen og hemming av apetittsenteret (34). Etter lovende resultater i fase 2–studien (35), har rekruttering av pasienter i en stor fase 3-studie nylig startet. Gastromedisinsk avdeling ved Oslo universitetssykehus Ullevål og Vestre Viken Bærum sykehus vil inkludere pasienter i denne studien i Norge.
1. Ludwig J, Viggiano TR, McGill DB, et al. Nonalcoholic steatohepatitis: Mayo Clinic experiences with a hitherto unnamed disease. Mayo ClinProc 1980; 55: 434-8.
2. Luo Y, Lin H. Inflammation initiates a vicious cycle between obesity and nonalcoholic fatty liver disease. Immun Inflamm Dis 2021; 9: 59-73.
3. Eslam M, Sanyal AJ, George J. MAFLD: A Consensus-Driven Proposed Nomenclature for Metabolic Associated Fatty Liver Disease. Gastroenterology 2020; 158: 1999-2014.e1.
4. Clark JM, Brancati FL, Diehl AM. Nonalcoholic fatty liver disease. Gastroenterology 2002; 122: 1649-57.
5. Boyle M, Masson S, Anstee QM. The bidirectional impacts of alcohol consumption and the metabolic syndrome: Cofactors for progressive fatty liver disease. J Hepatol 2018; 68: 251-67.
6. Bakhshimoghaddam F, Alizadeh M. Contribution of gut microbiota to nonalcoholic fatty liver disease: Pathways of mechanisms. Clin Nutr ESPEN 2021; 44: 61-8.
7. Eslam M, Valenti L, Romeo S. Genetics and epigenetics of NAFLD and NASH: Clinical impact. J Hepatol 2018; 68: 268-79.
8. Yanoussi ZM. The Epidemiology of Nonalcoholic Steatohepatitis, Clin Liver Dis 2018; 11: 92-94.
9. Day CP. Clinical spectrum and therapy of non-alcoholic steatohepatitis. Dig Dis Sci 2012; 30: 69-73.
10. Krokstad S, Langhammer A, Hveem K, et al. Cohort profile: the HUNT Study, Norway. Int J Epidemiol 2013; 42: 968-77.
11. Goldberg D, Ditah IC, Saeian K, et al. Changes in the prevalence of hepatitis C virus infection, nonalcoholic steatohepatitis, and alcoholic liver disease among patients with cirrhosis or liver failure on the waitlist for liver transplantation. Gastroenterology 2017; 152:1090-1099
12. Younossi ZM, Koenig AB, Abdelatif D, et al. Global epidemiology of nonalcoholic fatty liver disease. Hepatology 2016; 64: 73-84.
13. Machado M, Marques-Vidal P, Cortez-Pinto H. Hepatic histology in obese patients undergoing bariatric surgery. J Hepatol 2006; 5: 600-6.
14. Sayiner M, Koenig A, Henry L, et.al. Epidemiology of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis in the United States and the rest of the world. Clin Liver Dis. 2016 ; 20: 205-14.
15. Angulo, Gastroenterology 2013 Angulo P, Bugianesi E, Bjornsson ES, et al. Simple noninvasive systems predict long-term outcomes of patients with nonalcoholic fatty liver disease. Gastroenterology. 2013;145:782-9.
16. Ekstedt M, Hagström H, Nasr P, et al. Fibrosis stage is the strongest predictor for disease-specific mortality in NAFLD after up to 33 years of follow-up. Hepatology 2015; 61:1547-54.
17. Stepanova M, Rafiq N, Makhlouf H, et.al. Predictors of all-cause mortality and liver-related mortality in patients with non-alcoholic fatty liver disease (NAFLD). Dig Dis Sci. 2013; 58: 3017-23
18. Younossi ZM, Otgonsuren M, Henry L, et al. Association of nonalcoholic fatty liver disease (NAFLD) with hepatocellular carcinoma (HCC) in the United States from 2004 to 2009. Hepatology 2015; 62:1723-1730.
19. Younossi Z, Anstee QM, Marietti M, et al. Global burden of NAFLD and NASH: trends, predictions, risk factors and prevention. Nat Rev Gastroenterol Hepatol 2018;15:11-20.
20. Hernaez R, Lazo M, Bonekamp S, Kamel I, Brancati FL, Guallar E, et al. Diagnostic accuracy and reliability of ultrasonography for the detection of fatty liver: a meta-analysis. Hepatology 2011;54:1082–1090.
21. Eddowes PJ, Sasso M, Allison M, Tsochatzis E, Anstee QM, Sheridan D, et al. Accuracy of FibroScan controlled attenuation parameter and liver stiffness measurement in assessing steatosis and fibrosis in patients with nonalcoholic fatty liver disease. Gastroenterology 2019;156:1717– 1730.
22. Kleiner DE, Brunt EM, Van Natta M, et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology. 2005;41(6):1313–1321
23. European Association for the Study of the Liver. EASL Clinical Practice Guidelines on non-invasive tests for evaluation of liver disease severity and prognosis – 2021 update. Journal of Hepatology 2021 vol. 75 j 659–689
24. Eddowes PJ, Sasso M, Allison M, Tsochatzis E, Anstee QM, Sheridan D, et al. Accuracy of FibroScan controlled attenuation parameter and liver stiffness measurement in assessing steatosis and fibrosis in patients with nonalcoholic fatty liver disease. Gastroenterology 2019;156:1717– 1730.
25. Castera L, Friedrich-Rust M, Loomba R. Noninvasive assessment of liver disease in patients with nonalcoholic fatty liver disease. Gastroenterology 2019;156. 1264-1281.e1264.
26. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol2018;69:182-236. doi:10.1016/j.jhep.2018.03.019 pmid:29628281
27. Stafylidou M, Paschos P, Katsoula A, Malandris K, Ioakim K, Bekiari E, Haidich AB, Akriviadis E, Tsapas A. Performance of Baveno VI and Expanded Baveno VI Criteria for Excluding High-Risk Varices in Patients With Chronic Liver Diseases: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2019 Aug;17(9):1744-1755.e11. doi: 10.1016/j.cgh.2019.04.062. Epub 2019 May 8. PMID: 31077823.
28. Romero-Gómez M, Zelber-Sagi S, Trenell M. Treatment of NAFLD with diet, physical activity and exercise. J Hepatol2017;67:829-46. doi:10.1016/j.jhep.2017.05.016 pmid:28545937
29. Vilar-Gomez E, Martinez-Perez Y, Calzadilla-Bertot L, et al. Weight loss through lifestyle modification significantly reduces features of nonalcoholic steatohepatitis. Gastroenterology2015;149:367-78.e5, quiz e14-5. doi:10.1053/j.gastro.2015.04.005 pmid:25865049
30. Laursen TL, Hagemann CA, Wei C, et al. Bariatric surgery in patients with non-alcoholic fatty liver disease – from pathophysiology to clinical effects. World J Hepatol2019;11:138-49. doi:10.4254/wjh.v11.i2.138 pmid:30820265
31. Sanyal AJ, Chalasani N, Kowdley KV, et al., NASH CRN. Pioglitazone, vitamin E, or placebo for nonalcoholic steatohepatitis. N Engl J Med2010;362:1675-85. doi:10.1056/NEJMoa0907929 pmid:20427778
32. Younossi ZM, Ratziu V, Loomba R, et al., REGENERATE Study Investigators. Obeticholic acid for the treatment of non-alcoholic steatohepatitis: interim analysis from a multicentre, randomised, placebo-controlled phase 3 trial. Lancet2019;394:2184-96. doi:10.1016/S0140-6736(19)33041-7 pmid:31813633
33. Friedman SL, Ratziu V, Harrison SA, et al. A randomized, placebo-controlled trial of cenicriviroc for treatment of nonalcoholic steatohepatitis with fibrosis. Hepatology2018;67:1754-67. doi:10.1002/hep.29477 pmid:28833331
34. Campbell JE, Drucker DJ. Pharmacology, physiology, and mechanisms of incretin hormone action. Cell Metab2013;17:819-37. doi:10.1016/j.cmet.2013.04.008 pmid:23684623
35. Newsome PN, Buchholtz K, Cusi K, et al., NN9931-4296 Investigators. A placebo-controlled trial of subcutaneous semaglutide in nonalcoholic steatohepatitis. N Engl J Med2020. doi:10.1056/NEJMoa2028395 pmid:33185364