Hjertesvikt er et økende problem i befolkningen og står for mange av sykehusinnleggelsene ved medisinske avdelinger. I 2021 kom det oppdaterte retningslinjer fra European Society of Cardiology for behandling av hjertesvikt, og artikkelen gjennomgår endringene fra et norsk perspektiv.
Eivind Westrum Aabel, lege i spesialisering; Kaspar Broch, overlege PhD og Einar Gude, overlege PhD, kardiologisk avdeling, OUS Rikshospitalet og Universitet i Oslo
Behandling av hjertesvikt er under stadig utvikling, og for at retningslinjene skal gjenspeile den nyeste forskningen, må de oppdateres regelmessig. De nye europeiske retningslinjene for diagnostisering og behandling av akutt og kronisk hjertesvikt ble publisert i 2021 og erstatter European Society of Cardiology sine retningslinjer fra 2016 (1). Dokumentet er omfattende, med et stort antall anbefalinger og behandlingsalgoritmer. Mange av anbefalingene er basert på et solid evidensgrunnlag, mens noen anbefalinger er baserte på konsensus i ekspertgruppen som står for utformingen av retningslinjene. Mange av endringene følger naturlig av de siste årenes randomiserte studier og andre forskningsresultater. Det er tydeligere påpekt at hjertesviktpasienter trenger en nøye kartlegging av fenotype og et individuelt tilpasset behandlingsregime, og at det er viktig å utrede årsak til hjertesvikt. Dette gjelder spesielt hos yngre pasienter, hvor genetiske årsaker forekommer hyppigere, og der årsaksrettet behandling er tilgjengelig (f. eks ved klaffefeil, takykardi-indusert kardiomyopati eller amyloidose).
Definisjonen av hjertesvikt er uendret. Hjertesvikt betegnes som et klinisk syndrom med typiske symptomer som dyspné og perifere ødemer, forårsaket av redusert pumpeevne (med nedsatt eller normal ejeksjonsfraksjon) under normale eller økt fylningsforhold. Pasienter med symptomer og tegn på hjertesvikt bør få målt NT-proBNP. Dersom NT-proBNP er <125 pg/ml, er diagnosen hjertesvikt lite sannsynlig. I motsatt tilfelle bør hjertefunksjonen karakteriseres nærmere, primært med ekkokardiografi. Bruk av MR er fortsatt anbefalt der det er usikre funn ved ekkokardiografi, samt for avklaring av eventuell bakenforliggende årsak til hjertesvikten.
I denne artikkelen er det fokusert på kronisk hjertesvikt, men retningslinjene gir også behandlingsanbefalinger for avansert eller akutt hjertesvikt, som for det meste dekker behandling som gis på kardiologisk overvåkning eller sengepost.
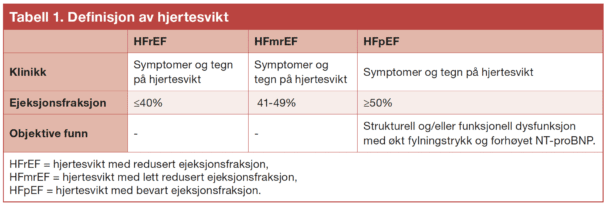
Andelen av hjertets blodvolum som tømmes ved hvert hjerteslag, også kalt ejeksjonsfraksjon (EF), har fortsatt en sentral rolle i kategorisering av hjertesvikt. Den klassiske pasienten med hjertesvikt har EF ≤40% (ofte kalt heart failure with reduced ejection fraction (HFrEF) i engelsk litteratur) og har ofte god effekt av både medikamenter, implanterbar hjertestarter og biventrikulær pacemaker. Denne gruppen har det beste evidensgrunnlaget for behandling.
Hjertesviktpasienter med bevart EF ≥50%, også kalt heart failure with preserved ejection fraction (HFpEF), utgjør imidlertid opptil halvparten av pasientene med hjertesvikt. Forekomsten av HFpEF øker med en aldrende befolkning med mer komorbiditet. Ved HFpEF foreligger det forstyrrelser i hjertets relaksasjon eller elastisitet, og flere studier har vist at konvensjonell HFrEFbehandling har liten eller ingen effekt på overlevelse. Litt vanskelig tolkbare resultater i store studier reflekterer kanskje delvis at normal EF for kvinner sannsynligvis er høyere enn for menn, slik at EF 45-50% muligens er subnormalt hos kvinner.
Hjertesviktpasienter med EF mellom 41% og 49% blir nå benevnt heart failure with mildly reduced ejection fraction (HFmrEF), hvor uttrykket «mildly reduced», mot tidligere «midrange », gjenspeiler at behandlingsstrategien for denne gruppen dreier mer i retning av HFrEF.
En fjerde gruppe er også nevnt i de nye retningslinjene, nemlig pasienter med forbedret EF (dvs EF ≥50%, etter tidligere å ha fått påvist EF ≤40%). Disse pasientene skal fortsette behandling som ved HFrEF, i tråd med TRED-HF-studien (2), som viste tilbakefall av hjertesvikt når behandling ble avsluttet for denne pasientgruppen.
Behandlingsalgoritmen for HFrEF er forenklet i de nye retningslinjene og er strukturert i tre trinn. Første trinn er å gi medikamentell behandling med det beste evidensgrunnlaget. Her inngår som tidligere betablokkere, angiotensin konverterende enzym (ACE)-hemmere og mineralokortikoid reseptor-antagonist (MRA; spironolakton eller eplerenon). Nytt for disse retningslinjene er at natrium glukose kotransporter 2 (SGLT-2)-hemmere (dapagliflozin eller empagliflozin) er anbefalt for HFrEF og introduseres parallelt med de tre andre medikamentene. Den nye anbefalingen om SGLT-2-hemmer ved HFrEF er basert på to store studier (DAPA-HF (3) og EMPERORREDUCED (4)), som samlet viste at behandling med SGLT2-hemmer ga en 13% reduksjon av død uansett årsak, 31% reduksjon av første hospitalisering for hjertesvikt og 32% reduksjon i forverring av nyresvikt (5). Denne effekten var uavhengig av om pasienten hadde diabetes mellitus og uavhengig av bakgrunnsmedikasjon. Nytt er også at angiotensinreseptor-/ neprilysin-hemmer (ARNI) kan startes hos pasienter som ikke tidligere har brukt ACE-hemmer, men dette er ikke støttet av norske refusjonsregler.
Tradisjonelt har betablokker og ACE-hemmer blitt trappet opp til maksimal tolerable dose før introduksjon av nyere medikamenter som MRA og ARNI. Nye anbefalinger er nå at betablokker, ACE-hemmer/ ARNI, MRA og SGLT2-hemmer bør startes så raskt og trygt som mulig med rask opptrapping under klinisk og biokjemisk kontroll. Det er derfor anbefalt at innlagte hjertesviktpasienter med dekompensering bør få oppfølging i løpet av 1 til 2 uker etter innleggelsen. Optimal medisinsk behandling gir god symptomatisk og prognostisk gevinst og bør tilstrebes hos de fleste. Hos eldre, skrøpelige eller pasienter med nyresvikt eller annen komorbiditet må opptrapping vurderes avhengig av toleranse og symptomatisk effekt.
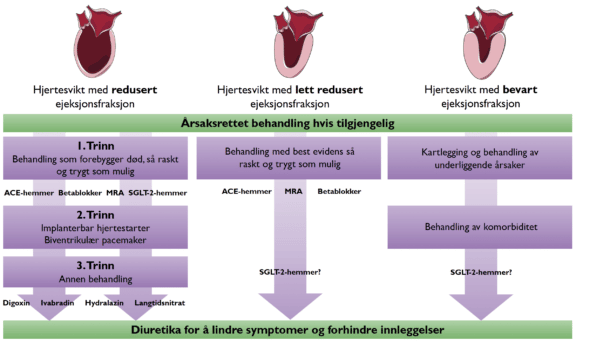
I andre trinn vurderes biventrikulær pacemaker og/eller implanterbar hjertestarter hos utvalgte pasienter med EF <35% etter minst tre måneder med optimal medisinsk behandling. Evidensen for bruk av implanterbar hjertestarter har imidlertid blitt nedgradert hos pasienter som har non-koronar kardiomyopati. Denne endringen er basert på resultatene fra DANISH-studien (6), som ikke viste overlevelsesgevinst av primærprofylaktisk implanterbar hjertestarter i denne gruppen.
I trinn tre bør medikamenter med svakere evidensgrunnlag vurderes ved vedvarende symptomer (digoxin, ivabradin, vericiguat, hydralazin eller langtidsnitrat), men bortsett fra digoxin, brukes disse medikamentene lite i Norge. Diuretika bør vurderes for å bedre symptomer og hindre innleggelser, men medikamentgruppen er ikke vist å påvirke overlevelse. Digoxin har først og fremst effekt som frekvensregulerende behandling ved samtidig atrieflimmer og hjertesvikt, hvor medikamentet kan øke EF og bedre symptomer.
Fordi det ikke forelå noen behandling med dokumentert effekt på mortalitet eller morbiditet da utarbeidelsen av retningslinjene fant sted, er det ikke gitt anbefalinger om behandling av denne gruppen utover diuretika og kartlegging og behandling av underliggende årsaker og komorbiditet. Det dårlige evidensgrunnlaget gjenspeiles i de nye retningslinjene, hvor kun 3 sider er viet HFpEF sammenlignet med 11 sider for behandling av HFrEF. Derimot viste EMPEROR-PRESERVED-studien (7) at hos denne pasientgruppen ga SGLT-2-hemmeren empagliflozin en 21% relativ risikoreduksjon for kardiovaskulær død eller sykehusinnleggelser for hjertesvikt. Endepunktet var drevet av reduksjon i sykehusinnleggelser grunnet hjertesvikt, og i subgruppeanalysen ser det ut som at pasientene med EF nærmere 40% (HFmrEF) hadde størst gevinst. Selv om studien kan åpne for bruk av disse medikamentene ved HFpEF, er ikke dette tatt inn i de nye retningslinjene. Bruken av SGLT-2-hemmer ved HFpEF er foreløpig heller ikke tatt inn i norske refusjonsregler.
For pasienter med HFmrEF er behandlingen i hovedtrekk den samme som ved HFrEF, bare med svakere styrke og evidensgrunnlag. Anbefalingene er basert på subgruppeanalyser fra studier der denne gruppen pasienter har blitt inkludert sammen med HFpEF. Derimot inngår ikke SGLT-2-hemmer som en del av behandlingen i de reviderte retningslinjene, men funnene i EMPEROR-PRESERVED tilsier at SGLT-2-hemmere kan være nyttige i denne populasjonen. Videre vil mange pasienter uansett ha indikasjon for hjertesviktmedikamenter på grunn av komorbiditet. Diuretika anbefales for å redusere symptomer, mens det er lite kunnskapsgrunnlag for biventrikulær pacemaker eller implanterbar hjertestarter hos pasienter med HFmrEF.

Nytt av fjorårets retningslinjer er at medikamentene med sterkest evidensgrunnlag (ACE-hemmer, betablokker, MRA og SGLT-2-hemmer) anbefales å startes så raskt og trygt som mulig. Dette er i motsetning til strategien med sekvensiell oppstart fra tidligere retningslinjer. Selv om studiene er laget slik at ACE-hemmer og betablokkere har vært introdusert før MRA, og deretter oppstart av SGLT2-hemmere, legger ikke de nye retningslinjene føringer for rekkefølge og opptitrering av medikamentgruppene. Det er opp til hver enkelt lege å individualisere oppstart av behandling, som må tilpasses om pasienten er inneliggende eller under poliklinisk oppfølging, samt kompliserende faktorer som hypotensjon, nyresvikt eller hyperkalemi. Endringen har skapt debatt i fagmiljøet på grunn av manglende evidens for denne raske strategien. Sannsynligvis når flere HFrEF-pasienter evidensbaserte behandlingsmål om flere medikamentgrupper introduseres synkront før maksimal dose er nådd på annen medikamentgruppe. Det er estimert at et medikamentregime bestående av ARNI, betablokker, MRA og SGLT2-hemmer kan gi mellom 2,7 (for en 80-åring) og 8,3 (for en 55-åring) ekstra år fri for kardiovaskulær død eller hospitalisering for hjertesvikt sammenlignet med et regime bestående av ACE-hemmer og betablokker8. Det er derfor viktig at pasientene får oppdatert evidensbasert behandling. Ifølge tall fra hjertesviktregisteret brukte 95-97% av pasientene ACE-hemmer og betablokker i 2020, mens kun 56% brukte MRA. Det finnes foreløpig ikke tall på bruk av SGLT-2-hemmer.
Gjennom norsk hjertesviktregister (9) har vi god oversikt over kvaliteten på behandlingen som gis til hjertesviktpasientene som følges på de 39 hjertesviktpoliklinikkene i Norge. Tall fra 2020 viser at disse først og fremst er pasienter med HFrEF (66%), etterfulgt av HFmrEF (23%) og HFpEF (11%). Fordelingen gjenspeiler sannsynligvis den økende kompleksiteten av behandlingen ved HFrEF og dermed behovet for oppfølging i spesialisthelsetjenesten, samtidig som medikamentell behandling for HFpEF er begrenset.
Basert på en aldersjustert forekomst av hjertesvikt på 6,8% hos kvinner og 6,1% for menn fra Tromsøundersøkelsen (10), er det estimert at det lever om lag 175.000 pasienter med hjertesvikt i Norge. Hjertepoliklinikkene hadde konsultasjoner med om lag 1.500 pasienter i 2020, under 1% av pasientgrunnlaget. Selv om ikke absolutt alle hjertesviktpasienter trenger oppfølging i spesialisthelsetjenesten, viser tallene at relativt få følges på norske hjertesviktpoliklinikker. Økende behandlingskompleksitet og intensivert behandlingsoppstart ved HFrEF tilsier et større behov for velfungerende hjertesviktpoliklinikker og gode klinikere i Norge.
Oppsummering
er en økende utfordring i en aldrende befolkning. Venstresidig, kronisk hjertesvikt inndeles i tre kategorier, hjertesvikt med redusert EF, lett redusert EF og bevart EF. Retningslinjer fra European Society of Cardiology ble oppdatert i 2021 og danner grunnlaget for dagens behandlingsanbefalinger. Behandlingen med ACE-hemmer, betablokker, MRA og SGLT-2-hemmer ved HFrEF bør startes så raskt og trygt som mulig ved redusert EF. Derimot er det ikke retningslinjebasert behandling for HFpEF bortsett fra behandling av symptomer og komorbiditet. SGLT-2-hemmere har fått plass ved behandling av pasienter med HFrEF uten samtidig diabetes mellitus, og SGLT-2-hemmere er også det første medikamentet som har dokumenterbar prognostisk effekt hos pasienter med HFpEF. De oppdaterte retningslinjene for hjertesvikt er et viktig dokument, som bør leses av alle kardiologer og annet helsepersonell.
1. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021;42(36):3599-3726.
2. Halliday BP, Wassall R, Lota AS, et al. Withdrawal of pharmacological treatment for heart failure in patients with recovered dilated cardiomyopathy (TRED-HF): an open-label, pilot, randomised trial. Lancet 2019;393(10166):61-73.
3. McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med 2019;381(21):1995-2008.
4. Packer M, Anker SD, Butler J, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med 2020;383(15):1413-1424.
5. Zannad F, Ferreira JP, Pocock SJ, et al. SGLT2 inhibitors in patients with heart failure with reduced ejection fraction: a meta-analysis of the EMPEROR-Reduced and DAPA-HF trials. Lancet 2020;396(10254):819-829.
6. Køber L, Thune JJ, Nielsen JC, et al. Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure. N Engl J Med 2016;375(13):1221-1230.
7. Anker SD, Butler J, Filippatos G, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med 2021;385(16):1451-1461.
8. Vaduganathan M, Claggett BL, Jhund PS, et al. Estimating lifetime benefits of comprehensive disease-modifying pharmacological therapies in patients with heart failure with reduced ejection fraction: a comparative analysis of three randomised controlled trials. Lancet 2020;396(10244):121-128.
9. M. Grundtvig, T Eriksen-Volnes, EK Slind, et al. Norsk Hjertesviktregister – Årsrapport 2020. https://www.kvalitetsregistre.no/register/hjerte-og-karsykdommer/norsk-hjertesviktregister: 15.06.2021 2021.
10. Melbye H, Stylidis M, Solis JCA, Averina M, Schirmer H. Prediction of chronic heart failure and chronic obstructive pulmonary disease in a general population: the Tromsø study. ESC Heart Fail 2020;7(6):4139-50.