De nye T-cellebaserte immunterapiene som har kommet lengst i klinisk utvikling, er behandling for B-celle maligniteter; B-celle akutt lymfoblastisk leukemi (B-ALL), B-celle non-Hodgkins lymfom og myelomatose. Ved Oslo Universitetssykehus behandles lymfomer ved Avdeling for kreftbehandling, mens B-ALL og myelomatose behandles ved Avdeling for blodsykdommer.
Ingerid Weum Abrahamsen, overlege, PhD., Avdeling for blodsykdommer, Oslo universitetssykehus
Kimær antigenreseptor (CAR) T-celler er genmodifiserte T-celler. Genet som settes inn i pasientens T-celler koder for en kunstig reseptor. Denne består av en intracellulær del som aktiverer T-cellen og en ekstracellulær del (antistoffderivert) som kan binde et overflateprotein på kreftcellen (jf. figur nr. 1).
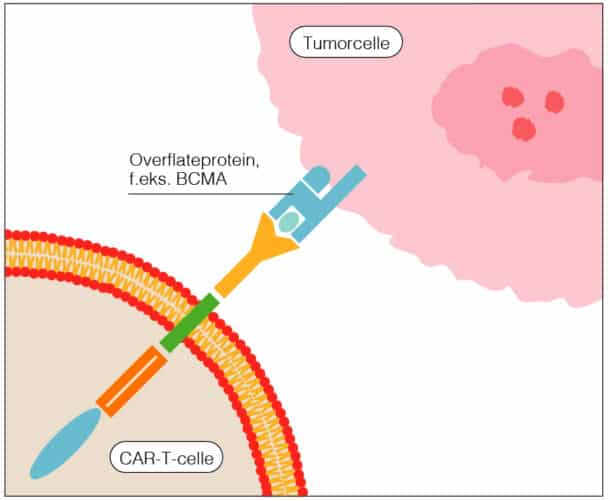
Fremstillingen av CAR-T-celler er en kompleks prosess. Først høstes T-celler fra pasienten med leukaferese. Gensekvensen for den kimære antigenreseptoren settes så inn i pasientens T-celler ex-vivo ved hjelp av virus. Etter dette er det flere skritt der man sikrer at reseptoren er satt inn i tilstrekkelig antall T-celler og at T-cellene fungerer som de skal. Fremstillingsprosessen er gitt et handelsnavn basert på gensekvensen med suffikset «cel» for å indikere cellulær terapi, f.eks. Idecabtagene vicleucel. CAR-T-celleprodukter har i tillegg ofte et kortnavn, f.eks. ide-cel.
Før pasienten får CAR-T-cellene, får de en cellegiftkur som reduserer antall lymfocytter (lymfodeplesjon) og bidrar til bedre ekspansjon av CAR-T-cellene. Etter at CAR-T cellene er gitt, er målet at de skal leve videre i pasienten og sikre vedvarende antitumor effekt. Behandlingen gis derfor vanligvis kun en gang [1].
T-celle-bispesifikke antistoffer er rekombinante antistoffer som binder CD3 på T-cellen og et overflateprotein på kreftcellen. Bindingen aktiverer T-cellen slik at den kan drepe målcellen (jf. figur nr. 2). Hvis det rekombinante antistoffet har en Fc-del, har det lengre halveringstid og kan gis ukentlig. Alternativt gis det som kontinuerlig infusjon.
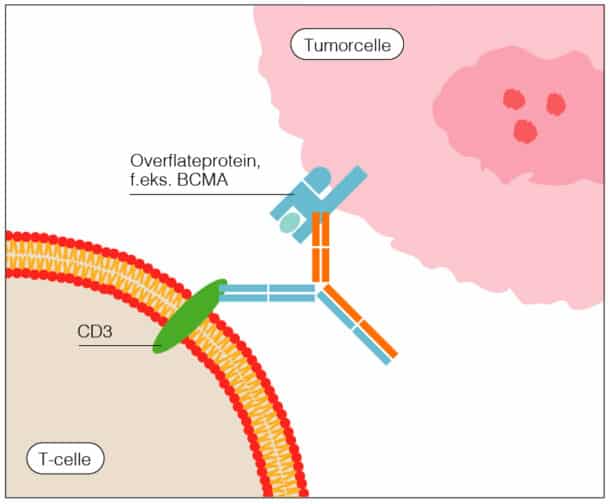
Med T-celle bispesifikke antistoffer forsøker man på samme måte som ved CAR-T behandling å oppnå T-cellemediert tumordrap. En fordel med bispesifikke antistoffer er at man unngår ressurs- og tidkrevende produksjon av pasientegne genmodifiserte celler. Ulempen er at behandlingen må gjentas regelmessig til progresjon eller til annen behandling gis (for eksempel allogen stamcelletransplantasjon ved ALL). Andelen pasienter som har effekt av behandlingen er generelt lavere enn ved CAR-T-cellebehandling [2]. (Tabell 1)
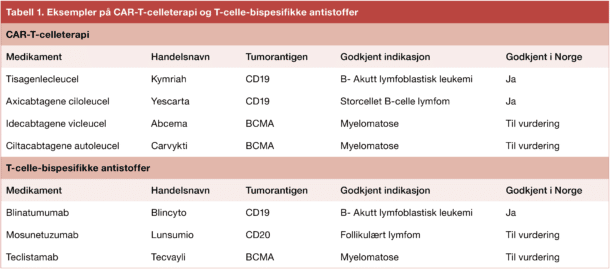
CAR-T-celler og T-celle-bispesifikke antistoffer er rettet mot overflateproteiner
For å utvikle denne type immunterapi er det nødvendig å finne overflateproteiner (antigener) som er uttrykt bare på kreftcellen, eventuelt også på celler vi kan klare oss uten. Flere B-celleantigener har vist seg svært egnede. B-ALL utrykker for eksempel CD19 og B-celle lymfomer CD19 og CD20. Effektiv immunterapi rettet mot disse antigenene vil også fjerne pasientens friske B-celler, men dette kan håndteres ved å gi intravenøs immunglobulin .
BCMA er et annet overflateprotein uttrykt på modne B-celler, plasmaceller og på myelomatoseceller. Her vil også såkalt «on target – off tumor»-effekt fjerne pasientens friske plasmaceller, noe som også kan gi hypogammaglobulinemi. De første T-cellebaserte immunterapiene er rettet mot CD19 ved ALL, CD19 og CD20 ved lymfom og BCMA ved myelomatose. Terapier rettet mot ulike andre overflateproteiner er under utprøving [1].
Komplikasjoner etter CAR-T-celler og T-celle bispesifikke antistoffer
Den mest kjente bivirkningen av T-cellerettet immunterapi er cytokinstorm (cytokine release syndrome, CRS) Både etter CAR-T-celler og bispesifikke antistoffer får flertallet av pasientene denne bivirkningen.CRS skyldes aktivering av immunforsvaret (T-celler og makrofager). Dette gir en feberreaksjon som kan utvikle seg til en alvorlig tilstand med multiorgansvikt. Diagnosen CRS stilles klinisk og oftest på basis av feber og typiske tidspunkter for CRS under slik behandling. Tilstanden kan være vanskelig å skille fra infeksjon/sepsis og noen ganger må begge tilstander behandles samtidig. CRS behandles etter alvorlighetsgrad. I tillegg til nødvendig støttebehandling, gis tocilizumab (IL-6 reseptorhemmer) og kortikosteroider.
Nevrotoksisitet er mindre hyppig og forekommer typisk under eller etter CRS. Tilstanden kan gi nedsatt konsentrasjon og forvirring. Alvorlige former kan gi redusert bevissthet og hjerneødem [3].
Immunterapi for B-akutt lymfoblastisk leukemi
CAR-T-cellebehandling for B-ALL hos barn og unge opp til 25 år, har vært godkjent i Norge siden desember 2018. Godkjenningen kom som et resultat av ELIANA-studien, der Oslo Universitetssykehus deltok som eneste senter i Norden. Studien inkluderte pasienter med tilbakefall eller refraktær akutt lymfoblastisk leukemi og 3 voksne pasienter fikk CAR-T-celler i Oslo. Studien viste ca. 80% respons, ca. 60% komplett respons og 70% var i live etter 1,5 år. Produktet heter i dag tisagenlecleucel (Kymriah) og er pasientegne CAR-T-celler rettet mot CD19 [4].
Indikasjonen for tisagenlecleucel i dag er pasienter opp til 25 år med B-ALL som er refraktær, i tilbakefall etter allogen stamcelletransplantasjon eller med to eller flere tilbakefall. For aldersgruppen mellom 18 og 25 år er det ikke mange aktuelle pasienter, men disse har i praksis få andre behandlingsalternativer.
Blinatumumab (Blincyto) er et T-celle-bispesifikt antistoff som binder CD19 og CD3. Det gis som kontinuerlig infusjon. For voksne pasienter er blinatumumab godkjent som tilbakefallsbehandling for B-ALL før allogen stamcelletransplantasjon (såkalt bro til transplantasjon). Medikamentet gis også til en gruppe pasienter som oppnår komplett remisjon med standard cellegiftbehandling, men som har forbigående tegn til restsykdom og dermed økt risiko for tilbakefall [5].
Immunterapi ved lymfomer
CD19 uttrykkes også hos flere typer B-celle lymfom. To forskjellige CAR-T produkter tisagenlecleucel (Kymriah) og Axicabtagene ciloleucel (Yescarta) har effekt ved diffust storcellet B-celle lymfom. Axicabtagene ciloleucel (Yescarta) ble nylig godkjent av Nye Metoder med indikasjonen residivert eller refraktært diffust storcellet B-cellelymfom og primært mediastinalt storcellet B-cellelymfom som har fått to eller flere linjer med systemisk behandling. Behandlingen har allerede vært i bruk i andre land i Norden i flere år. I ZUMA-1 studien oppnådde 82 % av pasientene respons. Etter 27 måneders oppfølging er median overlevelse mer enn 2 år [6].
Mosunetuzumab er et bispesifikt antistoff som binder CD20 og CD3. Hos pasienter med follikulært lymfom som hadde fått mer enn 2 tidligere behandlinger oppnådde ca. 60% av pasientene komplett respons. CRS er vanlig, men er hovedsakelig lavgradig. Mosunetuzumab er godkjent av Det europeiske legemiddelbyrået (EMA) til bruk ved follikulært lymfom som har fått minst to tidligere behandlingslinjer og er nylig innmeldt til vurdering hos Nye Metoder [7].
Immunterapi for myelomatose
Foreløpig er ikke T-cellebasert immunterapi for myelomatose godkjent i Norge. Imidlertid er to ulike CAR-T-celleprodukter (ide-cel (Abcema) og ciltacaptagene-autoleucel (cilta-cel, CarvyktiI)) og et T-celle-bispesifikt antistoff (teclistamab, Tecvayli) godkjent i USA (FDA) og av det europeiske legemiddelverket EMA. Disse produktene er innmeldt til vurdering hos Nye Metoder. I tillegg er det en rekke andre produkter i klinisk utprøving og som nærmer seg godkjenning.
Flere av disse immunterapiene for myelomatose har vært gitt til pasienter i legemiddelutprøvinger ved Avdeling for blodsykdommer, OUS. Dette er et samarbeid mellom Oslo Myelomatose Senter og Sengepost for blodsykdommer. Vi har deltatt i en fase 3 studie for utprøving av CAR-T-celleproduktet ide-cel (KarMMa-3). Ide-cel er rettet mot BCMA. 7 pasienter har fått behandling med ide-cel ved OUS. I denne studien behandlet vi pasienter som hadde progresjon etter 2-4 tidligere behandlingslinjer, inkludert bl.a. daratumumab. Nesten alle pasientene hos oss hadde effekt av behandlingen og hos om lag halvparten har denne effekten vart i over 1,5 år. Omtrent alle pasientene fikk CRS, men CRS var lavgradig og enkelt å behandle. Resultatene fra denne studien er ennå ikke publisert, mens fase 2 studien ble publisert i 2021 [8].
Vi deltar også i to studier med cilta-cel, CARTITUDE-5 og -6 (den siste er ikke åpnet ennå). Begge disse studiene tester cilta-cel for nyoppdaget myelomatose etter induksjonsbehandling, henholdsvis randomisert mot vedlikeholdsbehandling og mot høydosebehandling med autolog stamcellestøtte (HMAS). De første pasientene som skal få cilta-cel ved OUS vil trolig få behandling i starten av 2023.
Cilta-cel er godkjent av FDA og EMA på basis av CARTITUDE-1. I denne studien ble pasienter som hadde progresjon etter mer enn 3 tidligere behandlingslinjer behandlet med cila-cel. 98% av pasientene hadde effekt av behandlingen. Etter 28 måneders oppfølging er median overlevelse ikke nådd (55% progresjonsfri overlevelse og 70% total overlevelse) [9].
Teclistamab er det første T-celle bispesifikke antistoffet som er godkjent for myelomatose av FDA og EMA. Hos pasienter som hadde fått median fem tidligere behandlingslinjer, hadde 63% effekt [10].
Flere andre T-celle-bispesifikke antistoffer for myelomatose er testet ved OUS i legemiddelutprøvinger. Pasientene er vanligvis innlagt i forbindelse med de første infusjonene og får så senere infusjoner poliklinisk. Dette skyldes at risiko for CRS er størst ved de første behandlingene. Vi har nå fire slike studier som er åpne og i løpet av 2023 vil vi ha seks. Det er fem ulike bispesifikke antistoffer som skal testes.
Infeksjonskomplikasjoner etter CAR-T og T-celle-bispesifikke antistoffer
CAR-T og T-celle-bispesifikke antistoffer kan også gi langvarige cytopenier og økt infeksjonstendens. Dette er av betydning for oppfølgingen av pasientene. Vellykket B-cellerettet immunterapi gir gjerne hypogammaglobulinemi og immunglobulinsubstitusjon anbefales ved IgG < 4 g/L. Pasientene kan også ha T-celledefekter med økt risiko for reaktivering av CMV og EBV samt økt risiko for alvorlige forløp av COVID-19, influensa, RS-virus, parvovirus, adenovirus og andre virale infeksjoner.
Erfaringene så langt er at denne risikoen er større ved bispesifikke antistoffer enn ved CAR-T-celler. Man tror at dette kan forklares av at svært mange T-celler aktiveres ved bispesifikke antistoffer, mens ved CAR-T-cellebehandling er det hovedsakelig de modifiserte (CAR) T-cellene som aktiveres. Ved tegn til infeksjon hos pasienter som har fått CAR-T-celler eller bispesifikke antistoffer kan det være nødvendig med bred diagnostikk.
Pasientene kan ha også ha behov for transfusjoner og vekstfaktor (G-CSF). Pasienter som har fått behandling med CAR-T-celler og bispesifikke antistoffer, bør ha infeksjonsprofylakse for varicella zoster-reaktivering og pneumocystis jiroveci [11, 12].