De siste par år har vi opplevd et paradigmeskifte i behandling av cystisk fibrose. En ny medisin beskrives som årsakskorrigerende for en arvelig sykdom. Effekten er så stor at den også har blitt omtalt som mirakelbehandling.
Bernt Bøgvald Aarli. Overlege, Lungeavdelingen, Haukeland universitetssykehus. Førsteamanuensis, Universitetet i Bergen
Christian Lawley, Kasus
Cystisk fibrose (CF) er vår vanligste arvelige sykdom. Så når under 400 mennesker i Norge har denne diagnosen, forteller det noe om alvoret og hvordan sykdommen påvirker livslengden. Vi skal ikke mer enn noen tiår tilbake før CF ble oppfattet som en barnesykdom siden så få overlevde til voksen alder.
Sykdommen er forårsaket av mutasjon i genet CF transmembran konduktansregulator (CFTR), som koder for en klorkanal i cellemembranen. I dag får de fleste diagnosen i spedbarnsalder siden de vanligste mutasjonene er inkludert i nyfødtscreeningprogrammet. For dem som ikke fanges opp med testen, brukes svettetest hvor klorid-innholdet i svetten er diagnostisk ved verdier >60 mmol/L. Man supplerer med gentest ved gjentatte verdier over denne grense.
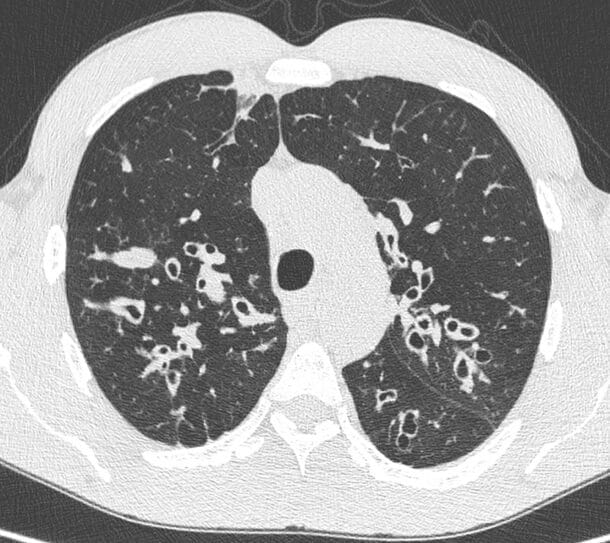
Personer med CF produserer ikke nok CFTR klorkanaler, eller de virker ikke som de skal. Dette gir opphopning av seigt slim fra slimproduserende kjertler. I lungene gir dette utslag i slimstagnasjon, økt infeksjonstendens, inflammasjon og utvikling av de cystiske bronkiektasiene som har gitt navn til sykdommen (bilde). Etter hvert faller lungefunksjonen, og det er særlig lungesykdom som begrenser livslengden.
Slimplugging i bukspyttkjertelen kan funksjonelt i stor grad oppveies med substitusjon av pankreasenzymer, men næringsopptaket blir dårligere og alle bør få tilskudd av fettløselige vitaminer. Vevsskade i bukspyttkjertelen av fordøyelsesenzymer som fanges i utførselsgangene gjør at mange med tiden utvikler en insulinkrevende diabetes.
God behandling har bedret overlevelse betraktelig. Omfattende slimmobilisering er hjørnestein i behandlingsstrategi – det seige slimet må opp og ut. Pasienter med CF har lange egenbehandlingsøkter hvor de inhalerer slimløsende midler som dornase alfa og hypertont saltvann etterfulgt av øvelser og lungefysioterapi. De behandles aggressivt med antibiotika for erradikering av luftveisinfeksjoner eller for suppresjon av luftveispatogene bakteriene når dette ikke lykkes. Disse tiltakene har hevet den forventede levealderen betraktelig, fra barneår til det den er i dag, rundt 50 år. Dette er fortsatt over 3 tiår kortere enn befolkningen ellers. Noen dør ung, mens den eldste i landet med CF har blitt over 80 år.
Denne store variasjonen skyldes delvis at noen mutasjoner i CFTR genet er alvorligere enn andre. Samtidig ser man også at to personer med samme genmutasjoner kan ha ulik sykdomsbyrde. Dessuten vil det alltid svære forskjeller fra person til person i hvor mye innsats de klarer legge i egenbehandling og fysisk aktivitet.
Genmutasjonen som dominerer i Norge er F508del, en alvorlig mutasjon som gir minimal funksjon av klorkanalen. 83% har en slik mutasjon og nær halvparten er homozygote [1]. I november 2019 ble det publisert en banebrytende studie i New England Journal of Medicine som viste frapperende effekt av Kaftrio og Kalydeco gitt til pasienter med F508del mutasjon [2]. Medisinkombinasjonen øker mengden CFTR klorkanaler som når celleoverflaten istedenfor å bli prosessert i cellen som defekt protein og sørger for at klorkanalen virker bedre ved at den klarer holde seg åpen større del av tiden. Sammenlignet med placebo fikk pasientene på Kaftrio og Kalydeco bedring av lungefunksjon, estimert ved forsert ekspirasjon ved 1 sekund (FEV1) på 14 %, en reduksjon av årlige forverringer på 63% og en signifikant forbedret livskvalitet målt ved Cystic Fibrosis Questionnaire – Revised. Ved svettetest som brukes diagnostisk for sykdommen, observerte man en gjennomsnittlig reduksjon på 42 mmol/L sammenlignet med placebo til et nivå under diagnostisk grense. Dette har ført til at man omtaler behandlingen som årsakskorrigerende.
I Danmark, hvor man raskt tok i bruk behandlingen i form av legemidlene Kaftrio og Kalydeco, kunne man bekrefte resultater i klinisk virksomhet på linje med studien, og man opplevde bedring på de fleste områder. Flere av pasientene som hadde vært så dårlige at de sto i kø for lungetransplantasjon opplevde så stor bedring at de ble tatt av listen [3].
I Norge ble det initialt gitt avslag på refusjonsøknaden, hovedsakelig begrunnet i pris hvor legemiddelselskapet Vertex initialt hadde lagt seg på et prisnivå på nesten 2,9 millioner kroner for ett års behandling, og at forhandlinger ikke hadde ført til enighet.
Skuffelsen var derfor stor både for pasientforeningen og for miljøet som behandler disse pasientene. Avslaget var absolutt og uten unntak, selv ikke for pasienter i transplantasjonskø eller for pasienter med tilsvarende alvorlig sykdom som hadde kontraindikasjoner mot lungetransplantasjon. På samme tid viste estimater fra kanadiske forskere at de nye medisinene reduserte dødelighet i CF befolkningen med hele 15% og økte overlevelsen med 9 år i snitt [4].
Pasientforeningens ansikt utad i denne saken har vært Christian Lawley som høsten 2021 startet digital pengeinnsamling under beskrivelsen: «Hjelp Christian med å få tilgang til livreddende medisiner!». På få måneder klarte han få inn den svimlende summen det kostet for 3 måneders behandling på hvit resept. Aksjonen var koordinert med mediaoppslag i TV og de større avisene. Dette ga betydelig politisk oppmerksomhet i forkant av neste metodevurdering. Hvorvidt mediapress og trykk fra opposisjonspolitikere hadde påvirkning på beslutningsprosessen, er ukjent, men april 2022 snudde beslutningsforum, og kombinasjonsbehandling med Kaftrio og Kalydeco ble godkjent fra 1. juni 2022 [5].
Erfaring fra behandling i Norge er begrenset da det bare er ett halvt år siden det ble mulig å skrive ut disse medikamentene, men som følge av aksjonen Christan satte i gang, har han brukt årsakskorrigerende behandling i over ett år. Resultatene som presenteres her viser effekt og toleranse som en kasuistikk.
Christian ble født i 1982, lenge før CF ble inkludert i nyfødtscreeningprogrammet. Diagnosen ble stilt i 6 års alder på grunnlag av luftveisplager. Christian er betydelig mer fysisk aktiv enn de fleste. Han ble norgesmester i bodyfitness i 2005. De senere år har han fokusert på kondisjonsidrett med løping og sykling for å holde seg frisk og arbeider som personlig trener og foredragsholder. Christian startet behandling med Kaftrio og Kalydeco på eget initiativ før en organisert protokoll for innføringen av behandling hadde blitt satt opp. Det ble derfor ikke utfylt livskvalitetsspørreskjema i forkant, men en rekke tester ble gjort både før og etter oppstart.
En rekke effekter er beskrevet av årsakskorrigerende behandling i oppfølgingsstudier, opplevde du noen umiddelbare effekter den første tiden etter du startet på Kaftrio og Kalydeco?
– Et par timer etter første dose kjente jeg igjen følelsen fra oppstart av Orkambi*. Jeg merket endringer i lungene etter bare 4-5 timer. Ved første “hoste anfall” etter oppstart kom slimet overraskende lett opp, men den største endringen kom en times tid etter kveldsdosen, da rant slimet enkelt opp fra lungene. Og neste dag når jeg bøyde meg fram for å knyte skolissene, regelrett rant slimet opp fra lungene og i munnen min. I løpet av de tre første dagene kom det nærmere 5-6 dl slim fra lungene uten at jeg måtte hoste eller drenere.
*En tidligere CFTR modulerende behandling med virkestoffene Lumakaftor og Ivakaftor.
Var det uproblematisk å starte behandling, eller opplevde du noen plagsomme bivirkninger av medisinen etter oppstart?
– Jeg fikk magesmerter og kontaktet CF poliklinikken, som skrev ut Movicol (mot forstoppelse). Buktrykket varte i 2-3 dager etter oppstart av Movicol.
Effekt på lungefunksjon og svetteklorid
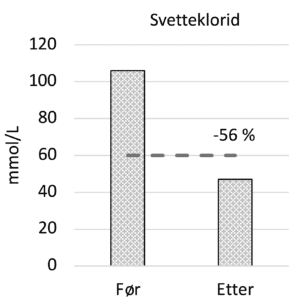
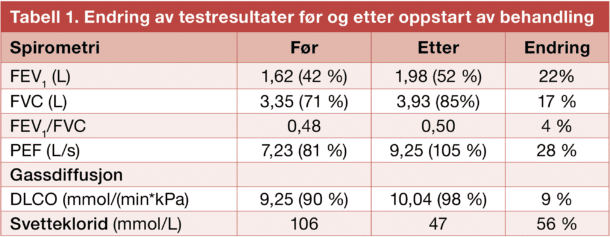
Lungefunksjon målt ved FEV1 økte fra 1,62 L til 1,98 L (22% forbedring) og FVC økte fra 3,35 til 3,93 L (17 % forbedring). Gassdiffusjon (DLCO) var normal før oppstart, en ikke-signifikant økning ble sett fra 9.25 til 10.04 mmol/(min*kPa). Ved ergospirometri økte det maksimale oksygenopptaket, V’O2 max/kg fra 33,7 til 42,0 mL/min/kg, (25% forbedring), figur 1. Svetteklorid falt fra 106 mmol/L til 47 mmol/L, tabell 1 og figur 2.
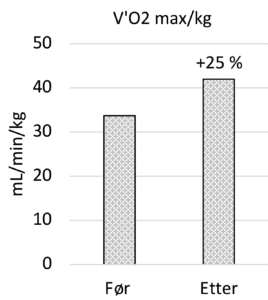
Denne kasuistikken beskriver effekten av årsakskorrigerende behandling med Kaftrio og Kalydeco hos medforfatter av artikkelen. Christian opplevde en 22% økning av FEV1 på beste spirometri tatt etter behandlingsstart sammenlignet med spirometrien før behandlingsstart. Dette er mer enn den gjennomsnittlige dokumenterte effekten. Enda større forskjell ble sett på maksimalt oksygenopptak, V’O2 maks som steg hele 25%. Maksimalt oksygenopptak angir det maksimale oksygenforbruket ved maksimal belastning og er avhengig av fysisk kondisjon. En endring i lungefunksjon med bedring i FEV1 vil dermed alene ikke kunne forklare en slik forskjell, men krever en betydelig treningsinnsats. Christian beskriver det på denne måten:
-Uken før oppstart av Kaftrio/Kalydeco klarte jeg jogge i 2 min i rolig joggetempo, tilsvarende 7,5 min/km før jeg måtte hoste og få tilbake pusten. Etter 5 dager kunne jeg løpe 16 minutter uavbrutt i 6 min/km. Da deltok jeg på trappeløpet opp Ulriken og gjorde to «løp» opp Oppstemten. I tiden etter oppstart har jeg kunnet løpe intervaller raskere enn noen gang tidligere i livet mitt. Den 15. september 2022 deltok jeg i Bergen City Milen og løp 10 km på 52,5 min, raskere enn noen gang tidligere.
Svetteklorid falt 56%, fra et høyt nivå til like under diagnostisk grense. Det er fortsatt et stykke ned til normalområdet for friske personer som regnes <30 mmol/L. Disse dramatiske forskjellene hos Christian ble sett på tross av at han allerede før oppstart sto på CFTR modulerende behandling med Lumakaftor og Ivakaftor i form av Orkambi. Ved overgang til Kaftrio/Kalydeco ble tidligere CFTR modulerende behandling seponert. Medikamentet har vært bra tolerert med unntak av forbigående magesmerter og forstoppelse som krevde behandling
Effektstudier på gruppenivå har vist betydelig effekt av årsakskorrigerende behandling ved cystisk fibrose på lungefunksjon, livskvalitet og mortalitet. Denne kasuistikken beskriver frapperende effekt på lungefunksjon og en svær forbedring i maksimalt oksygenopptak med denne behandling. De store endringene ble sett på tross av at han allerede brukte en annen type CFTR modulerende behandling før oppstart. Kombinasjonsbehandling med eleksakaftor, tezakaftor og ivakaftor regnes som årsakskorrigerende, og svetteklorid fungerer som markør på funksjonen til CFTR klorkanalen. På gruppenivå håper vi å se det samme som ble observert i Danmark, at innføring av behandlingen fjerner denne pasientgruppen fra transplantasjonskøen Vi er spent på hva behandlingen kan gjøre med forventet levealder for denne pasientgruppen i årene som kommer.