Ukontrollert astma defineres av dårlig symptomkontroll og/eller hyppige forverringer på tross av høydosert astmabehandling med inhalasjonssteroider og tilleggskontrollere. Ofte skyldes dette behandlingsbarriærer slik som manglende sykdomsforståelse, feil inhalasjonsteknikk, dårlig etterlevelse av behandling eller annen sykdom som påvirker symptombildet. En mindre andel pasienter forblir ukontrollert tross optimalisering av disse forhold. Vi kaller dette alvorlig astma.
Bernt Bøgvald Aarli, overlege, Lungeavdelingen, Haukeland universitetssykehus, førsteamanuensis, Universitetet i Bergen
Sverre Lehmann, avdelingsdirektør, Lungeavdelingen, Haukeland universitetssykehus, førsteamanuensis, Universitetet i Bergen
Astma er en folkesykdom med forekomst på 5 % estimert fra reseptforskriving i Norge.[1] De klassiske symptomene er piping fra luftveier, tungpust, tetthet for brystet og hoste. Symptomene varierer over tid og i intensitet og er ofte verre på natten eller tidlig på morgenen. Endel pasienter opplever å våkne om natten med anfall av tungpust. Mange opplever også at triggere slik som luftveisinfeksjoner, kulde, fukt, allergener eller irritanter (røyk, luftforurensing og sterke lukter) kan forverre plagene.
Inhalasjonssteroider (ICS) er bærebjelken i astmabehandling og denne medikamentgruppen har best dokumentasjon på å forhindre sykehusinnleggelse og død.[2] Som anerkjennelse av dette endret Global Initiative for Astma (GINA) retningslinjene i 2019.[3] Fra dette tidspunkt anbefales ikke lenger korttidsvirkende beta 2 agonister (SABA) som monoterapi for noen. Alle astmapasienter bør ha tilgang på ICS også ved mild sykdom eller kun anstrengelsesutløste symptomer. Førstevalget ved GINA trinn 1 er kombinasjonspreparatet formoterol/ ICS tatt ved behov. Alternativet er å gi SABA samtidig med et ICS.
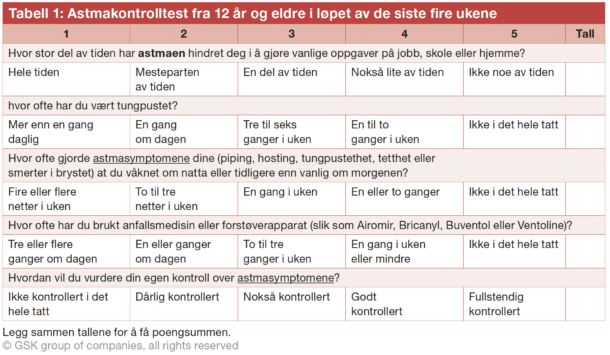
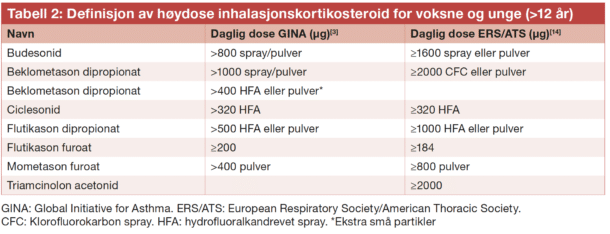
De fleste astmapasienter oppnår god sykdomskontroll på konvensjonell behandling, men regnes som ukontrollert dersom de har mye symptomer (Astmakontrolltest <20, se tabell 1), hyppige forverringer som krever perorale kortikosteroider (≥2/ år), eller om de har opplevd en forverring med sykehusinnleggelse siste år.[3] Pasienter som forblir ukontrollert tross høyt dosert astmabehandling, GINA trinn 4-5, det vil si høydose ICS (definert i tabell 2) kombinert med andre kontrollere, slik som langtidsvirkende beta 2 agonister (LABA), langtidsvirkende muskarinreseptor antagonister (LAMA), montelukast eller perorale kortikosteroider, i tillegg til pasienter med høy bivirkningsrisiko på denne behandling, bør henvises lungespesialist for vurdering med tanke på alvorlig astma.
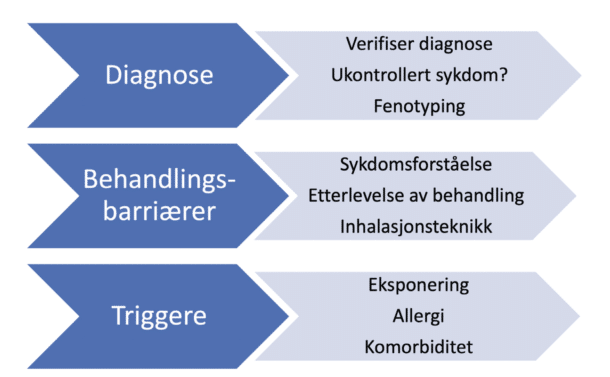
Det er helt uakseptabelt å få en så alvorlig diagnose som alvorlig astma på grunnlag av symptomer alene. Pasienten kan da gå glipp av behandling som påvirker både symptombyrde og prognose, og pasientsikkerhet settes i fare. Dersom pasienten feilaktig har mottatt en behandling med høydose ICS og gjentatte kurer med perorale kortikosteroider, innebærer dette høy risiko for bivirkninger. Når en pasient utredes hos lungespesialist under mistanke om alvorlig astma, har utredningen 3 hovedelementer (Figur 1).[4]
Det er helt uakseptabelt å få en så alvorlig diagnose som alvorlig astma på grunnlag av symptomer alene.
Ved utredning med tanke på alvorlig astma skal astmadiagnosen verifiseres med funn av variabel luftveisobstruksjon.[5, 6] Astma påvises ved spirometri med tillegg av reversibilitetstest, provokasjonstest eller variasjon i toppstrømningshastighet (peak expiratory flow/PEF) over tid eller stor variasjon i forsert ekspiratorisk volum det første sekund (FEV1) over tid, med mindre dette er forårsaket av luftveisinfeksjon.[3]
Endel får trigget inflammasjonen i luftveiene av luftveisallergener, men ikke-allergiske triggere er vanligere, slik som virus og irritanter. Allergisk astma identifiseres ved funn av spesifikt IgE i serum eller prikktest hos pasient med symptomer ved eksponering for det aktuelle allergenet. De siste årene har det dukket opp flere biologiske medisiner til bruk ved alvorlig astma. De er alle rettet mot type 2 inflammasjon. Dette er en cellemediert betennelsesprosess, som drives hovedsakelig av eosinofile celler, mastceller, basofile, Th2 hjelpeceller, gruppe 2 inate lymfoide celler og IgE produserende B-celler. En rekke cytokiner er involvert og inflammasjonen kan bremses ved å hemme IL-4, IL-5 og IL-13. Vi har i dag behandling mot både allergisk og ikke-allergisk type 2 inflammasjon. Fenotyping utføres derfor med tanke på målrettet behandling.[5]
Markører for type 2 inflammasjon er:
* hos pasient med symptomer ved relevant eksponering for allergen
Det er ikke sikkert pasienten deler legens sykdomsforståelse. Det er heller ikke sikkert at pasienten etterlever anbefalt medikamentell behandling. I tillegg til å spørre om hvordan medisinen tas, kan man få en oversikt over hva som faktisk Indremedisineren 1 • 2022 Fagartikkel er utlevert fra apotek i forskrivingsmodul for e-resept eller kjernejournal. Selv om dette nødvendigvis ikke samsvarer med forbruk, har informasjon om uekspederte resepter verdi når etterlevelse av behandling skal vurderes. Feilbruk av inhalatorer slik at de ikke leverer riktig dose er dessverre også vanlig, både hos pasienter og helsepersonell. [7, 8] Triggere må identifiseres. Hos noen kan astmaanfall utløses av acetylsalisylsyre eller NSAIDs. Til slutt må man vurdere om annen sykdom i eller utenfor luftveier bidrar til symptombildet.
De fleste pasienter som henvises til astmapoliklinikk med ukontrollert astma, viser seg å kunne oppnå god astmakontroll på konvensjonell astmabehandling etter at behandlingsbarrierene beskrevet over er håndtert. Kun 3-4% av astmapasientene har alvorlig astma.[9]
Hver konsultasjon er et møtepunkt som kan brukes til å bedre sykdomsforståelsen. Kunnskap bedrer etterlevelse og gjør pasienten bedre i stand til å unngå utløsende triggere. Pasienten må få en plan for opp-/ nedtrapping av behandlingen i forhold til astmakontroll, og hvis komorbid sykdom påvirker symptombildet, må denne diagnostiseres og behandles. Allergisanering er aktuelt for noen. Medikamentell behandling må optimaliseres. LAMA er anbefalt som tilleggsbehandling ved alvorlig astma.[5]
De fleste pasientene oppnår symptomkontroll ved optimalisering av behandling og håndtering av behandlingsbarriærer, og bærebjelken i astmabehandling er fortsatt ICS.
Monoklonalt antistoff mot IgE (omalizumab) kan vurderes hos pasienter sensibilisert mot et helårsallergen som trigger sykdommen.[ 5, 6] Ved annen type 2 inflammasjon brukes eosinofile ≥300 celler/ μl ved blodprøve som kriterium for biologiske medikamenter som blokkerer IL-5 signalveien (mepolizumab, reslizumab, benralizumab).[6] Dersom blodprøven ble tatt under behandling med perorale kortikosteroider er ≥150 celler/μl satt som grense. [6] Behandlingen fører til reduksjon av de eosinofile cellene i antall og proinflammatorisk aktivitet. Anti-IL4 behandling (dupilumab) forskrives i Norge på samme vilkår som IL-5 hemmere og fører også til redusert type 2 inflammasjon.[6] FeNO som inflammasjonsmarkør alene brukes ikke som behandlingskriterium i Norge selv om dette beskrives i GINA og brukes i våre naboland.[5, 6, 10, 11] Anti-IL4 gir fall i FeNO og man ser ofte en forbigående stigning i eosinofile. Både IL5-hemmere og anti-IL4 reduserer astmasymptomer, antall astmaforverringer og behov for perorale kortikosteroider.
Vi har i dag ingen biologisk behandling tilgjengelig mot astma med lav type 2 inflammasjon. I USA har tezepelumab, monoklonalt antistoff til thymic stromal lymfopoietin (TSLP) nylig fått godkjenning. Det knyttes forventninger til om anti-TSLP kan få en rolle i behandling av astma med lav type 2 lav inflammasjon ettersom medikamentet har vist effekt på forverringer uavhengig av inflammasjonsmarkører.[12]
Alvorlig astma har høy kostnad for samfunnet i form av sykefravær og innleggelse i sykehus. Målrettet biologisk behandling har også betydelig høyere kostnad enn de konvensjonelle inhalasjonsmedikamentene brukt i astmabehandling. For astma med høy type 2 inflammasjon drevet av eosinofile dekkes denne utgiften på H-resept av helseforetaket, hvor behandlende lege er bundet av en prioriteringsliste for aktuelle medikamenter basert på innkjøpsavtale mellom Sykehusinnkjøp HF og legemiddelselskapene etter nasjonale anbudsprosesser.
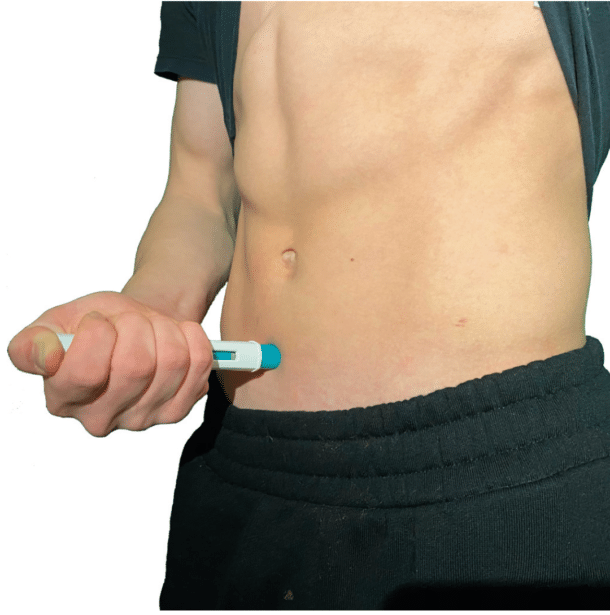
For allergisk astma dekkes antistoff mot IgE gjennom HELFO på §3. Samtlige biologiske preparater er injeksjonspreparater som tas hver 2-8 uke avhengig av type medikament, hvor behandlingen oftest foregår ved selvadministering hjemme etter pasienten har fått opplæring av helsepersonell, se figur 2.
I 2021 hadde Beslutningsforum for nye metoder gjennomgang av bronkial termoplastikk, som inntil nylig også var et behandlingsalternativ for denne pasientgruppen. Grunnet begrenset dokumentasjon ble det besluttet at bronkial termoplastikk ikke lenger skal være et behandlingstilbud i Norge.
Oppfølging av lungespesialist halvårlig eller oftere er anbefalt ved alvorlig astma. Det anbefales en kontroll 3-4 måneder etter oppstart av biologisk behandling for å vurdere toleranse. Dette tidspunkt er ofte for tidlig til å vurdere effekt. Behandlingsmålet er kontroll på symptomer og forverringer, samt nedtrapping av kortikosteroider, først perorale og deretter de høyeste doseringer av ICS. Nedtrappingsskjema for perorale kortikosteroider under dekke av biologisk behandling er etablert. [13] Ved nedtrapping av ICS anbefales det ikke å gå lavere enn til moderat dose.[5] Instruksjon i inhalasjonsteknikk bør tilbys regelmessig, og influensavaksine anbefales alle med kroniske lungesykdommer. Ved uakseptable bivirkninger eller manglende effekt, seponeres behandling hvoretter øvrige biologiske medikamenter kan vurderes.
Vi anbefaler henvisning til lungespesialist av pasienter som forblir ukontrollert med høy symptombyrde og/eller hyppige forverringer tross høydosert astmabehandling. Diagnosen må kvalitetssikres. De fleste pasientene oppnå symptomkontroll ved optimalisering av behandling og håndtering av behandlingsbarriærer, og bærebjelken i astmabehandling er fortsatt ICS. Ved alvorlig astma med type 2 inflammasjon har vi fått flere steroidsparende behandlingsalternativer med monoklonale antistoffer.